иммунодепрессивное лечение что такое
Иммуносупрессивная терапия
Для того, чтобы не произошло отторжение пересаженного органа необходимо проведение иммуносупрессивной терапии. Неверно думать, будто она полностью выключает или подавляет иммунитет, вызывает выключение защитных механизмов. Современная медикаментозная иммуносупрессия меняет иммунитет, блокируя на разных уровнях механизмы агрессии иммунитета против пересаженного органа. Действительно, состояние иммуносупрессии несколько повышает восприимчивость организма к инфекциям, в первую очередь вирусным. Кроме того, иммуносупрессивные препараты имеют некоторые особенности, которые необходимо знать как врачу, так и пациенту, который их принимает.
Важно помнить следующее. Несоблюдение рекомендаций врача пациентами после трансплантации печени создаёт угрозу жизни. Назначенная иммуносупрессивная терапия должна приниматься неукоснительно и точно до минуты и до таблетки. Человек, лукавящий, обманывающий врачей, родственников в приёме препаратов, обманывает только самого себя. Хорошее самочувствие, большой срок после трансплантации, хорошие показатели не означают, что можно самостоятельно отменить или снизить дозировку иммуносупрессивной терапии. Зная, что эксперименты на людях запрещены, мы не должны ставить экспериментов на самих себе. Перечислим основные препараты, с которыми Вы сможете столкнуться после трансплантации. Эти препараты применяются во всех странах мира. Вы можете быть уверены, что получаете такую же современную иммуносупрессию, как и пациенты в Токио, Ганновере, Нью-Йорке, Москве. Приведённые данные носят ориентирующий характер. За более подробной информацией обращайтесь, пожалуйста, к инструкции по медицинскому применению препарата, вложенной в упаковку.
Если Вы забыли своевременно принять дозу препарата или после приема таблетки Вас вырвало, примите пропущенную дозу. Однако, если уже почти наступило время для приёма следующей дозы, пропустите пропущенную дозу и продолжайте регулярный режим дозирования. Не принимайте двойную дозу, чтобы наверстать пропущенный прием. Один пропущенный прием препарата как правило не опасен, но таких пропусков должно быть как можно меньше.
Такролимус (програф, прилуксид, рединесп)
Иммуносупрессивный препарат такролимус был открыт в 1984 году как продукт жизнедеятельности грибков из почвы в Японии. Являясь макролидным антибиотиком, он обладает слабым противомикробным и противогрибковым действием, но наиболее мощным является его иммуносупрессивное действие. Широко внедрён в клиническую практику благодаря трудам отца современной трансплантологии Томаса Старзла. Химически является 23-членным макролидом. Угнетает кальциневрин, приводя к снижению выделения лимфоцитами интерлейкина-2. В настоящее время такролимус является золотым стандартом и препаратом №1 в проведении иммуносупрессивной терапии после трансплантации печени.
Этот препарат обладает рядом специфических особенностей, которые надо понимать.
Такролимус пролонгированного действия (адваграф)
Форма пролонгированного действия такролимуса полностью идентична такролимусу, однако суточная доза принимается в один прием — как правило, утром. Все предосторожности в отношении такролимуса распространяются и на данную форму.
Циклоспорин А (сандиммун неорал, экорал, панимун беорал)
Циклоспорин был открыт в 1969 году в Норвегии как продукт жизнедеятельности почвенных грибков. В 1972 году в Швейцарии открыто его действие на иммунитет. Как и такролимус, является ингибитором кальциневрина. Имеет меньшую по сравнению с такролимусом эффективность и более выраженную нефротоксичность. Так как концентрация препарата после его приёма меняется, как правило берут кровь для её определения до приёма таблеток (обычно, за 30 минут до очередного приёма) — это называется «нулевой» концентрацией или С0. Также иногда определяют концентрацию препарата на 2 часу после приёма очередной дозы — концентрацию С2. В сложных случаях концентрацию определяют несколько раз в разные сроки после приема препарата, строят кривую препарата и определяют интегральный показатель — площадь под кривой концентрации (AUC). В редких случаях прием циклоспорина повышает артериальное давление. Редким осложнением также является гиперплазия дёсен. При появлении разрастания тканей дёсен необходимо сообщить своему врачу и обратиться к стоматологу. Если у Вас имеется склонность к повышению уровня холестерина в крови, прием циклоспорина может способствовать его повышению.
Мы назначаем циклоспорин довольно редко, например, при непереносимости препаратов такролимуса
Микофенолаты: микофеноловая кислота (майфортик), микофенолата мофетил (селлсепт, майсепт, микофенолат тл)
Препараты микофеноловой кислоты имеют выраженное иммуносупрессивное действие при небольшом количествепобочных эффектов. Они подавляют фермент, синтезирующий основания для образования ДНК, за счёт чего тормозят деление Т и В лимфоцитов. У некоторых пациентов прием препаратов микофеноловой кислоты достаточно редко приводит к прокинетическому эффекту: увеличивается активность кишечника вплоть до развития диареи. При приёме этих препаратов необходимо контролировать уровень лейкоцитов, при тенденции к снижению необходимо корригировать дозировку во избежание развития инфекционных осложнений (вирусных, в первую очередь). Применение цитостатических иммуносупрессивных препаратов несколько замедляет заживление ран
Ингибиторы mTOR рецепторов: сиролимус (рапамун), эверолимус (сертикан)
Азатиоприн
Азатиоприн является классическим иммуносупрессивным препаратом, введенным в клиническую практику в 1978 году основоположником мировой трансплантации Роем Калном. Данный препарат обладает лимфостатическим действием. Превращаясь в активную форму 6-меркаптопурин, азатиоприн подавляет синтез ДНК в быстро делящихся клетках, в том числе, в Т и В лимфоцитах. Контроль концентрации этого препарата не нужен. Нужен контроль количества лейкоцитов в крови, так как азатиоприн может понижать его. Как и у других лимфостатических иммуносупрессивных препаратов, длительный приём азатиоприна может повышать риск развития некоторых опухолей, о чём нужно помнить. На фоне приёма азатиоприна редко может разиваться острый панкреатит. Несмотря на то, что в клинической практике встречаются более эффективные препараты со сходным действием, недорогой азатиоприн до сих пор имеет место в клинической практике лечения пациентов после трасплантации. Принимается два раза в день в одно и то же время.
Преднизолон, метилпреднизолон (метипред)
Глюкокортикоидные гормоны являются классическим компонентом иммуносупрессивной терапии. С их применением связаны частые страхи и домыслы. Действительно, в прошлом, когда после трансплантации глюкокортикоиды длительно применялись в больших дозировках, на этом фоне возникали такие побочные эффекты, как увеличение веса, покраснение лица, чувство «приливов» после приёма таблеток, увеличение аппетита и другие. Однако сейчас схемы снижения глюкокортикоидов претерпели значительные изменения и дозировки и сроки применения препаратов минимизированы, такие побочные эффекты выражены крайне редко. Под действием глюкокортикоидов уменьшаесмя количество лимфоцитов и уменьшается их активность. Наш центр назначает глюкокортикостероиды крайне редко. Через некоторое время мы снижаем дозировку стероидов или отменяем их приём.
Иммунодепрессанты (лекарственные препараты, подавляющие активность иммунной системы)
Иммунодепрессанты (иммуносупрессивные препараты) – это особая группа лекарственных средств, которые подавляют иммунитет.
Однако существуют ситуации, когда под влиянием определенных условий защитные иммунные механизмы приобретают извращенные черты и становятся причиной развития нежелательных реакций. К таким реакциям относят аутоиммунные заболевания и реакция отторжения трансплантата.
Аутоиммунные заболевания – это обширная группа воспалительных болезней, связанных с нарушением функции иммунной системы, при котором иммунитет начинает воспринимать собственные органы и ткани (например, щитовидную железу, поджелудочную железу, слюнные, слезные железы, нервную, мышечную, соединительную ткани, капилляры сосудов) как чужеродные объекты и активно атакует их.
Реакция отторжения трансплантата – угрожающая жизни реакция, возникающая у пациента после пересадки ему чужого органа или ткани. При этом иммунитет пациента начинает атаковать пересаженный от донора орган или ткань, принимая его за опасную чужеродную структуру.
Риск развития реакции отторжения трансплантата отсутствует только при аутотрансплантации – когда пациент является донором для самого себя (например, при пересадке кожи из одного участка тела на другой или же при трансплантации заранее отобранного и законсервированного костного мозга или стволовых клеток после тяжелой химиотерапии или лучевой терапии рака) и изотрансплантации – когда донором является однояйцевый близнец, абсолютно идентичный по генетическим и иммунологическим характеристикам пациенту.
Во всех остальных случаях реакция отторжения трансплантата без определенных мер по угнетению иммунитета неминуема.
Для этих целей и используют препараты группы иммунодепрессантов – средства, подавляющие иммунный ответ.
Показания к применению
Препараты иммунодепрессантов применяют при заболеваниях, связанных с извращенно-активным иммунитетом:
Помимо этого, отдельные иммунодепрессанты используют при тяжелом поражении почек – нефротическом синдроме на фоне гломерулонефрита или гломерулосклероза (циклоспорин, глюкокортикостероиды).
Также некоторые препараты иммунодепрессантов (цитостатики, глюкокортикостероиды, ингибиторы кальциневрина) назначают в комплексной или поддерживающей терапии злокачественных опухолей – рака крови, молочной железы, почек, легких, поджелудочной железы, лимфомах, хорионкарциномах и т.д.
Глюкокортикостероиды дополнительно используют при тяжелых аллергиях – анафилактическом шоке, ангионевротическом отёке (отёке Квинке), бронхиальной астме, атопическом дерматите; при резком падении артериального давления – кардиогенном, травматическом, токсическом шоках; при черепно-мозговой травме, отеках мозга и легких.
Фармакологическое действие
Препараты иммунодепрессантов угнетают иммунитет благодаря подавлению роста и развития иммунных клеток – Т-лимфоцитов и В-лимфоцитов, а также уменьшению образования антител.
Иммунодепрессивное и противовоспалительное действие препаратов иммунодепрессантов реализуется также за счет подавления специфических сигнальных молекул, отвечающих за «общение» клеток иммунитета – цитокинов: интерлейкинов (интерлейкина-1, интерлейкина-4, интерлейкина-6), фактора некроза опухоли-альфа.
Глюкокортикоиды также имеют выраженный противоаллергический и противовоспалительный эффекты, повышают артериальное давление (противошоковый эффект), стимулируют обезвреживающую функцию печени (антитоксический эффект).
Иммунодепрессанты группы цитостатиков, глюкокортикоиды, ингибиторы кальциневрина выраженно угнетают рост и развитие раковых клеток, оказывая дополнительно противоопухолевое действие.
Классификация иммунодепрессантов
Препараты иммунодепрессантов классифицируют на:
Иммунодепрессивное действие присуще также противомалярийным препаратам – хлорохину, гидроксихлорохину, препаратам золота – ауранофину, ауротиомалату натрия, ауротиоглюкозе.
Основы лечения препаратами иммунодепрессантов
Лечение препаратами иммунодепрессантов обычно очень длительное – составляет от нескольких месяцев до нескольких лет. Однако чаще всего эти препараты пациенту нужно принимать пожизненно (особенно в случае пересадки органов или тканей).
Препараты глюкокортикостероидов следует использовать рано утром – в промежутке времени между 6 и 7 часами утра. Такой режим помогает препаратам достичь своего максимального эффекта, а также снизить выраженность их побочного действия.
Особенности лечения препаратами иммунодепрессантов
Препараты иммунодепрессантов имеют большое количество побочных эффектов, кроме того, они значительно влияют на действие других лекарственных средств, повышая их токсичность. Поэтому иммунодепрессанты используют только по назначению и под строгим контролем врача.
Препараты иммунодепрессантов, подавляя иммунную защиту организма, делают его гораздо более чувствительным к инфекционным заболеваниям – бактериальным, вирусным, грибковым. Также иммунодепрессанты маскируют симптомы острых инфекционных заболеваний, в том числе простудных, что может привести к развитию более тяжелых состояний, например, пневмонии.
ВНИМАНИЕ! Цены актуальны только при оформлении заказа в электронной медицинской информационной системе Аптека 911. Цены на товары при покупке непосредственно в аптечных заведениях-партнерах могут отличаться от указанных на сайте!
Иммуносупрессия: диагностика и лечение
Подавление врожденной способности организма отражать болезни и инфекции известно как иммуносупрессия. Это подавление может быть результатом заболевания, которое нацелено на иммунную систему, такого как вирус иммунодефицита человека (ВИЧ) или являться следствием фармацевтических агентов, используемых для борьбы с определенными состояниями, такими как рак.
В некоторых случаях иммуносупрессия также может быть вызвана намеренно. Эта индукция может быть необходима для терапевтических вмешательств, таких как трансплантация тканей и органов, чтобы снизить риск отторжения органа.
Каковы причины иммуносупрессии?
Иммуносупрессия может быть вызвана рядом системных заболеваний. Они включают, но не ограничиваются:
В дополнение к системным болезням определенные фармацевтические препараты и терапевтические вмешательства могут также вызвать иммуносупрессию. Они включают, но не ограничиваются:
Каковы признаки и симптомы иммуносупрессии?
В целом пациенты с ослабленным иммунитетом, как правило, очень больны и подвержены инфекции обычными микроорганизмами, которые в противном случае не представляли бы угрозы для здоровых людей. Они называются оппортунистическими инфекциями и часто встречаются у людей с ослабленной иммунной системой.
Оппортунистические инфекции могут быть вызваны:
Эти микробы легко распространяются через жидкости организма, воздух или загрязненную пищу, воду, животных и предметы. Помимо того, что они физически больны, эти пациенты обычно имеют широкий диапазон нарушений в показателях общего анализа крови, которые используются для указания на инфекционную этиологию.
Инфекции у людей с ослабленным иммунитетом, как правило, длятся дольше и являются более частыми и трудными для лечения, чем инфекции у людей с нормальной иммунной системой. Эти пациенты могут иметь регулярные инфекции дыхательных путей и желудочно-кишечного тракта, а также воспаления и инфекции других внутренних органов и систем. Кроме того, у детей, страдающих иммуносупрессией, наблюдаются признаки ненормального развития и роста.
Как диагностируется и лечится иммуносупрессия?
Иммуносупрессию можно легко увидеть по отклонениям в анализе крови, особенно по количеству лейкоцитов и уровням иммуноглобулинов, которые являются белками, в первую очередь участвующими в борьбе с инфекциями.
Функциональность иммунной системы может быть установлена с помощью дальнейших тестов, которые проверяют клеточный и гуморальный иммунитет. Клеточный иммунитет может быть протестирован с помощью фагоцитарной функции и тестов активации Т-клеток.
Цель лечения иммуносупрессии заключается в том, чтобы по возможности выявить этиологию. Тогда важно агрессивно лечить и предотвращать инфекции, в то же время стимулируя иммунную систему фармакологической терапией.
Антимикробные препараты имеют первостепенное значение против инфекционных агентов. Если виновниками являются бактерии, для предотвращения дальнейшей инфекции необходим длительный курс антибиотиков, пока сила иммунной системы пациента все еще находится ниже оптимальной.
Существует несколько методов лечения, которые могут быть использованы при попытке поддержать организм человека с ослабленным иммунитетом. Такой терапией является использование иммуноглобулинов, которые вводятся внутривенно или подкожно.
Отказ от ответственности: этот контент, включая советы, предоставляет только общую информацию. Это никоим образом не заменяет квалифицированное медицинское заключение. Для получения дополнительной информации всегда консультируйтесь со специалистом или вашим лечащим врачом.
Добавьте «Правду.Ру» в свои источники в Яндекс.Новости или News.Google, либо Яндекс.Дзен
Быстрые новости в Telegram-канале Правды.Ру. Не забудьте подписаться, чтоб быть в курсе событий.
Спецагенты по борьбе с аутоиммунным воспалением: место моноклональных антител в современной ревматологии
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Вам когда-нибудь снились кошмары о том, как организм разъедает себя изнутри? А что если это становится реальностью? Именно процессы аутофагии лежат в основе развития ревматических заболеваний. В борьбе с аутоиммунным воспалением медицина слишком часто проигрывала. пока не появились они. Моноклональные антитела.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Основы нормального иммунитета и аутоиммунного процесса в доступной форме изложены на «Биомолекуле» в статье «Иммунитет: борьба с чужими и. своими» [1].
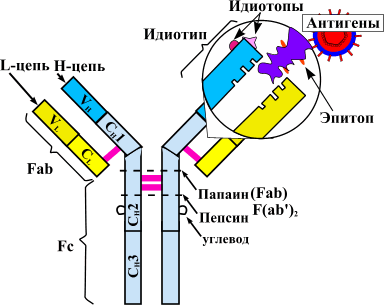
Рисунок 1. Схема строения антител. Антитела представляют собой белки-иммуноглобулины, имеющие две H-цепи (тяжелые) и две L-цепи (легкие). В каждой молекуле белка есть специфические Fab-фрагменты. Эти области отвечают за связывание с антигеном — «мишенью», на которую воздействует антитело. Структура Fab-фрагмента очень вариабельна, что позволяет ей подстраиваться под активные центры антигена — эпитопы. Между антителом и антигеном формируются химические связи (ионные, водородные, гидрофобные). Другой конец молекулы — Fc-фрагмент — отвечает за связывание образовавшихся иммунных комплексов с Fc-рецептором, расположенным на мембранах иммунных клеток (нейтрофилов, макрофагов, тучных клеток). Активация компонентов иммунитета запускает «реакцию уничтожения» по отношению к чужеродному антигену. Таким путем осуществляется антителозависимая цитотоксичность.
В 2017 году «Биомолекула» опубликовала спецпроект, посвященный аутоиммунным заболеваниям.
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
Лекарства, применяемые при ревматических болезнях
Разберемся, почему нужны новые лекарства. В качестве примера можно рассмотреть классическую терапию одного из самых распространенных аутоиммунных заболеваний — ревматоидного артрита [3]. Современные стратегии борьбы с этой патологией должны соответствовать концепции Treat to target — «лечение до достижения поставленной цели». Она направлена на ремиссию (исчезновение симптомов) заболевания или резкое снижение активности артрита [5], [6].
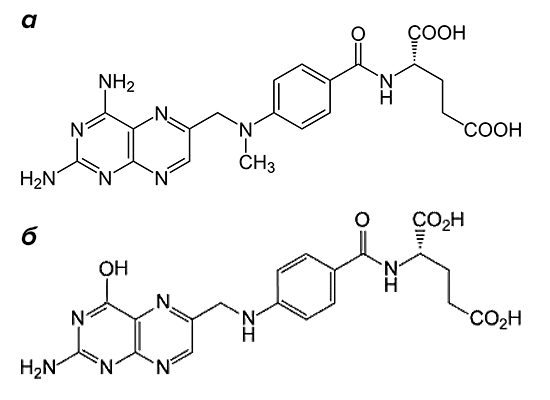
«Золотым стандартом» в терапии заболевания является метотрексат (рис. 2). Препарат входит в группу базисных противовоспалительных средств.
Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
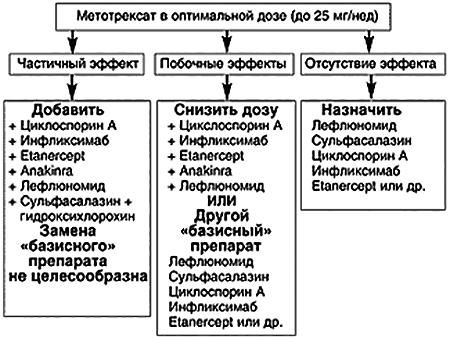
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).
Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
Иммунная система — это сложный механизм, состоящий из множества «винтиков» — иммунных клеток. Каждая из них имеет свои функции и занимает определенное место в общей структуре защитной системы. В ответ на поступление «вражеского» агента (антигена) включаются компоненты врожденного иммунитета — неспецифические факторы защиты. Это нейтрофилы, эозинофилы и базофилы, которые первыми стоят на пути у вредного воздействия.
Винтики крутятся — активируются новые компоненты иммунной системы. В борьбу с патогеном вступают Т- и В-лимфоциты. Они включают более тонкие механизмы защиты — специфическую цитотоксичность. Вырабатываются антитела, ищут себе «жертву» Т-киллеры. Тонкая регуляция процесса с помощью цитокинов позволяет быстро достигнуть поставленной цели. Согласованное действие всех компонентов иммунитета приводит к выполнению программы — уничтожению патологического агента.
Во время подбора подходящих «деталей» для механизма — при селекции лимфоцитов — неизбежно возникают ошибки. Иммунная система производит аутореактивные клоны — клетки, которые специфичны к антигенам тканей организма. В норме они отсеиваются в «мастерских» — тимусе и лимфатических узлах. Те клоны лимфоцитов, которые не различают собственные и чужеродные антигены, сразу же уничтожаются еще до того, как они приступят к выполнению своей функции. Но что происходит, если «винтики» выпадают из машины иммунитета? Поломка возникает в специфической части механизма — в работе Т- и В-лимфоцитов. При нарушении процесса селекции аутореактивные клетки выходят в кровь. Они ищут своих «жертв» и находят их в нормальных элементах собственных тканей.
В зависимости от типа реакции отличается патофизиологический процесс, лежащий в основе аутоиммунной агрессии. Т-лимфоциты могут самостоятельно убивать клетки тела, а могут и работать «чужими руками» — активировать выработку аутоантител В-лимфоцитами. При поражении В-клеточного иммунитета аутофагия реализуется через систему комплемента, а также путем формирования цитотоксических иммунных комплексов [13], [14]. Подробнее о механизмах нормального и измененного иммунного ответа можно почитать на «Биомолекуле» [1], а также в статьях [15], [16].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
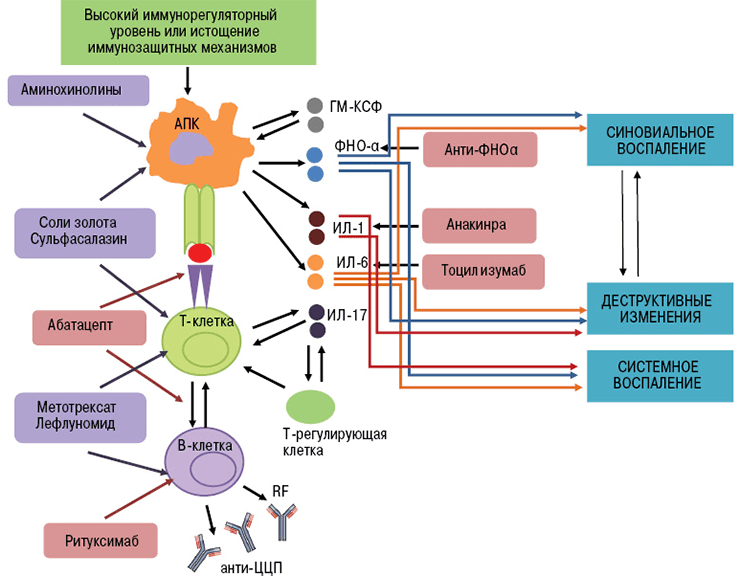
Биологические агенты воздействуют на отдельные «винтики» механизма иммунной защиты. Их мишенями могут быть цитокины и их рецепторы, мембранные молекулы лимфоцитов. В зависимости от точки приложения препарата моноклональные антитела делятся на группы (рис. 4):
Рисунок 4. Патофизиологические «жертвы» моноклональных антител — интерлейкины, ФНО, поверхностные белки лимфоцитов.
Ингибиторы ФНО
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.
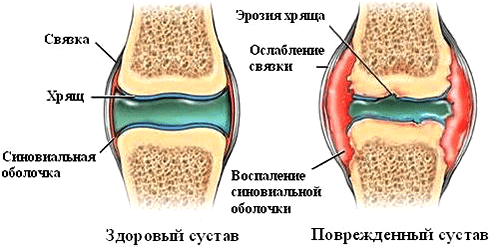
Однако влияние ФНО на суставы при ревматических заболеваниях нельзя назвать положительным. Так, при ревматоидном артрите цитокин стимулирует размножение синовиальных фибробластов — клеток оболочки сустава. Это приводит к формированию паннусов — разрастаний агрессивной ткани. С течением заболевания процесс воспаления и деструкции распространяется на суставный хрящ и подлежащие кости (рис. 5). Ткани сустава заполняются иммунными клетками — макрофагами, Т- и В-лимфоцитами, нейтрофилами. Эти механизмы лежат в основе развития хронического воспаления. Освежить знания о патогенезе ревматоидного артрита можно в статье «Ревматоидный артрит: изменить состав суставов» [3].
Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
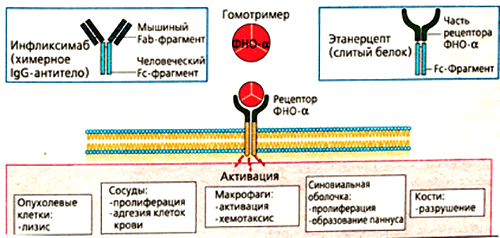
Одним из ингибиторов ФНО является препарат инфликсимаб. Он имеет «человеческую» и «мышиную» области. Примерно 25% всех аминокислот в составе моноклонального антитела получены из организма мышей. Это Fab-фрагмент — специфический участок, отвечающий за связывание с ФНО. Fc-фрагмент белка образуется из IgG1 — антитела человека.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.
Механизм действия инфликсимаба понятен из его строения. Fab-фрагмент молекулы связывает фактор некроза опухолей, образуя с ним устойчивый комплекс. Такое взаимодействие полностью блокирует активность цитокина, препятствуя его соединению с мембранными рецепторами p55 и p57. Инфликсимаб «обезвреживает» как растворимую, так и мембраноассоциированную формы ФНО (рис. 6). В клетках суставов снижается содержание и других провоспалительных факторов — ИЛ-1, ИЛ-6, монооксида азота.
Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
Немного другую структуру имеет еще один эффективный препарат из группы ингибиторов ФНО — этанерцепт. В его состав входит внеклеточная часть рецептора к фактору некроза опухолей. Она «подсоединяется» к человеческому IgG1. Гибридная молекула вступает в жесткую конкуренцию за свободный ФНО и обезвреживает его до того, как цитокин успевает связаться с рецепторами и запустить воспалительную реакцию. Дополнительное действие этанерцепта, которого нет у других ингибиторов ФНО, — это нейтрализация лимфотоксина. Это вещество тоже относится к провоспалительным цитокинам. Выработка лимфотоксина стимулирует пролиферативные процессы в суставах. Соответственно, блокировка его действия снижает активность воспаления при ревматологических заболеваниях [18].
Ингибиторы ФНО хорошо показали себя не только при лечении ревматоидного артрита, но и при других аутоиммунных патологиях. Например, у пациентов с болезнью Бехтерева широко используют новые препараты. Замедление прогрессирования патологии в этом случае очень важно, так как аутоагрессия направлена на суставные и костные образования позвоночника. С течением времени болезнь превращает позвоночный столб в «бамбуковую палку» — монолитное негнущееся образование. Анкилоз развивается постепенно, но неотвратимо. С каждым годом двигательные возможности больных становятся все более ограниченными. Применение биологических препаратов позволяет снизить активность воспаления в позвоночнике. Это замедляет процесс формирования анкилоза [19].
Блокаторы интерлейкиновых рецепторов
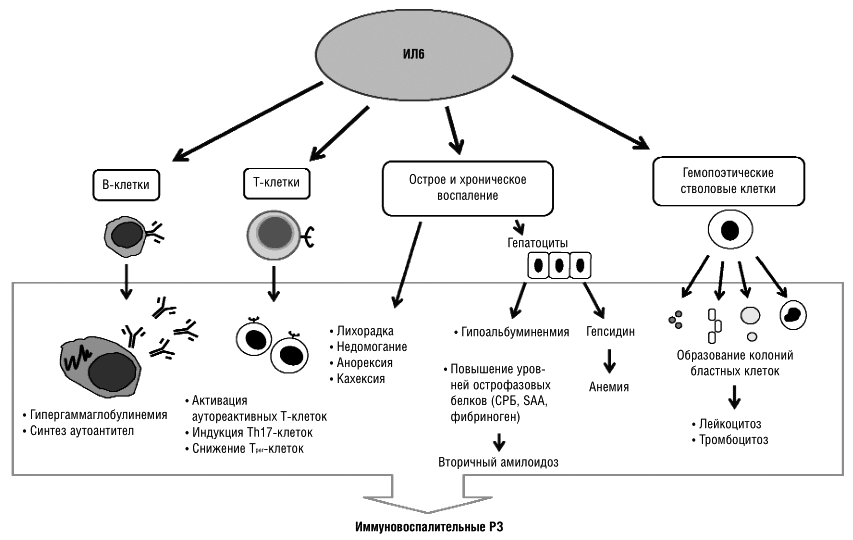
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].
Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Влияние интерлейкинов — один из «спусковых крючков» воспалительного процесса. Поэтому блокировка их активности улучшает состояние пациентов с аутоиммунными заболеваниями. Приостановить работу интерлейкинов можно, если связать их рецепторы — молекулы, передающие сигнал иммунным клеткам. На этом основан механизм действия моноклональных антител из группы ингибиторов интерлейкиновых рецепторов.
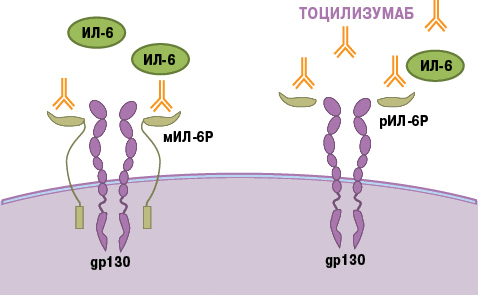
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.
Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Анти-B-клеточная терапия
Одними из главных элементов, участвующих в аутоиммунном воспалении, являются В-лимфоциты. Именно они вырабатывают аутоантитела, которые связываются со здоровыми клетками организма. Образовавшийся комплекс антитела и аутоантигена атакует система комплемента или цитотоксические лимфоциты. Этот процесс лежит в основе воспалительной реакции при таком ревматическом заболевании, как системная красная волчанка. Ей на «Биомолекуле» посвящена отдельная статья: «Системная красная волчанка: болезнь с тысячью лиц» [2].
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].
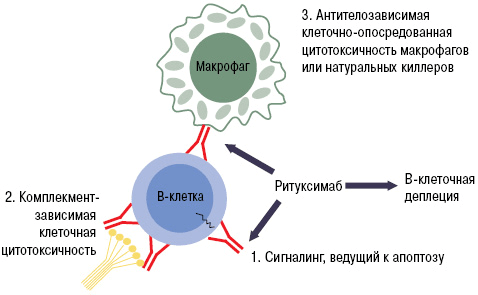
Благодаря этой особенности белок CD20 является идеальной «жертвой» для биологических препаратов. При «выключении» его активности не нарушается ни образование новых лимфоцитов, ни выработка нормальных антител. Одним из лекарств с таким механизмом действия является ритуксимаб. Моноклональное антитело связывается с молекулой CD20. Это приводит к запуску иммунологических реакций по отношению к B-лимфоцитам, которые обеспечивают разрушение (лизис) этих клеток (рис. 9).
Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Анти-Т-клеточная терапия
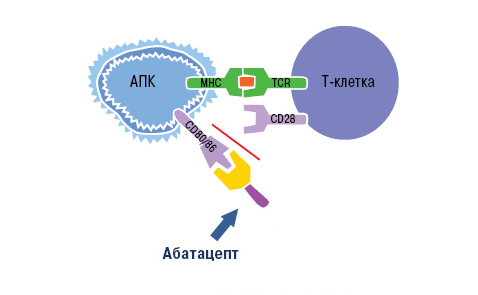
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).
Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Препараты моноклональных антител уже довольно долго используют в ревматологической практике. Однако назначают их далеко не всем — не каждому первому и даже не каждому второму пациенту. Главным ограничением, с которым сталкиваются врачи и больные, является действительно «заоблачная» стоимость препаратов этой группы. Ревматические заболевания нельзя вылечить за неделю или месяц — они требуют многолетнего (или даже пожизненного) использования терапии. Поэтому при подборе лекарственного средства важна не только его эффективность, но и цена.
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Поэтому лечение ревматических заболеваний проводят по строгим алгоритмам. При выявлении патологии пациенту назначают базисный препарат. К примеру, при ревматоидном артрите основным лекарством, вероятнее всего, станет метотрексат. Добавлять моноклональные антитела к стандартной схеме лечения врачи будут только в исключительных случаях. В России их считают препаратами резерва — дополнительными средствами, которые стоит «оставить на потом», даже несмотря на высокую эффективность. Так, если выраженность симптомов не снижается долгое время (как минимум 6 месяцев!), к метотрексату могут добавить биологический препарат. Базисная терапия при этом не отменяется.
Если заболевание изначально имеет высокую активность, быстро прогрессирует и сопровождается внесуставными осложнениями, то больному сразу могут назначить комбинированное лечение базисными средствами и моноклональными антителами. Это связано с тем, что лучше всего биологические препараты работают именно в «остром периоде», когда выраженность симптомов максимальная. Кроме того, эффект от их использования наблюдается быстрее. Лечение инфликсимабом дает результаты уже через 2–4 недели, тогда как метотрексат «включается в работу» только через несколько месяцев.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Назначение и реализация биологических препаратов контролируется государством. Многие средства из группы моноклональных антител (инфликсимаб, этанерцепт, тоцилизумаб, голимумаб) входят в «Перечень жизненно необходимых и важнейших лекарственных средств». В соответствии с ним формируется список лекарств, которые поступают в стационары по всей России. Конечно, биологические препараты сегодня есть далеко не в каждой больнице. Обычно их используют в региональных центрах или специализированных стационарах.
При неспособности обеспечить себя лекарствами пациенты получают инвалидность и проходят терапию за счет государства. Это право закреплено в действующей «Программе государственных гарантий оказания бесплатной медицинской помощи». Лечение биологическими препаратами предоставляется при ревматоидном артрите, болезни Бехтерева, СКВ, дерматополимиозите, ювенильном артрите и других заболеваниях. При этом врачи должны определить четкие показания к назначению того или иного средства. Получить дорогостоящее лечение довольно сложно — нужно пройти полное обследование, собрать документы. Однако предоставление государственной квоты для многих пациентов является последним шансом на полноценную жизнь.
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Аутоиммунные синдромы, спровоцированные введением лекарства, обычно представлены васкулитами, СКВ, антифосфолипидным синдромом, псориазом [25]. Высокой иммуногенностью обладает инфликсимаб, в составе которого есть чужеродные мышиные фрагменты. Менее активно провоцируют иммунитет полностью «человеческие» препараты. Но даже при их применении есть высокий риск развития побочных аутоиммунных реакций. Чтобы устранить эти нарушения, необходимо скорректировать схему лечения больного. В нее включают дополнительные иммуносупрессоры, которые будут подавлять осложнения. Возможно, поэтому комбинации биологических препаратов с базисными лекарствами часто более эффективны, чем изолированная терапия, пусть даже и самыми новыми средствами [24].
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.