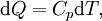закон майера утверждает что
Соотношение Майера
Для любого идеального газа справедливо соотношение Майера:

где 


Уравнение Майера вытекает из первого начала термодинамики, примененного к изобарному процессу в идеальном газе:

в рассматриваемом случае:

Очевидно, уравнение Майера показывает, что различие теплоёмкостей газа равно работе, совершаемой одним молем идеального газа при изменении его температуры на 1 K, и разъясняет смысл универсальной газовой постоянной 
Ссылки
Полезное
Смотреть что такое «Соотношение Майера» в других словарях:
Идеальный газ — Термодинамика Статья является частью одноименной сер … Википедия
ОБЛИТЕРАЦИЯ — (лат. obliteratio уничтожение), термин, употребляемый для обозначений закрытия, уничтожения той или иной полости или просвета посредством разрастания^ ткани, идущего со стороны стенок данного полостного образования. Указанное разрастание чаще… … Большая медицинская энциклопедия
Водоемкость — (по Шюблеру), влагоемкость, водоудерживающая сила (по Габерланду) или капиллярность (по Шумахеру) почвы свойство почвы принимать и задерживать в своих волосных скважинах известное количество капельножидкой воды, не позволяя последней стекать. Это … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Медицина — I Медицина Медицина система научных знаний и практической деятельности, целями которой являются укрепление и сохранение здоровья, продление жизни людей, предупреждение и лечение болезней человека. Для выполнения этих задач М. изучает строение и… … Медицинская энциклопедия
Германия — (лат. Germania, от Германцы, нем. Deutschland, буквально страна немцев, от Deutsche немец и Land страна) государство в Европе (со столицей в г. Берлин), существовавшее до конца второй мировой войны 1939 45. I. Исторический очерк … Большая советская энциклопедия
Германская Демократическая Республика — (Deutsche Demokratische Republik) ГДР (DDR). Табл. 1. Административное деление (1971)* | Округа | Площадь, | Население, | Адм. центр |… … Большая советская энциклопедия
Закон сохранения энергии — Закон сохранения энергии фундаментальный закон природы, установленный эмпирически и заключающийся в том, что для изолированной физической системы может быть введена скалярная физическая величина, являющаяся функцией параметров системы и… … Википедия
ТЕРМОДИНАМИКА — раздел прикладной физики или теоретической теплотехники, в котором исследуется превращение движения в теплоту и наоборот. В термодинамике рассматриваются не только вопросы распространения теплоты, но и физические и химические изменения, связанные … Энциклопедия Кольера
Борн, Макс — У этого термина существуют и другие значения, см. Борн. Макс Борн Max Born … Википедия
Формула Майера
Для любого идеального газа справедливо соотношение Майера:
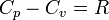
где 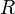
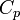
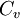
Уравнение Майера вытекает из первого начала термодинамики, примененного к изобарическому процессу в идеальном газе:
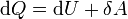
в рассматриваемом случае:
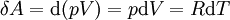
Очевидно, уравнение Майера показывает, что различие теплоемкостей газа равно работе, совершаемой одним молем идеального газа при изменении его температуры на 1 K, и разъясняет смысл универсальной газовой постоянной R — механический эквивалент теплоты.
Смотреть что такое «Формула Майера» в других словарях:
Фон Майер, Юлиус Роберт — В Википедии есть статьи о других людях с такой фамилией, см. Майер. Юлиус Роберт фон Майер нем. Julius Robert von Mayer … Википедия
Фон Майер — Фон Майер, Юлиус Роберт В Википедии есть статьи о других людях с фамилией Майер. Роберт Майер Юлиус Роберт фон Майер (нем. Julius Robert von Mayer; … Википедия
ОБЛИТЕРАЦИЯ — (лат. obliteratio уничтожение), термин, употребляемый для обозначений закрытия, уничтожения той или иной полости или просвета посредством разрастания^ ткани, идущего со стороны стенок данного полостного образования. Указанное разрастание чаще… … Большая медицинская энциклопедия
Кинетическая теория газов — Сущность ее может быть выражена в немногих словах. Согласно этой теории, газы состоят из огромного числа отдельных весьма малых частиц, двигающихся по всем возможным направлениям и со всеми возможными скоростями; частицы эти связаны между собой… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Газы — тела, характеризующиеся стремлением наполнять любое пространство и лишенные собственной формы. Учение о Г. представляет блестящую страницу современного естествознания. Казавшаяся некогда неуловимой форма тела, по понятиям древних занимавшего… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Газы тела — характеризующиеся стремлением наполнять любое пространство и лишенные собственной формы. Учение о Г. представляет блестящую страницу современного естествознания. Казавшаяся некогда неуловимой форма тела, по понятиям древних занимавшего среднее… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ТЕРМОДИНАМИКА — раздел прикладной физики или теоретической теплотехники, в котором исследуется превращение движения в теплоту и наоборот. В термодинамике рассматриваются не только вопросы распространения теплоты, но и физические и химические изменения, связанные … Энциклопедия Кольера
Чемпионат мира по футболу — англ. FIFA World Cup … Википедия
Московский государственный университет печати
Физика. Часть 1. Механика. Молекулярная физика и термодинамика
Курс лекций

Графическое изображение работы в изобарном процессе Р = const дано на рис. 37 



Все тела состоят из атомов и молекул, находящихся в непрерывном тепловом, хаотическом движении. Даже если тело в целом неподвижно и имеет нулевую потенциальную энергию, оно, тем не менее обладает энергией, связанной с внутренним движением составляющих его атомов и молекул и с их взаимодействием.
Иначе говоря, любому коллективу атомов и молекул всегда присуща некоторая внутренняя энергия. Если рассматривать внутреннюю структуру вещества, то всегда можно конкретизировать формы и носителя этой внутренней энергии. Но термодинамика сознательно отвлекается от внутренней структуры изучаемых систем. Поэтому в термодинамике внутреннюю энергию необходимо рассматривать как особую форму энергии.
Это характерное для данного состояния значение внутренней энергии зависит только от внешних параметров и от температуры. Изменение внутренней энергии системы в результате некоторого процесса (перехода системы из состояния, в котором внутренняя энергия характеризовалась значением 


Для циклического процесса, когда система, пройдя через ряд состояний, возвращается в исходное изменение внутренней энергии равно нулю 
Зависимость внутренней энергии от температуры Т всех термодинамических систем одинакова: с ростом температуры внутренняя энергия также увеличивается.
В середине 19 века исследованиями многих ученых (немецкий врач Р. Майер, английский физик Дж. Джоуль, немецкий физик Г. Гельмгольц) была твердо установлена эквивалентность теплоты и работы, т.е. возможность их сравнения и измерения в одних и тех же единицах. Тем самым была заложена основа для обобщения закона сохранения энергии на тепловые процессы.
Согласно закону сохранения энергии, энергия не возникает и не исчезает: она только переходит из одной формы в другую или от одной физической системы к другой. Первый закон (или начало) термодинамики математически выражает количественную сторону закона сохранения и превращения энергии. Его можно сформулировать следующим образом.
Изменение внутренней энергии системы 

Содержание первого закона термодинамики можно выразить и таким образом:

сообщенное системе количество теплоты равно сумме изменения внутренней энергии и совершенной системой работы (здесь совершенная системой работа 
Приведенные формулировки первого закона равнозначны утверждению о невозможности вечного двигателя, т. е. машины, совершающей работу без затрат энергии. Никакая машина не может совершить работу большую, чем полученная извне энергия (теплота).
Если рассматривать бесконечно малые приращения внутренней энергии системы dU в процессе получения элементарной теплоты 


При выводе основного уравнения молекулярно-кинетической теории мы получили следующий результат: среднее значение кинетической энергии поступательного движения молекул идеального газа равно 
При поступательном движении одноатомной молекулы число координат i (степеней свободы), которыми полностью описывается такое движение, равно трем i = 3 ( рис. 39 
У двухатомной молекулы с жесткой связью между атомами кроме поступательного движения (три степени свободы) возможно вращение (еще две степени свободы, вращение относительно оси, проходящей через атомы такой молекулы не рассматривается), поэтому число степеней свободы двухатомной молекулы равно:
Если связь между молекулами упругая и расстояние между атомами может меняться, то число степеней свободы увеличивается на единицу, т.к. возникает кроме поступательного и вращательного движений еще колебательное движение молекул:
Для многоатомной молекулы (три атома и больше) с жесткой связью число степеней свободы складывается из трех поступательных и трех вращательных:
На каждую степень свободы поступательного движения приходится средняя энергия 
Закон равного распределения молекул по степеням свободы молекул идеального газа установил Больцман и он утверждает: на каждую степень свободы молекулы приходится в среднем одинаковая кинетическая энергия, равная 


В соответствии с этим внутренняя энергия одного моля идеального газа равна

Внутренняя энергия v молей идеального газа соответственно:

Изменение внутренней энергии идеального газа

Теплоемкостью тела (системы) называется физическая величина, численно равная отношению теплоты 

Теплоемкость зависит от химического состава, массы тела, от вида процесса, в котором сообщается количество теплоты. В зависимости от процесса теплоемкость тела может меняться от 



Теплоемкость единицы массы вещества называют удельной теплоемкостью :

Теплоемкость одного моля вещества называют молярной теплоемкостью :

Связь между молярной и удельной теплоемкостями:

Чтобы теплоемкость была определена однозначно необходимо указать условия теплопередачи. Обычно различают изохорную молярную теплоемкость (изохорный процесс) и изобарную молярную теплоемкость (изобарный процесс). Соответственно их обозначают 



Используя уравнение первого закона термодинамики для одного моля ( v = 1 моль) вещества

для изохорного процесса (dV =0) получим:

Для изобарного процесса ( Р = const) из уравнения (13.4) получим

Из (13.6) связь изохорной и изобарной молярной теплоемкости имеет вид:

Как следует из уравнений (13.5) и (13.7)

Для температур, где 


Таким образом, число степеней свободы молекул зависит от температуры и классический закон о равном распределении энергии по степеням свободы молекул не является универсальным. Для многоатомных молекул выражения теплоемкостей (13.8) справедливы лишь для определенных температурных интервалов и каждому интервалу соответствует свое число степеней свободы.
При учете зависимости теплоемкости многоатомных газов от температуры при очень высоких температурах следует еще принять во внимание диссоциацию молекул (пунктирная кривая на рис. 40 

Классическая теория приводит к выводу, что молярные теплоемкости всех твердых тел одинаковые, не зависят от температуры. Этот теоретический результат согласуется с установленным экспериментально законом Дюлонга и Пти, по которому молярные теплоемкости всех твердых тел приблизительно одинаковы и составляют около 25 Дж/ (моль К).
Адиабатическим называют процесс, протекающий в системе, без теплообмена ( 

Адиабатический процесс играет большую роль в технике. При работе тепловых машин (паровые машины, двигатели внутреннего сгорания), где движение поршня совершается с большой скоростью, расширение и сжатие газа происходят адиабатически на некоторых участках полного рабочего цикла.
Из первого закона термодинамики для адиабатического процесса:




С учетом уравнения (13.7) выразим
Тогда уравнение (13.10) можно представить в виде




Показатель адиабаты 



Показатель адиабаты 

Графики адиабатического процесса в координатах ( P,V ) и изотермического процесса изображены на рис. 41 
Если вычислить тангенс угла наклона адиабаты и изотермы для точки пересечения графиков О, то можно увидеть, что у адиабаты он в 
1. Что изучает термодинамика? В чем состоят особенности термодинамики как теории?
2. Что такое равновесное состояние?
3. Сформулируйте первое начало термодинамики.
4. Чему равна работа, совершаемая 1 молем идеального газа в ходе расширения при неизменной температуре Т = 300 К, в результате которого объем увеличился в 4 раза?
5. Что такое молярная теплоемкость?
6. Как связаны между собой изохорная молярная теплоемкость и изобарная молярная теплоемкость?
7. Каков физический смысл универсальной газовой постоянной?
8. Что такое адиабатный процесс? Каким уравнением описывается изменение термодинамических параметров в этом процессе?
© Центр дистанционного образования МГУП