селективный агонист что это
Агонисты и антагонисты рецепторов
Агонисты и антагонисты [ править | править код ]
Агонист (рис. А) имеет сродство к рецептору, видоизменяет рецепторный белок, что в свою очередь влияет на функции клетки («внутренняя активность»). Биологическая эффективность агонистов, т. е. их влияние на функции клетки, зависит от того, насколько активация рецепторов может повлиять на передачу сигнала в клетке.
Рассмотрим два агониста А и В (рис. Б). Агонист А может вызвать максимальный эффект даже при связывании части рецепторов. Агонист В с таким же сродством, но с ограниченной способностью активировать рецептор (ограниченная внутренняя активность) и влиять на передачу сигнала может связываться со всеми рецепторами, но вызывает лишь ограниченный эффект, т. е. проявляет ограниченную эффективность. Агонист В является частичным агонистом. Потенциал агониста характеризуется концентрацией ЕС50, при которой достигается половина максимального эффекта.
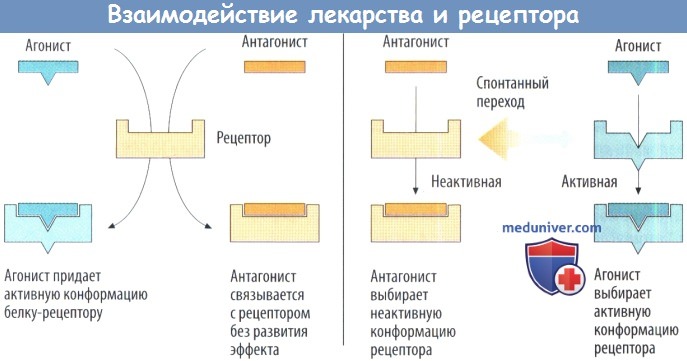
Антагонисты (А) ослабляют действие агонистов: они влияют «антагонистически». Полные антагонисты имеют сродство к рецепторам, однако их связь не приводит к изменению клеточной функции (отсутствие внутренней активности). При одновременном применении агониста и полного антагониста результат их конкурентного действия определяется сродством и концентрацией каждого из этих веществ. Так, при повышении концентрации агониста, несмотря на противодействие антагониста, может быть достигнут полный эффект (рис. В): т. е. в присутствии антагониста кривая концентрация агониста — эффект смещается вправо по абсциссе к более высоким значениям концентрации. Модель молекулярного механизма действия агонистов/антагонистов (А)
Агонист вызывает переход в активную конформацию. Агонист присоединяется к неактивному рецептору и способствует его переходу в активную конформацию. Антагонист присоединяется к неактивному рецептору, при этом не меняя его конформацию.
Агонист стабилизирует спонтанно возникающую активную конформацию. Рецептор может спонтанно перейти в активную форму. Однако статистическая вероятность такого события очень мала. Агонист селективно присоединяется к рецепторам, находящимся в активной конформации, и поддерживает это состояние рецептора. Антагонист обладает сродством к «неактивным» рецепторам и поддерживает их конформацию. Если спонтанная активность рецептора практически отсутствует, то введение антагониста не приводит к значимому эффекту. Если система имеет высокую спонтанную активность, антагонист оказывает действие, противоположное действию агониста: обратный агонист. «Истинный» антагонист без внутренней активности имеет одинаковое сродство как к активному, так и к неактивному рецептору и не влияет на исходную активность клетки. Частичный агонист не только селективно присоединяется к активному рецептору, но может частично связываться с неактивной формой. Другие формы антагонистического действия
Аллостерический антагонизм. Антагонист присоединяется к рецептору вне зоны присоединения агониста и снижает сродство агониста к этому рецептору. При аллостерическом синергизме сродство агониста усиливается.
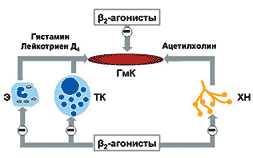
Функциональный антагонизм. Два агониста посредством разных рецепторов влияют на один и тот же параметр (например, просвет бронхов) в противоположных направлениях (адреналин вызывает расширение, гистамин — сужение).
Селективный агонист что это
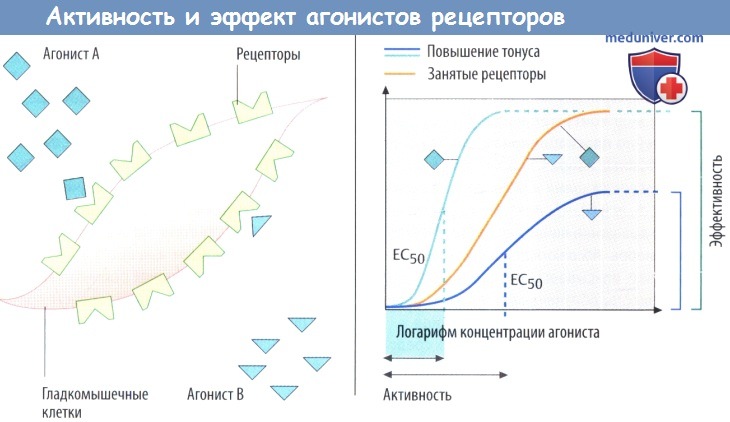
Агонисты способны прикрепляться к белкам-рецепторам, изменяя функцию клетки, т. е. обладают внутренней активностью. Биологический эффект агониста (т. е. изменение функции клетки) зависит от эффективности внутриклеточной передачи сигнала в результате активации рецептора. Максимальный эффект агонистов развивается уже тогда, когда связанной оказывается только часть доступных рецепторов.
Другой агонист, обладающий такой же аффинностью, но меньшей способностью активировать рецепторы и соответствующую внутриклеточную передачу сигнала (т. е. обладающий меньшей внутренней активностью), вызовет менее выраженный максимальный эффект, даже если связанными окажутся все рецепторы, т. е. имеет меньшую эффективность. Агонист В является частичным агонистом. Активность агонистов характеризуется концентрацией, при которой достигается половина максимального эффекта (EC50).
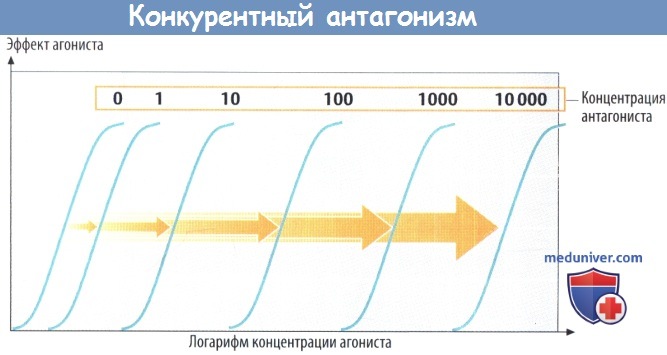
Антагонисты ослабляют эффект агонистов, противодействуя им. Конкурентные антагонисты обладают способностью связываться с рецепторами, но при этом функция клетки не изменяется. Другими словами, они лишены внутренней активности. Находясь в организме одновременно, агонист и конкурентный антагонист соперничают за связывание с рецептором. Химическое сродство и концентрация обоих соперников определяют, кто будет связываться активнее: агонист или антагонист.
Увеличивая концентрацию агониста, можно преодолеть блок со стороны антагониста: в этом случае кривая зависимости эффекта от концентрации сдвигается вправо, к более высокой концентрации с сохранением максимальной эффективности препарата.
Модели молекулярных механизмов действия агонистов и антагонистов
Агонист вызывает переход рецептора в активированную конформацию. Агонист связывается с рецептором в неактивированной конформации и вызывает его переход в активированное состояние. Антагонист прикрепляется к неактивному рецептору, не изменят его конформацию.
Агонист стабилизирует спонтанно появившуюся активированную конформацию. Рецептор способен спонтанно переходить в состояние активированной конформации. Однако обычно статистическая вероятность такого перехода настолько мала, что спонтанное возбуждение клеток определить не удается. Селективное связывание агониста происходит только с рецептором в активированной конформации и тем самым благоприятствует этому состоянию.
Антагонист способен связываться с рецептором, находящимся только в неактивном состоянии, продлевая его существование. Если у системы невысокая спонтанная активность, добавление антагониста не оказывает особого влияния. Однако, если система демонстрирует выэсокую спонтанную активность, антагонист может вызывать эффект, противоположный эффекту агониста, — такназываемый обратный агонист. «Истинный» агонист без внутренней активности (нейтральный агонист) обладает одинаковой аффинностью к активированным и неактивированным конформациям рецептора и не изменяет базальную активность клетки.
Согласно этой модели, частичный агонист обладает меньшей селективностью по отношению к активированному состоянию: однако в некоторой степени он связывается также с рецептором в неактивированном состоянии.
Другие виды антагонизма. Аллостерический антагонизм. Антагонист связывается за пределами места прикрепления агониста к рецепторуи вызывает снижениеаффинностиагони-ста. Последняя нарастает в случае аллостерического синергизма.
Функциональный антагонизм. Два агониста, действующие через различные рецепторы, изменяют одну и ту же переменную (диаметр бронхов) в противоположных направлениях (адреналин вызывает расширение, гистамин — сужение).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
b2-агонисты: роль и место в лечении бронхиальной астмы
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Государственный институт усовершенствования врачей МО РФ, Москва
Терапия бронхиальной астмы (БА) может быть условно разделена на два основных направления. Первое – симптоматическая терапия, быстро и эффективно купирующая бронхоспазм, ведущий клинический симптом БА. Второе – противовоспалительная терапия, способствующая модификации главного патогенетического механизма заболевания, а именно, воспаления слизистой дыхательных путей (ДП) [1].
Терапия бронхиальной астмы (БА) может быть условно разделена на два основных направления. Первое – симптоматическая терапия, быстро и эффективно купирующая бронхоспазм, ведущий клинический симптом БА. Второе – противовоспалительная терапия, способствующая модификации главного патогенетического механизма заболевания, а именно, воспаления слизистой дыхательных путей (ДП) [1].
Центральное место среди средств симптоматического контроля БА, очевидно, занимают b 2–агонисты, характеризующиеся выраженной бронхолитической активностью (и бронхопротективным действием) и минимальным числом нежелательных побочных явлений при их правильном использовании.
Краткая история b 2 –агонистов
История применения b –агонистов в XX веке – это последовательная разработка и внедрение в клиническую практику лекарственных средств со все более возрастающей b 2–адренергической селективностью и увеличивающейся продолжительностью действия.
Впервые симпатомиметик адреналин (эпинефрин) был использован в лечении больных БА в 1900 г. [2]. Поначалу адреналин широко применялся как в инъекционной форме, так и в виде ингаляций. Однако неудовлетворенность врачей кратковременностью действия (1–1,5 ч), большим количеством негативных побочных эффектов препарата явилась стимулом к дальнейшему поиску более «привлекательных» лекарственных средств.
В 1940 г. появился изопротеренол – синтетический катехоламин. Он разрушался в печени так же быстро, как и адреналин (при участии фермента катехол–о–метилтрансферазы – КОМТ), и поэтому характеризовался небольшой продолжительностью действия (1–1,5 ч), а образующиеся в результате биотрансформации изопротеренола метаболиты (метоксипреналин) обладали b –адреноблокирующим действием. В то же время изопротеренол был свободен от таких нежелательных явлений, присущих адреналину, как головная боль, задержка мочи, артериальная гипертензия и др. Изучение фармакологических свойств изопротеренола привело к установлению гетерогенности адренорецепторов [3]. По отношению к последним адреналин оказался универсальным прямым a – b –агонистом, а изопротеренол – первым короткодействующим неселективным b –агонистом [2].
Первым селективным b 2–агонистом стал появившийся в 1970 г. сальбутамол, характеризовавшийся минимальной и клинически незначимой активностью в отношении a – и b 1–рецепторов. Он по праву приобрел статус «золотого стандарта» в ряду b 2–агонистов. За сальбутамолом последовало внедрение в клиническую практику других b 2–агонистов (тербуталин, фенотерол и др.). Эти препараты оказались столь же эффективны в качестве бронхолитиков, как и неселективные b –агонисты, поскольку бронхолитический эффект симпатомиметиков реализуется только через b 2–адренорецепторы. Вместе с тем b 2–агонисты демонстрируют существенно менее выраженное стимулирующее воздействие на сердце (батмотропное, дромотропное, хронотропное) по сравнению с b 1– b 2–агонистом изопротеренолом [4].
Некоторые различия в селективности b 2–агонистов не имеют серьезного клинического значения. Большая частота нежелательных кардиоваскулярных эффектов при приеме фенотерола (по сравнению с сальбутамолом и тербуталином) может быть объяснена большей эффективной дозой препарата и, отчасти, более быстрой системной абсорбцией. У новых препаратов сохранилось быстродействие (наступление эффекта в первые 3–5 минут после ингаляции), характерное для всех предшествующих b –агонистов при заметном увеличении продолжительности их действия до 4–6 часов (менее выраженном при тяжелой БА). Это улучшало возможности контроля за симптомами БА в течение дня, но «не спасало» от ночных приступов [4,5].
Появившаяся возможность приема отдельных b 2–агонистов внутрь (сальбутамол, тербуталин, формотерол, бамбутерол) в некоторой степени решала проблему контроля ночных приступов БА. Однако необходимость принимать значительно более высокие дозы (почти в 20 раз больше, чем при ингаляционном применении) способствовала появлению нежелательных явлений, связанных со стимуляцией a – и b 1–адренорецепторов. Кроме того, была выявлена и более низкая терапевтическая эффективность этих препаратов [5].
Значительно изменило возможности терапии БА появление пролонгированных ингаляционных b 2–агонистов – сальметерола и формотерола. Первым появился на рынке сальметерол – высокоселективный b 2–агонист, демонстрирующий продолжительность действия, по крайней мере, в течение 12 часов, но с медленным началом действия. Вскоре к нему «присоединился» формотерол, также являющийся высокоселективным b 2–агонистом с 12–часовым действием, но со скоростью развития бронходилатационного эффекта, аналогичной таковой сальбутамола [4]. Уже в первые годы применения пролонгированных b 2–агонистов было отмечено, что они способствуют урежению обострений БА, уменьшению количества госпитализаций, а также снижению потребности в ингаляционных кортикостероидах (ИГКС).
Наиболее эффективным путем введения лекарственных препаратов при БА, в том числе и b 2–агонистов, признан ингаляционный. Важными преимуществами этого пути являются возможность непосредственной доставки лекарственных препаратов к органу–мишени (что в значительной степени обеспечивает быстродействие бронходилататоров) и минимизация нежелательных эффектов. Из известных в настоящее время средств доставки наиболее часто используются дозированные аэрозольные ингаляторы (ДАИ), реже дозированные порошковые ингаляторы (ДПИ) и небулайзеры. Пероральные b 2–агонисты в виде таблеток или сиропов применяются крайне редко, главным образом как дополнительное средство при частых ночных симптомах БА или высокой потребности в ингаляционных короткодействующих b 2–агонистах у больных, получающих высокие дозы ИГКС (эквивалентные 1000 мкг беклометазона в сутки и более) [1,6,7].
Механизмы действия b 2 –агонистов
b 2–агонисты вызывают бронходилатацию в первую очередь в результате непосредственной стимуляции b 2–адренорецепторов гладких мышц ДП. Доказательства этого механизма были получены как in vitro (при воздействии изопротеренола происходило расслабление бронхов человека и отрезков легочной ткани), так и in vivo (быстрое падение сопротивления ДП после ингаляций бронхолитика) [8].
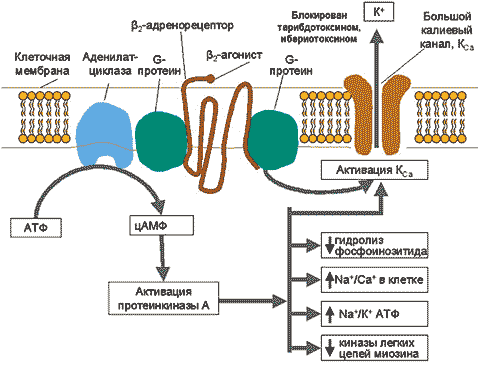
Стимуляция b –адренорецепторов приводит к активации аденилатциклазы, образущей комплекс с G–протеином (рис.1), под воздействием которого повышается содержание внутриклеточного циклического аденозин–3,5–монофосфата (цАМФ). Последнее приводит к активации специфической киназы (протеинкиназы А), которая фосфорилирует некоторые внутриклеточные белки, в результате чего происходит снижение внутриклеточной концентрации кальция (активное его «перекачивание» из клетки во внеклеточное пространство), тормозится гидролиз фосфоинозитида, ингибируются киназы легких цепей миозина и, наконец, «открываются» большие кальций–активируемые калиевые каналы, обусловливающие реполяризацию (расслабление) гладкомышечных клеток и секвестрацию кальция во внеклеточное депо. Нужно сказать, что b 2–агонисты могут связываться с калиевыми каналами и непосредственно вызывать релаксацию гладкомышечных клеток независимо от повышения внутриклеточной концентрации цАМФ [5,9].
b 2–агонисты рассматриваются как функциональные антагонисты, обусловливающие обратное развитие бронхоконстрикции вне зависимости от имевшего место констрикторного воздействия. Это обстоятельство представляется чрезвычайно важным, поскольку многие медиаторы (медиаторы воспаления и нейротрансмиттеры) обладают бронхоконстрикторным действием.
В результате воздействия на b –адренорецепторы, локализующиеся в различных отделах ДП (табл. 1), выявляются дополнительные эффекты b 2–агонистов, которые объясняют возможность профилактического использования препаратов. В их числе угнетение высвобождения медиаторов из клеток воспаления, уменьшение проницаемости капилляров (предотвращение развития отека слизистой бронхов), угнетение холинергической передачи (уменьшение холинергической рефлекторной бронхоконстрикции), модуляция продукции слизи подслизистыми железами и, следовательно, оптимизация мукоцилиарного клиренса (рис. 2).
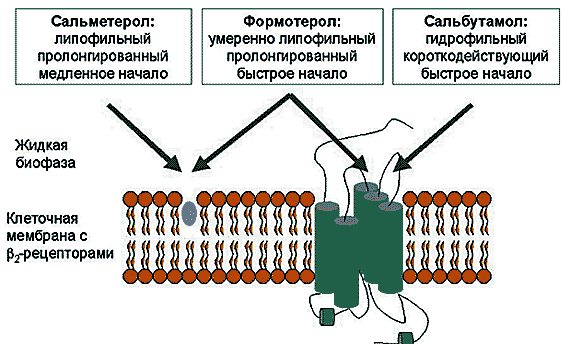
Согласно микрокинетической диффузионной теории G.Andersen [10], продолжительность и время начала действия b 2–агонистов связаны с их физико–химическими свойствами (в первую очередь липофильностью/гидрофильностью молекулы) и особенностями механизма действия. Сальбутамол – гидрофильное соединение. Попадая в водную среду внеклеточного пространства, он быстро проникает в «сердцевину» рецептора и после прекращения связи с ним удаляется путем диффузии (рис. 3). Сальметерол, созданный на основе сальбутамола, высоко липофильный препарат, быстро проникает в мембраны клеток дыхательных путей, выполняющих функцию депо, и затем медленно диффундирует через мембрану рецептора, обусловливая его длительную активацию и более позднее начало действия. Липофильность формотерола меньше, чем у сальметерола, поэтому он образует депо в плазматической мембране, откуда диффундирует во внеклеточную среду и затем одновременно связывается с b –адренорецептором и липидами, что обусловливает и быстроту наступления эффекта, и увеличение его продолжительности [7] (рис. 3). Продолжительный эффект сальметерола и формотерола объясняется их способностью длительное время находиться в бислое клеточных мембран гладкомышечных клеток в непосредственной близости от b 2–адренорецепторов и взаимодействовать с последними.
Рис. 3. Механизм действия b 2-агонистов [10] (объяснения в тексте)
При исследовании in vitro спазмированная мышца расслабляется быстрее при добавлении формотерола, нежели сальметерола. Это подтверждает то, что сальметерол является частичным агонистом b 2–рецепторов относительно формотерола [5].
Селективные b 2–агонисты представляют из себя рацемические смеси (50:50) двух оптических изомеров – R и S. Установлено, что фармакологическая активность R–изомеров в 20–100 раз выше, чем S–изомеров. Показано, что R–изомер сальбутамола проявляет свойства бронхолитика. [11] В то же время S–изомер проявляет прямо противоположные свойства: провоспалительное действие, увеличение гиперреактивности ДП, усиление бронхоспазма, кроме того, он значительно медленнее метаболизируется. Недавно был создан новый препарат, содержащий только R–изомер (левалбутерол). Он существует пока только в растворе для небулайзеров и имеет лучший терапевтический эффект, чем рацемический сальбутамол [12], так как эквивалентный эффект левалбутерол демонстрирует в дозе, равной 25% рацемической смеси (нет противодействующего S–изомера, уменьшено и количество нежелательных явлений) [12,13].
Селективность b 2 –агонистов
Цель применения селективных b 2–агонистов состоит в том, чтобы обеспечить бронходилатацию и при этом избежать нежелательных явлений, индуцируемых стимуляцией a – и b 1–рецепторов. В большинстве случаев умеренное применение b 2–агонистов не ведет к развитию нежелательных эффектов. Однако селективность не может полностью устранить риск их развития, и тому есть несколько объяснений.
Прежде всего, селективность к b 2–адренорецепторам всегда относительна и дозозависима. Незначительная активация a – и b 1–адренорецепторов, незаметная при обычных среднетерапевтических дозах, становится клинически значимой при увеличении дозы препарата или частоты его приема в течение дня. Дозозависимый эффект b 2–агонистов необходимо учитывать при лечении обострений БА, особенно жизнеугрожающих состояний, когда повторные ингаляции в течение короткого времени (нескольких часов) в 5–10 раз превышают допустимую суточную дозу. [2, 5]
b 2–рецепторы широко представлены в ДП (табл. 1). Плотность их увеличивается по мере уменьшения диаметра бронхов, а у больных БА плотность b 2–рецепторов в дыхательных путях выше, чем у здоровых. Многочисленные b 2–адренорецепторы найдены на поверхности тучных клеток, нейтрофилов, эозинофилов, лимфоцитов [14]. И в то же время b 2–рецепторы находят в разнообразных тканях и органах, особенно в левом желудочке, где они составляют 14% всех b –адренорецепторов, и в правом предсердии – 26% всех b –адренорецепторов [11]. Стимуляция этих рецепторов может привести к развитию нежелательных явлений, включая тахикардию, трепетание предсердий и ишемию миокарда. Стимуляция b 2–рецепторов скелетных мышц может вызвать мышечный тремор. Активация больших калиевых каналов может способствовать развитию гипокалиемии и, как следствие этого – удлинению интервала QT и нарушениям сердечного ритма, в т.ч. фатальным. При системном введении больших доз препаратов могут наблюдаться метаболические эффекты (увеличение уровня свободных жирных кислот в сыворотке крови, инсулина, глюкозы, пирувата и лактата) [5].
При стимуляции сосудистых b 2–рецепторов развивается вазодилатация и возможно снижение диастолического артериального давления. Особенно выражены нежелательные кардиальные эффекты в условиях тяжелой гипоксии во время обострений БА – увеличение венозного возврата (особенно в положении ортопноэ) может вызвать развитие синдрома Bezold–Jarisch с последующей остановкой сердца [15].
Связь между b 2 –агонистами и воспалением в ДП
В связи с широким использованием b 2–агонистов короткого действия, а также внедрением в клиническую практику пролонгированных ингаляционных b 2–агонистов стал особенно актуальным вопрос о том, обладают ли эти препараты противовоспалительным действием. Несомненно, противовоспалительным эффектом b 2–агонистов, способствующим модификации острого воспаления бронхов, можно считать угнетение высвобождения медиаторов воспаления из тучных клеток и уменьшение проницаемости капилляров. В то же время при биопсии слизистой бронхов больных БА, регулярно принимающих b 2–агонисты, было установлено, что число клеток воспаления, в т.ч. и активированных (макрофаги, эозинофилы, лимфоциты) не уменьшается [5, 16].
При этом теоретически регулярный прием b 2–агонистов может даже привести к усугублению воспаления в ДП. Так, обусловливаемая b 2–агонистами бронходилатация позволяет осуществить более глубокий вдох, результатом чего может стать более массивная экспозиция аллергенов.
Кроме того, регулярное применение b 2–агонистов может маскировать развивающееся обострение, тем самым задерживая начало или усиление истинной противовоспалительной терапии.
Потенциальный риск использования b 2 –агонистов
Частое регулярное применение ингаляционных b 2–агонистов может привести к развитию толерантности (десенситизации) к ним. Накопление цАМФ способствует переходу рецептора в неактивное состояние. Чрезмерно интенсивная стимуляция b –адренорецепторов способствует развитию десенситизации (уменьшению чувствительности рецепторов в результате разобщения рецептора с G–протеином и аденилатциклазой) [14]. При сохранении избыточной стимуляции уменьшается число рецепторов на поверхности клетки («down»–регуляция). Нужно отметить, что b –рецепторы гладких мышц ДП имеют довольно значительный резерв и поэтому они более устойчивы к десенситизации, чем рецепторы нереспираторных зон (например, скелетной мускулатуры или регулирующие метаболизм). Установлено, что у здоровых лиц быстро развивается толерантность к высоким дозам сальбутамола, а к фенотеролу и тербуталину – нет. Вместе с тем у больных БА толерантность к бронхолитическому эффекту b 2–агонистов появляется редко, гораздо чаще развивается толерантность к их бронхопротективному действию.
Уменьшение бронхопротективного действия b 2–агонистов при их регулярном, частом применении в равной степени касается и короткодействующих, и пролонгированных препаратов даже на фоне базисной терапии ингаляционными кортикостероидами. В то же время речь идет не о полной потере бронхопротекции, а о небольшом снижении ее первоначального уровня. H.J.van der Woude et al. [17] установили, что на фоне регулярного применения больными БА формотерола и сальметерола бронхолитический эффект последних не снижается, бронхопротективное действие оказывается выше у формотерола, но при этом значительно меньше выражено бронхолитическое действие сальбутамола.
Десенситизация развивается длительно, в течение нескольких дней или недель, в отличие от тахифилаксии, которая развивается очень быстро и не связана с функциональным состоянием рецепторов. Это обстоятельство объясняет снижение эффективности лечения и требует ограничения частоты применения b 2–агонистов [18].
Индивидуальную вариабельность ответа на b 2–агонисты и развития толерантности к их бронходилатирующему эффекту многие исследователи связывают с генетическим полиморфизмом генов. Ген b 2–адренорецепторов локализуется на 5q хромосоме. Существенное влияние на течение БА и эффективность лечения оказывает изменение аминокислотной последовательности b 2–адренорецепторов, в частности, перемещение аминокислот в 16 и 27 кодонах. Влияние полиморфизма генов не распространяется на вариабельность бронхопротективного эффекта. Справедливости ради надо отметить, что эти данные подтверждаются не во всех работах [19–22].
b 2–агонисты и смертность больных БА
Серьезные сомнения в безопасности ингаляционных b –агонистов возникли в 60–х годах ХХ столетия, когда в ряде стран, в том числе Англии, Австралии, Новой Зеландии разразилась «эпидемия смертей» среди больных БА [23]. При этом высказывалось предположение о связи между терапией симпатомиметиками и увеличением смертности от БА. Причинно–следственные взаимоотношения между применением b –агонистов (изопротеренола) и возросшей смертностью тогда не были установлены, а по результатам ретроспективных исследований доказать их было практически невозможно. Связь же между приемом фенотерола и повышением смертности от БА в Новой Зеландии в 80–е годы удалось доказать, поскольку было установлено, что этот препарат чаще назначался в случаях фатальной БА, по сравнению с хорошо контролируемым заболеванием. Эта связь была косвенно подтверждена и снижением смертности, совпавшей с отменой широкого приема фенотерола (при общем увеличении продаж других b 2–агонистов). В этом плане показательны результаты эпидемиологического исследования в Канаде, ставившего своей целью изучить возможную связь между частотой летальных исходов и назначаемыми лекарственными средствами [24]. Было показано, что возрастание частоты летальных исходов ассоциируется с высокодозной терапией любым из доступных ингаляционных b 2–агонистов. Риск фатального исхода был наибольшим при применении фенотерола, однако при упорядоченном сравнении с эквивалентными дозами сальбутамола показатели смертности достоверно не отличались.
В то же время связь между высокодозной терапией b 2–агонистами и увеличением смертности от БА надежно доказать не удается, поскольку больные с более тяжелой и плохо контролируемой БА чаще прибегают к помощи высоких доз b 2–агонистов и, напротив, реже – к помощи эффективных противовоспалительных лекарственных средств. Кроме того, высокие дозы b 2–агонистов маскируют признаки нарастающего фатального обострения БА [16].
Ингаляционные короткодействующие b 2–агонисты
Не вызывает сомнений тот факт, что ингаляционные короткодействующие b 2–агонисты являются препаратами выбора для ситуационного симптоматического контроля БА [1], а также для предупреждения развития симптомов астмы физического усилия (АФУ). Регулярное же применение ингаляционных b –агонистов может привести к утрате адекватного контроля над течением заболевания. Так, в исследовании, проведенном M.R. Sears et al. в Новой Зеландии [25], изучались бронхиальная гиперреактивность, утренняя ПСВ, ежедневные симптомы и потребность в ИГКС у пациентов, использующих b 2–агонисты «по требованию», по сравнению с больными, применяющими фенотерол регулярно 4 раза в день. В группе больных с регулярным приемом фенотерола наблюдался плохой контроль над симптомами БА, кроме того, отмечались более частые и тяжелые обострения по сравнению с группой больных, применяющих b 2–агонисты «по требованию» в течение полугода. У последних же наблюдались улучшение показателей функции внешнего дыхания, утренней ПСВ, снижение ответа на бронхопровокационную пробу с метахолином. Повышение гиперреактивности бронхов на фоне регулярного приема короткодействующих b 2–агонистов, скорее всего, связано с наличием S–энантомеров в рацемической смеси препарата [26–27].
В отношении сальбутамола подобные закономерности установить не удалось, хотя, как и в случае с фенотеролом, его регулярный прием сопровождался незначительным возрастанием бронхиальной гиперреактивности. Имеются отдельные доказательства того, что регулярное применение сальбутамола сопровождается возрастанием частоты эпизодов АФУ и увеличением выраженности воспаления в ДП [5].
Короткодействующие b 2–агонисты должны использоваться (в т.ч. и в рамках монотерапии) только «по требованию». Маловероятно, что обычно рекомендуемый режим дозирования b 2–агонистов «по требованию» может ухудшить контроль над течением БА, однако при использовании высоких доз препарата ухудшение контроля становится реальным. Более того, многие больные становятся особенно чувствительными к агонистам при наличии полиморфизма b 2–адренорецепторов, что обусловливает более быстрое ухудшение контроля [28]. Связь, установленная между повышением риска смерти у больных БА и применением высоких доз ингаляционных b 2–агонистов, отражает лишь степень тяжести заболевания. Возможно также, что высокие дозы ингаляционных b 2–агонистов оказывают вредоносное воздействие на течение БА [16]. Больные, получающие высокие дозы b 2–агонистов (более 1,4 баллончика аэрозоля в месяц), безусловно, нуждаются в эффективной противовоспалительной терапии, в т.ч. и с целью уменьшения дозы b 2–агонистов [28]. При увеличении потребности в бронходилататорах (чаще трех раз в неделю) показано дополнительное назначение противовоспалительных препаратов, а при употреблении b 2–агонистов более 3–4 раз в день для купирования симптомов – увеличение их дозы.
Прием короткодействующих b 2–агонистов с целью бронхопротекции также ограничивается «разумными пределами» (не более 3–4 раз в сутки). Бронхопротективные свойства b 2–агонистов позволяют многим высококвалифицированным спортсменам, страдающим БА, выступать в соревнованиях международного уровня (правила позволяют использовать короткодействующие b 2–агонисты для профилактики АФУ при условии, что заболевание врачебно верифицировано). Так, например, на Олимпийских играх 1984 г. в Лос–Анджелесе принимали участие 67 спортсменов с АФУ, из которых 41 получил медали разного достоинства [29]. Известно, что пероральные b 2–агонисты способствуют повышению работоспособности за счет увеличения мышечной массы, белкового и липидного анаболизма, психостимуляции [30,31,32]. В исследовании С.Goubart et al. [33] было показано, что влияние ингаляционных b 2–агонистов у здоровых спортсменов ограничивается лишь небольшой бронходилатацией, которая, впрочем, может вносить существенный вклад в улучшение дыхательной адаптации в начале нагрузки.
Пролонгированные ингаляционные b 2–агонисты
Доступные в настоящее время пролонгированные ингаляционные b 2–агонисты – формотерол и сальметерол оказывают свое действие в течение 12 часов с равноценным бронхолитическим эффектом. Тем не менее различия между ними есть. В первую очередь, это быстродействие формотерола (в форме ДПИ), сопоставимое со временем начала действия сальбутамола (в форме ДАИ) [34], что позволяет использовать формотерол в качестве средства скорой помощи, вместо короткодействующих b 2–агонистов. В то же время нежелательных явлений при использовании формотерола существенно меньше, чем при применении сальбутамола [17]. Эти препараты могут использоваться в качестве монотерапии у больных с легким течением БА в качестве бронхопротекторов при АФУ. При использовании формотерола чаще 2 раз в неделю «по требованию» необходимо добавлять к лечению ИГКС.
Следует отметить, что монотерапия пролонгированными b 2–агонистами на регулярной основе не рекомендуется, так как до сих пор нет надежных доказательств их противовоспалительного, модифицирующего заболевание действия [35].
Есть научно обоснованные доказательства целесообразности комбинированного применения ИГКС и бронходилататоров. Кортикостероиды усиливают экспрессию b 2–рецепторов и уменьшают потенциальную десенситизацию, в то время как пролонгированные b 2–агонисты увеличивают чувствительность кортикостероидных рецепторов к ИГКС [36].
Проведенные к настоящему времени исследования свидетельствуют о возможности более раннего назначения пролонгированных ингаляционных b 2–агонистов. Так, например, у больных с неадекватным контролем астмы на фоне приема 400–800 мкг ИГКС дополнительное назначение сальметерола обеспечивает более полный и адекватный контроль по сравнению с увеличением дозы ИГКС. Формотерол демонстрирует сходный эффект и одновременно способствует уменьшению частоты обострений заболевания. Эти и ряд других исследований свидетельствуют о том, что добавление пролонгированных ингаляционных b 2–агонистов к низко–среднедозовой терапии ИГКС у больных с неадекватным контролем БА равноценно удвоению дозы стероидов [5].
В настоящее время рекомендовано использовать пролонгированные ингаляционные b 2–агонисты только у больных, одновременно получающих ИГКС. Многообещающими представляются фиксированные комбинации, такие как сальметерол с флютиказоном (Серетид) и формотерол с будесонидом (Симбикорт). При этом отмечается лучшая комплаентность, исключается риск использования только одного из препаратов в рамках длительной терапии заболевания.
1. National Institutes of Health, National Heart, Lung, and Blood Institute. Expert Panel Report 2: Guidelines for the Diagnosis and Management of Asthma. Bethesda, Md: National Institutes of Health, National Heart, Lung, and Blood Institute; April 1997. NIH publication 97–4051.
2. Лоуренс Д.Р., Бенитт П.Н. Клиническая фармакология. В 2–х томах. Москва: Медицина; 1991 г.
3. Машковский М.Д. Лекарственные средства. Москва: Медицина; 1984 г.
4. Show M. B2–agonists, from pharmacological properties to everyday clinical practice. International workshop report (based on a workshop held in London, UK February 28–29, 200)
5. Barnes P.J. b –Agonists, Anticholinergics, and Other Nonsteroid Drugs. In: Albert R., Spiro S., Jett J., editors. Comprehensive Respiratory Medicine. UK:Harcourt Publishers Limited; 2001. p.34.1–34–10
6. Updating guidelines on asthma in adults (editorial). BMJ 2001; 323:1380–1381.
7. Jonson M. b 2–adrenoceptor agonists: optimal pharmacological profile. In: The role of b 2–agonists in asthma management. Oxford: The Medicine Group; 1993. p. 6–8.
8. Barnes P.J. beta–adrenergic receptors and their regulation. Am J Respir Crit Care Med. 1995; 152:838–860.
9. Kume H., Takai A., Tokuno H., Tomita T. Regulation of Ca2+ dependent K+–channel activity in tracheal myocytes by phosphorylation. Nature 1989; 341:152–154.
10. Anderson G.P. Long acting inhaled beta–adrenoceptor agonists: the comparative pharmacology of formoterol and salmeterol. Agents Actions Suppl. 1993; 43:253–269.
11. Stiles GL, Taylor S, Lefkowitz RJ. Human cardiac beta–adrenergic receptors: subtype heterogeneity delineated by direct radioligand binding. Life Sci. 1983; 33:467–473.
12. Prior JG, Cochrane GM, Raper SM, Ali C, Volans GN. Self–poisoning with oral salbutamol. BMJ. 1981; 282:1932.
13. Handley D. The asthma–like pharmacology and toxicology of (S)–isomers of beta agonists. J Allergy Clin Immunol. 1999;104: S69–S76.
15. Burggsaf J., Westendorp R.G.J., in’t Veen J.C.C.M et al. Cardiovascular side effects of inhaled salbutamol in hypoxic asthmatic patients. Thorax 2001; 56: 567–569.
16. Van Shayck C.P., Bijl–Hoffland I.D., Closterman S.G.M. et al. Potential masking effect on dispnoea perception by short– and long–acting b 2–agonists in asthma. ERJ 2002; 19:240–245.
17. Van der Woude H.J., Winter T.N., Aalbers R. Decreased bronchodilating effect of salbutamol in relieving methacholine induced moderate to severe bronchoconstriction during high dose treatment with long acting b 2 agonists. Thorax 2001; 56: 529–535.
18. Nelson HS. Clinical experience with levalbuterol. J Allergy Clin Immunol. 1999; 104:S77–S84.
19. Lipworth BJ, Hall IP, Tan S, Aziz I, Coutie W. Effects of genetic polymorphism on ex vivo and in vivo function of b 2–adrenoceptors in asthmatic patients. Chest 1999;115:324–328.
20. Lipworth BJ, Kopelman G.H., Wheatley A.P. et al. b 2–adrenoceptor promoter polymorphism: extended halotypes and functional effects in peripheral blood mononuclear cells. Thorax 2002; 57: 61–66.
21. Lima JJ, Thomason DB, Mohamed MH, Eberle LV, Self TH, Johnson JA. Impact of genetic polymorphisms of the b 2–adrenergic receptor on albuterol bronchodilator pharmacodynamics. Clin Pharm Ther 1999; 65:519–525.
22. Kotani Y, Nishimura Y, Maeda H, Yokoyama M. b 2–adrenergic receptor polymorphisms affect airway responsiveness to salbutamol in asthmatics. J Asthma 1999; 36:583–590.
23. Taylor D.R., Sears M.R., Cockroft D.W. The beta–agonist controversy. Med Clin North Am 1996; 80: 719–748.
24. Spitzer WO, Suissa S, Ernst P, et al. The use of beta–agonists and the risk of death and near death from asthma. N Engl J Med 1992; 326:501–506.
25. Sears MR, Taylor DR, Print CG, et al. Regular inhaled beta–agonist treatment in bronchial asthma. Lancet 1990; 336:1391–1396.
26. Handley D. The asthma–like pharmacology and toxicology of (S)–isomers of beta agonists. J Allergy Clin Immunol. 1999; 104:S69–S76.
27. Nelson HS. Clinical experience with levalbuterol. J Allergy Clin Immunol 1999;104:S77–S84.
28. Liggett S.B. Polymorphisms of the b 2–adrenergic receptor in asthma. Am J Respir Cri. Care Med 1997; 156: S 156–162.
29. Voy R.O. The US Olympic Commitee experience with exercise–induced bronchospasm. Med Sci Exerc 1986; 18:328–330.
30. Lafontan M, Berlan M, Prud’hon M. Les agonistes beta–adrenergiques. Mecanismes d’action: lipomobilisation et anabolisme. Reprod Nutr Develop 1988; 28:61–84
31. Martineau L, Horan MA, Rothwell NJ, et al. Salbutamol, a b 2–adrenoceptor agonist, increases skeletal muscle strength in young men. Clin Sci 1992; 83: 615–621.
32. Price AH, Clissold SP. Salbutamol in the 1980s. A reappraisal of its clinical efficacy. Drugs 1989; 38: 77–122.
33. Goubault C, Perault M–C, Leleu et al. Effects of inhaled salbutamol in exercising non–asthmatic athletes Thorax 2001; 56: 675–679.
34. Seberova E, Hartman P, Veverka J, et al. Formoterol given by Turbuhaler® had a rapid onset of action as salbutamol given by pMDI. Program and abstracts of the 1999 International Conference of the American Thoracic Society; April 23–28, 1999; San Diego, California. Abstract A637.
35. Wallin A., Sandstrom T., Soderberg M. et al. The effects of regular inhaled formoterol, budesonide, and placebo on mucosal inflammation and clinical indices of mild asthma. Am J Respir Crit Care Med. 1998; 158:79–86.
36. Greening AP, Ind PW, Northfield M, Shaw G. Added salmeterol versus higher–dose corticosteroid in asthma patients with symptoms on existing inhaled corticosteroid. Allen & Hanburys Limited UK Study Group. Lancet. 1994; 334:219–224.