сальник в животе чем опасен
Перитонеальный канцероматоз
Перитонеальный канцероматоз
Вам поставили диагноз: перитонеальный канцероматоз (опухоль брюшины)
Предлагаем Вашему вниманию краткий, но очень подробный обзор перитонеального канцероматоза.
Филиалы и отделения, где лечат перитонеальный канцероматоз
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Национальный центр лечения больных канцероматозом
МНИОИ имени П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Руководитель Центра к.м.н. Владимир Михайлович Хомяков – 8 495 150 11 22
Введение
Причины возникновения перитонеального канцероматоза
Развитие перитонеального канцероматоза является поэтапным процессом. Первый этап – распространение опухолевых клеток из первичного очага поражения. Это связано с нарушением межклеточного взаимодействия и приобретением клетками опухоли подвижности. При этом эпителиальные клетки меняют фенотип на мезенхимальный, происходит деградация межклеточного матрикса. Распространение опухолевых клеток может происходить в ходе оперативного вмешательства. Их механическое отделение возможно при повреждении лимфатических или кровеносных сосудов. Попавшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов, имплантируются в местах повышенной резорбции: большом сальнике, в области слепой кишки, дугласовых карманах.
На втором этапе опухолевые клетки взаимодействуют с мезотелием брюшины. Механизмы адгезии определяются природой клеток, особенностями морфологии брюшины, а также наличием участков ее повреждения. Далее клетки закрепляются в мезотелии, происходит их горизонтальное распространение по поверхности перитонеума, а затем инвазивный рост – прорастание в базальную мембрану, соединительную ткань. Следующим этапом является стимуляция неоангиогенеза – обязательного фактора развития опухоли. Морфопатогенетические механизмы формирования канцероматоза брюшины еще недостаточно изучены, в связи с чем отсутствуют радикальные методы лечения.
Частота развития канцероматоза брюшины зависит не только от первичной локализации опухоли, но и от ее размеров, глубины инвазии, гистотипа, степени дифференцировки (недифференцированный рак желудка осложняется поражением брюшины в 60% случаев, ограниченный – в 15%).
Классификация перитонельного канцероматоза
Единая классификация данного заболевания отсутствует, поскольку характеристики первичных опухолей, приводящих к поражению брюшины, весьма разнообразны. Наиболее распространена классификация перитонеального канцероматоза брюшины в зависимости от числа, локализации метастазов, которая предусматривает три степени:
Р1 – локальное поражение брюшины
Р2 – несколько областей канцероматоза, разделенных здоровыми участками брюшины
Р3 – многочисленные очаги поражения
Также используется метод определения индекса канцероматоза брюшины: суммируются баллы измерения максимальных очагов поражения (0-3 балла) в каждой из 13 наиболее вероятных областей поражения брюшины.
Симптомы перитонеального канцероматоза
Перитонеальный канцероматоз брюшины является вторичным поражением, поэтому его клиническая картина во многом определяется проявлениями первичной опухоли. Характерным признаком является обильный выпот в брюшную полость – формирование асцита. Зачастую асцитический синдром, развивающийся вследствие обструкции лимфатического дренажа, является единственным признаком заболевания, и пациенты могут поступать в отделение гастроэнтерологии или терапии для диагностики причин асцита. Состояние больных тяжелое, характерна значительная потеря веса. Неспецифическими признаками являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов возможно их прощупывание через брюшную стенку.
Диагностика перитонеального канцероматоза
Перитонельный канцероматоз имеет неспецифическую клиническую картину, однако консультация гастроэнтеролога или онколога позволяет предположить данное заболевание на основании симптомов и физикальных данных. Лабораторные анализы не выявляют специфических изменений: определяется лейкоцитоз, ускорение СОЭ. Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Информативным методом диагностики перитонеального канцероматоза является лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, сопровождающаяся биопсией. Высокой специфичностью обладает обратнотранскриптазная полимеразная цепная реакция (ОТ-ПЦР), которая позволяет определить источник диссеминации даже при малом количестве опухолевых клеток.
Сложности диагностики возникают при наличии перитонеального канцероматоза без выявленного первичного очага. Данная форма заболевания, встречающаяся в 3-5 % случаев, проявляется клинически только при уже сформировавшемся поражении брюшины. При этом первичный очаг может иметь настолько малые размеры, что его прижизненное обнаружение невозможно.
В качестве дополнительных методов может использоваться определение онкомаркеров (кислой фосфатазы, раково-эмбрионального антигена, альфа-фетопротеина, бета-субъединицы ХГЧ). Такая диагностика не обладает высокой специфичностью, но применяется для оценки прогноза, раннего выявления диссеминации, рецидивов, а также для контроля эффективности лечения.
Лечение перитонеального канцероматоза
Хирургическое лечение канцероматоза включает удаление первичной опухоли с регионарными метастазами и отсевами по брюшине. Циторедуктивная операция выполняется в объеме перитонэктомии, может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После проведения операции оценивается индекс полноты циторедукции: СС-0: после проведения хирургического лечения очаги поражения визуально не определяются; СС-1: имеются неудаленные очаги диаметром до 2,5 мм; СС-2: очаги диаметром 2,5 мм – 2,5 см; СС-3: очаги поражения более 2,5 см в диаметре. Однако даже при определении индекса СС-0 нельзя полностью исключить возможность диссеминации, поэтому обязательно проводится химиотерапия.
Эффективные подходы к лечению, как правило, подразумевают проведение комбинированной терапии, например, сочетания хирургического вмешательства и системной химиотерапии. Одним из наиболее эффективных методов является локальная химиотерапия. Идея локальной химиотерапии состоит в том, чтобы обеспечить доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Из-за крайне низкой проницаемости этой области для лекарственных препаратов, например, при внутривенном их введении или приеме в виде таблеток, доставка препаратов в виде аэрозоля под давлением углекислого газа даёт накопление препарата в опухоли в значительно больших концентрациях.
Методы лечения перитонеального канцероматоза
Длительное время канцероматоз брюшины и плевры считали терминальной стадией болезни, не подлежащей специальному лечению. Разработка методик непосредственного воздействия на брюшину и плевру позволила улучшить прогноз при этом состоянии. МНИОИ им. П.А. Герцена обладает уникальными возможностями лечения больных с канцероматозом, имея в арсенале весь комплекс новейших методов терапии.
Гипертермическая интраоперационная внутрибрюшная (внутриплевральная) химиотерапия (HITEC).
Это методика, при которой во время операции в брюшную или плевральную полость вводится подогретый до 42,5С, высококонцентрированный раствор химиотерапевтических препаратов, что обеспечивает их воздействие непосредственно на раковые клетки в брюшной (плевральной) полости при минимальном воздействии на другие органы. Сеанс проводится в течение часа, что позволяет разрушить опухолевые клетки, оставшиеся после так называемой циторедуктивной операции.
Внутрибрюшная (внутриплевральная) аэрозольная химиотерапия под давлением (PIРAC)
Это новейший инновационный метод лечения перитонеального канцероматоза, который обеспечивает доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Метод совсем недавно появился в России. Процедуру проводят посредством лапароскопии (торакоскопии). В брюшной или плевральной полости под давлением углекислого газа распыляют аэрозоль химиопрепаратов и оставляют в течение 30 мин. При таком способе введения химиопрепаратов их воздействие на опухоль многократно возрастает при полном отсутствии системной токсичности. Ноу-хау МНИОИ имени П.А. Герцена в этом методе лечения стала разработка собственной специальной форсунки, которая формирует поток мелкодисперсного аэрозоля с размером капель от 1 до 40 мкм. Изделие выполнено из специализированных материалов и не уступает по качеству импортному аналогу, а по ряду технических характеристик его превосходит.
Преимущества лечения перитонеального канцероматоза в МНИОИ имени П.А. Герцена – филиале ФГБУ «НМИЦ радиологии» Минздрава России
Медицинские интернет-конференции
Языки
Перекрут и некроз жировых подвесков толстой кишки и прядей большого сальника. Torsion and necrosis of fat suspensions of the colon and strands of the large omentum
Сильвеструк С.В.
Silvestruk S.V.
Резюме
Перекрут и некроз жировых подвесков толстой кишки и прядей большого сальника
Torsion and necrosis of fat suspensions of the colon and strands of the large omentum
Проведен ретроспективный анализ историй болезни 33 пациентов (данные за октябрь 2015 – декабрь 2019 гг.), у которых по данным хирургического вмешательства обнаружены перекрут и некроз сальниковых отростков толстой кишки и прядей большого сальника (К 63.8). Клиническая картина, как и данные лабораторно-инструментальных исследований при перекруте и некрозе жировых структур брюшной полости скудны и неспецифичны. Ведущим симптомом являются боли в животе (100%), с преимущественной локализацией в нижних отделах. На догоспитальном этапе диагностика данной патологии представляет определенные трудности, поэтому в неясных случаях лапароскопия является методом выбора, который позволяет поставить правильный диагноз в 100%. Успешное оперативное лечение перекрута и некроза жировых структур возможно в 93,9% случаев лапароскопическим доступом, имеющим ряд преимуществ перед лапаротомией.
The authors retrospectively analyzed history cases of 33 patients (data for October 2015-December 2019), who were found to have torsion and necrosis of the omentum processes of the colon and strands of the large omentum (K 63.8). The clinical picture, as well as the data of laboratory and instrumental studies for torsion and necrosis of abdominal fat structures are sparse and non-specific. The leading symptom is abdominal pain (100%), with predominant localization in the lower parts. At the pre-hospital stage, the diagnosis of this pathology presents certain difficulties, so in unclear cases, laparoscopy is the method of choice that allows you to make a correct diagnosis in 100%. Successful surgical treatment of torsion and necrosis of fat structures is possible in 93.9% of cases by laparoscopic access, which has a number of advantages over laparotomy.
Ключевые слова
Введение
Перекрут и некроз сальниковых отростков (appendices epiploicae) ободочной кишки относится к редким заболеваниям и встречается у 0,09—0,3% пациентов с острыми хирургическими заболеваниями органов брюшной полости, а среди острых хирургических заболеваний толстой кишки – до 2% [8-10, 15, 16]. В литературе встречаются лишь единичные описания случаев диагностики и лечения данной патологии, также редко приводится анализ наблюдений пациентов.
Предполагают, что в развитии перекрута и некроза отростков играют роль ряд факторов: нарушения моторной функции кишечника, наличие воспалительного очага (дивертикулит, холецистит, болезнь Крона), спаечного процесса в брюшной полости, подвижность, размеры и форма подвесков, аномалии развития толстой кишки. Триггерными факторами выступают резкие повороты, сгибания туловища, тяжелая физическая нагрузка, быстрое снижение массы тела, закрытая травма живота [3-9, 15, 17]. Среди наиболее частых причин развития заболевания жировых подвесков толстой кишки выступают избыточная масса тела, ожирение, пожилой возраст [3, 5, 6, 11].
Перекрут и некроз отростков диагностируется на дооперационном этапе не более в 63% наблюдений, что связано с отсутствием специфики клиники [1, 3-4, 7, 9]. Основным симптомом являются остро возникшие постоянные боли в животе, которые чаще всего локализуются в левой или правой подвздошной области, могут периодически усиливаться. При вовлечении в воспалительный процесс других органов наблюдается иррадиация. Больных заставляет обратиться за помощью отсутствие купирования болевого синдрома самостоятельным приемом анальгетиков, спазмолитиков. Тошнота, рвота, задержка стула и газов, диарея не являются характерными для перекрута и некроза отростков (30 % наблюдений) [1, 6, 14]. Температура тела в ряде случаев может повышаться до субфебрильной. Так как данный процесс отличается более мягким течением и более медленным нарастанием симптоматики, это обусловливает позднюю обращаемость ряда пациентов (от 1 до 8 сут от начала заболевания) [2, 6, 8, 14, 15].
Физикальное обследование больных также не дает патогномоничных симптомов. При пальпации живота определяется только локальную болезненность, в ряде случаев — локальное напряжение мышц передней брюшной стенки в проекции измененного отростка. Иногда может пальпироваться болезненное образование. Существенные трудности возникают при дифференциальной диагностике с острым аппендицитом, так как нередко у этих пациентов выявляются симптомы воспаления червеобразного отростка (Ровзинга, Ситковского и др.) [3, 6, 9]. При вовлечении в воспалительный процесс при длительном существовании перекрута и некроза отростков могут возникать жалобы на дизурические явления (при вовлечении стенки мочевого пузыря), на боли в правом подреберье (при вовлечении желчного пузыря, печени) и др. [3-6, 9, 14-16]
При исследовании показателей лабораторных данных могут отмечаться умеренный лейкоцитоз (до 12·109 /л), незначительное повышение уровня С-реактивного белка, что не дает весомо значимой информации для постановки точного диагноза. Зарубежные авторы подчеркивают значительную роль инструментальных методов исследования при визуализации и дифференциальной диагностике перекрута и некроза жировых отростков толстой кишки. При компьютерной томографии можно выявить сальниковый отросток как овальное толстокишечное жировое образование в окружении инфильтрированной брызжейки [11, 12, 14]. Тем не менее в 50—63,4% наблюдений неинвазивные лучевые методы не дают достоверных результатов, поэтому на дооперационном этапе, как правило, устанавливают диагноз других заболеваний органов брюшной полости и малого таза, таких как дивертикулит ( 50% наблюдений), острый аппендицит (13—76,5%), почечная колика (до 35%), перитонит (до 27,3%), заболевания придатков матки (до 19,6%) [1-3, 6-8].
С появлением лапараскопических бригад данный метод стал «золотым стандартом» диагностики перекрута и некроза отростков и позволяет верифицировать диагноз в 83—100% наблюдений. В настоящее время все большее значение в лечении придается лапароскопии. Консервативное ведение данной патологии не рекомендуется, так как данная тактика может приводить к развитию осложнений, рецидиву заболевания (до 10% наблюдений). В большинсте случаев предлагается лапароскопическое удаление патологически измененных отростков с различными способами обработки и пересечения ножки отростка: коагуляцией, клипированием, лигированием. При осложнениях (обширных некрозах прядей большого сальника) производится переход на лапаротомный доступ [2, 4, 5, 7, 8, 15-16].
Диагноз перекрута и некроза отростков редко удается поставить на дооперационном этапе, что обуславливает актуальнось изучения особенностей клинической картины, возможностей различных лабораторно-инструментальных методов в диагностике заболеваний сальниковых отростков ободочной кишки.
Цель исследования — изучение особенностей клинической симптоматики и оценка возможностей лапароскопии в современной диагностике и лечении больных с патологическими изменениями сальниковых отростков ободочной кишки.
Резекция большого сальника (лапароскопия/лапаротомия)
Резекция большого сальника — операция, при которой иссекается и ушивается складка брюшины, покрывающая полость брюшины от области желудка до тонкого кишечника. Данное хирургическое вмешательство, как правило, не является самостоятельной операцией, и чаще выполняется при злокачественном процессе в органах брюшины и малого таза. Как показывает практика, при поражении матки и придатков своевременная выполненная резекция увеличивает выживаемость пациенток. Объясняется это тем, что в ткани сальника легко метастазируют злокачественные клетки. Незамеченные при операции, они будут причиной новых очагов, поэтому удаленная ткань сальника в обязательном порядке должна направляться на гистологический анализ. В ходе хирургического вмешательства по поводу злокачественного процесса удалению также подлежат затронутые раком структуры: лимфатические узлы, кишечник.
Резекция большого сальника может быть проведена с использованием лапароскопического или лапаротомического доступа. В ходе лапаротомии выполняется разрез передней брюшной стенки, открытый метод целесообразен, если необходим обзор пораженных участков. Продолжительность госпитализации в этом случае составляет около 10 дней, восстановление займет около 1-1,5 месяца. В отличие от лапаротомии, при лапароскопическом доступе манипуляции выполняются через несколько небольших разрезов на животе с использованием видеоэндоскопического оборудования. Все действия хирурга отражаются на мониторе с качественным разрешением, визуальный контроль современной аппаратуры обеспечивает высокую точность манипуляций. После лапароскопии длительность пребывания в клинике составляет не более трех дней, период восстановления занимает не более 4 недель.
Показания и противопоказания
Преимущества резекции большого сальника
Комментарий врача

Руководитель хирургической службы SwissClinic Пучков Константин Викторович
Почему резекцию большого сальника лучше сделать в Швейцарской Университетской клинике?
Часто задаваемые вопросы
В чем заключается подготовка к резекции большого сальника?
Перед операцией необходимо тщательно очистить кишечник. Также за несколько дней до вмешательства нужно исключить из рациона продукты, способные вызвать повышенное газообразование. Операция проводится строго натощак, последний прием пищи, как минимум, за 8 ч до ее начала. При необходимости приема каких-либо медикаментов необходимо предупредить лечащего врача, возможно, некоторые препараты нужно будет исключить на несколько дней.
Возможны ли осложнения при резекции большого сальника?
Как при любом оперативном вмешательстве, при резекции также есть риск развития осложнений, теоретически нельзя исключить кровотечения или повреждения близлежащих органов в ходе вмешательства, инфицирование в ранний послеоперационный период. Поэтому наши пациенты проходят тщательное предоперационное обследование, чтобы исключить факторы, увеличивающие риск развития осложнений. Визуальный контроль процесса и использование при проведении операции оборудования и инструментария последнего поколения сводит к минимуму риск негативных последствий.
Реабилитация после резекции большого сальника
На продолжительность восстановления влияет, прежде всего, метод проведения операции. Но, независимо от используемого доступа, через несколько часов женщина может ходить, ей разрешается принимать жидкую легкую пищу. При лапаротомическом доступе длительность госпитализации составляет около 7-10 дней, восстановление занимает 4-6 недель. После лапароскопии период реабилитации значительно короче, женщина, как правило, выписывается на 3 сутки, полное восстановление занимает 2-4 недели. В послеоперационный период могут быть назначены антибактериальные и обезболивающие препараты. На протяжении месяца следует отказаться от интенсивных физических нагрузок и половых контактов, лучше исключить посещение бассейна или сауны.
Используется ли анестезия при резекции большого сальника?
В ходе оперативного вмешательства какие-либо болезненные ощущения полностью исключены, операция может быть проведена под общим наркозом, эпидуральной или спинальной анестезией. Какому способу отдать предпочтение, решает врач в каждом случае индивидуально.
Заболевания
Рак шейки матки
Рак шейки матки — онкологическое заболевание, при котором эпителий нижнего отдела матки трансформируется в злокачественные клетки. В зависимости от типа эпителия различают плоскоклеточный рак — он диагностируется у 85-95% больных, и аденокарциному — появляющуюся в 5-15%.
Рак эндометрия
Рак эндометрия — онкологическое заболевание, при котором злокачественный процесс развивается во внутреннем слое матки. Среди онкологических патологий женской половой сферы эта болезнь по частоте возникновения занимает лидирующее место. Согласно статистике, на 100 тысяч женщин приходится около 13 пациенток с диагностированным заболеванием. Около 75% заболевших приходится на женщин после 50 лет — предменопаузального и постменопаузального возраста, однако в последние годы все чаще пациентками онколога становятся женщины помоложе.
Рак яичников
Рак яичников — одно из распространенных онкологических заболеваний в гинекологии, по частоте развития уступает первенство лишь злокачественным опухолям матки. Поражение яичника может быть первичным — патологический очаг находится в самом яичнике, и вторичным, называемым метастатическим — очаг патологии расположен в любом другом органе. Злокачественные клетки в тканях яичника могут появляться при опухолях в молочной железе, матке, кишечнике, желудке.
Записывайтесь на консультацию: +7 (495) 782-50-10
ДИАГНОСТИКА И ЛЕЧЕНИЕ ПЕРЕКРУТОВ БОЛЬШОГО САЛЬНИКА У ДЕТЕЙ
Ю.Ю. Соколов, С.В. Стоногин, С.А. Коровин,
А.С. Трубицын, А.В. Вилесов, М.Э. Шувалов
Кафедра детской хирургии РМАПО
(заведующий кафедрой – профессор Ю.Ю. Соколов)
Тушинская детская городская больница
Детская городская больница святого Владимира
В настоящей работе приведен опыт лечения 13 детей с редкой патологией органов брюшной полости – перекрутом большого сальника. Из них первичный перекрут сальника был установлен у 10 детей, вторичный перекрут – у 3 больных. Лапароскопическая резекция сальника была выполнена в 12 наблюдениях, из них в 1 случае операция была дополнена аппендэктомией. Лапароскопическая резекция фрагмента большого сальника с кистой была выполнена 1 больной. Конверсия с переходом на верхнюю срединную лапаротомию и резекция всего большого сальника потребовалась у 1 больного с травмой живота. Интра- и послеоперационных осложнений не было. При гистологическом исследовании иссеченных фрагментов сальника были выявлены признаки гангренозного оментита. При лапароскопии всегда удается установить правильный диагноз и в большинстве наблюдений выполнить резекцию измененного сальника. В ряде случаев вторичных перекрутов в ходе лапароскопии можно также устранить этиологические факторы перекрута сальника.
Перекрут большого сальника – редкое полиэтиологическое заболевание, являющееся одной из причин острых болей в животе у детей. Подобная патология встречается у 0,01-0,32% больных, экстренно оперированных на органах брюшной полости [1, 4]. Учитывая редкую частоту встречаемости данного состояния, мы решили проанализировать собственные клинические наблюдения детей с перекрутом большого сальника.
Материалы и методы. С 2007 по 2011 годы на лечении в Тушинской детской городской больнице и ДГКБ святого Владимира с перекрутом большого сальника находились на лечении 13 детей. Возраст больных колебался от 1,5 до 13 лет и составил в среднем 9 + 1,8 лет. Мальчиков было 9, девочек – 5.
В клинической картине у экстренно поступивших больных преобладали разной степени интенсивности боли в правой половине живота. В большинстве наблюдений боли были постоянного характера, иногда отмечался приступообразный характер болей. При поступлении положительные симптомы раздражения брюшины в правой подвздошной области были выявлены у 2 детей. Помимо болевого синдрома у 3 детей наблюдались диспепсические расстройства: рвота, тошнота, жидкий стул. Температура тела во всех случаях была нормальной. Уровень лейкоцитов в крови колебался от 6.9 до 17,3х10 9 /л и составил в среднем 11,5х10 9 /л + 2,4.
Только у 1 экстренно поступившего больного при УЗИ в нижних отделах брюшной полости справа был обнаружен неоднородный по структуре инфильтрат с нечеткими контурами. Во всех остальных наблюдениях при сонографии патологических изменений в брюшной полости обнаружено не было.
В экстренном порядке были оперированы 12 детей. Показанием к проведению диагностической лапароскопии у них явилось сохранение абдоминального болевого синдрома, появление в процессе наблюдения симптомов раздражения брюшины, а также обнаружение при УЗИ инфильтрата в брюшной полости. Лапароскопия в плановом порядке была выполнена 1 ребенку с кистой брюшной полости.
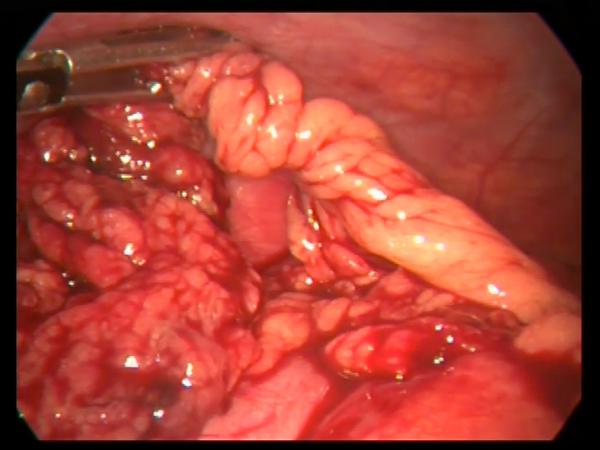
Перекрученные фрагменты сальника располагались в нижних отделах брюшной полости или правом боком канале, имели продольные размеры от 3 до 7см, были темно-багрового или черного цвета, при этом всегда отчетливо определялась граница перекрута сальника (рис. 1).
Рис. 1. При лапароскопии выявляется участок большого сальника, перекрученного на 720 0
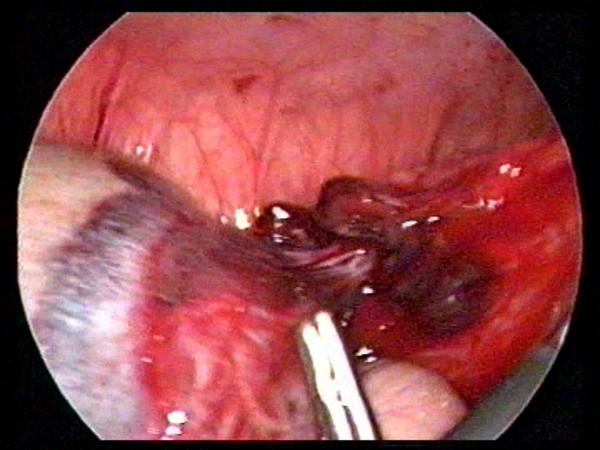
Лапароскопическая резекция перекрученного участка большого сальника с применением монополярной коагуляции или петли Редера была выполнена в 12 наблюдениях, из них в 1 случае операция была дополнена аппендэктомией. Лапароскопическая резекции фрагмента большого сальника с кистой была выполнена у 1 больной (рис. 2). Для удаления из брюшной полости резецированных препаратов производили замену околопупочного 5-мм троакара на троакар большего диаметра.
Рис. 2. При лапароскопии выявляется больших размеров киста сальника с перекрутом на 180 0 в области основания кисты
Конверсия с переходом на верхнюю срединную лапаротомию и резекция всего большого сальника потребовалась у больного с травмой живота и большими размерами инфильтрированного тотально перекрученного сальника.
Интра- и послеоперационных осложнений не было. Сроки лечения в стационаре варьировали от 5 до 15 суток и составили в среднем 7 дней. При гистологическом исследовании иссеченных фрагментов сальника во всех случаях были выявлены признаки нарушения кровообращения с развитием гангренозного оментита.
Обсуждение. Впервые перекрут большого сальника описал Oberst в 1882 году. Различают первичные и вторичные перекруты сальника. Первичный перекрут сальника чаще встречается у мальчиков и возникает без каких-либо видимых причин. Клинические данные и операционные находки при этом исключают первичные патологические изменения в самом сальнике или в окружающих его органах [ 1 ]. Первичный перекрут сальника у детей чаще встречается в возрасте 9–16 лет, в младшей возрастной группе из-за малого количества жировой ткани в сальнике данное заболевание отмечено крайне редко.
Вторичный перекрут может возникать при наличии в сальнике кист, опухолей или гематом; при вовлечении сальника в инфильтрат при аппендиците, холецистите, воспалительных заболеваниях гениталий; при наличии спаек в брюшной полости, а также при фиксации сальника к послеоперационным рубцам, вокруг вентрикулоперитонеальных шунтов или в грыжевом мешке [1].
Различают также парциальный и тотальный перекрут сальника. Чаще встречается частичный перекрут сальника в области свободного края.
К предрасполагающим факторам перекрута сальника у детей относят анатомические особенности сальника, особенно его правой половины, заключающиеся в образовании отшнурованной подвижной концевой пряди в виде лепестка, наличия добавочной сальниковой вены, преобладание поперечного размера сальника над продольным, что приводит к возникновению более частого перекрута правой половины свободного края сальника [7, 8, 11]. Факторами, способствующими возникновению перекрута сальника, являются усиленная перистальтика, нарушение кровообращения застойного характера, резкое перемещение тела, быстрое напряжение мышц при поднятии тяжестей [1, 3]. К фактором риска возникновения перекрута сальника у детей относят ожирение, что подтверждается увеличением количества наблюдений перекрута сальника параллельно увеличению в последние годы детей с избыточной массой тела [9, 11, 15].
Среди описанных нами больных первичный перекрут сальника отмечен у 10 детей. Объективные причины перекрута у них установить не удалось, с другой стороны, большинство из них имело избыточную массу тела. Перекрут сальника в 3 случаях имел вторичный характер и возник вследствие закрытой травмы живота, перекрута врожденной кисты сальника и вовлечения сальника в инфильтрат при остром флегмонозном аппендиците.
Диагностика перекрута сальника очень трудна и нередко диагноз устанавливается во время операции [5, 6, 11]. Некоторые авторы категорически отвергают наличие специфичных для перекрута сальника симптомов, отличных от симптомов острого аппендицита. Чаще всего перекрут сальника у детей необходимо дифференцировать с острым аппендицитом или острой патологией органов малого таза у девочек [4, 8, 9].
При перекруте сальника больные предъявляют жалобы на островознукшую боль чаще в правой половине живота, тошноту, рвоту (однократную или многократную), головокружение. Часто боль появляется обильного приёма пищи, то есть после резкого повышения внутрибрюшного давления. Боль в животе может быть без определённой локализации, разлитой, но может носить и приступообразный характер.
Клинические симптомы могут нарастать медленно, длительное время отсутствуют признаки интоксикации, и большая часть больных (до 85%) поступает не сразу, а через 1-4 суток от начала заболевания. Отмечается также расхождение между выраженностью болевого синдрома и удовлетворительным общим состоянием больных. По мнению ряда авторов, это объясняется богатой васкуляризацией большого сальника, устойчивостью жировой ткани к гипоксии, а также асептичностью процесса в течение нескольких суток.
При пальпации брюшной стенки выявляется болезненность в правой подвздошной области, но отсутствует мышечная ригидность. Перекрученный фрагмент сальника удается пропальпировать чрезвычайно редко. Температура тела может быть нормальной или субфебрильной. В общем анализе крови в начале заболевания нет изменений, при развитии некроза сальника и перитонита выявляется лейкоцитоз.
УЗИ обладает низкой чувствительностью и специфичностью при перекруте сальника [6, 12]. Иногда в брюшной полости удается выявить отечные, гиперэхогенные участки жировой ткани с нарушенным кровотоком, что среди оперированных нами детей имело место в 1 случае. Наиболее информативным методом диагностики перекрута сальника является лапароскопия, которая носит не только диагностический, но и лечебный характер [5, 14].
В литературе указывалось на возможность консервативного лечения больных с перекрутом сальника, но подобный подход может приводить к формированию абсцессов, развитию сепсиса и возникновению спаек [6, 7, 13]. Поэтому общепризнанным стандартом лечения остается хирургический метод. Резекция перекрученного сальника в пределах здоровых тканей значительно уменьшает количество осложнений и ускоряет реабилитацию детей [10]. Преимущества миниинвазивного метода, которым является лапароскопия, неоднократно были описаны в литературе и не вызывают сомнения [2, 9, 12, 14, 16].
У всех описанных нами больных при лапароскопии удалось установить правильный диагноз. В 12 из 13 случаях резекция перекрученного сальника была завершена в миниинвазивном варианте. При вторичных перекрутах одномоментно с резекцией сальника в 1 случае и была выполнена лапароскопическая аппендэктомия, в другом наблюдении была иссечена врожденная киста сальника.
Частота встречаемости перекрута большого сальника у детей крайне низка, заболевание обычно протекает под маской острого аппендицита.
Отсутствие у детей специфических клинических симптомов и низкая информативность УЗИ делает лапароскопию методом выбора в диагностике перекрута сальника.
С активным внедрением в клиническую практику лапароскопии в последние годы отмечается увеличение выявляемости детей с перекрутом сальника.
Лапароскопия позволяет не только установить диагноз, но и выполнить резекцию измененного сальника, а в случаях вторичных перекрутов устранить его этиологические факторы.
Cervellione R.M.// Pediatr Surg Int – 2002. – Vol. 18(2-3). P. 184-6.
Theriot J.A., Sayat J., Fran ko S. et al.//Pediatrics – 2003 – Vol. 112. – N6. – P.460-462.
Сведения об авторах
Коровин С.А. – кандидат медицинских наук, доцент кафедры детской хирургии РМАПО
Трубицын А.С. – руководитель центра эндоскопической абдоминальной хирургии ДГКБ святого Владимира г. Москвы
Вилесов А.В. – врач-хирург центра эндоскопической абдоминальной хирургии ДГКБ святого Владимира г. Москвы
Шувалов М.Э. – врач-хирург центра эндоскопической абдоминальной хирургии ДГКБ святого Владимира г. Москвы