с чем реагирует оксид бериллия
Бериллий: способы получения и химические свойства
Бериллий Be — это cветло-серый, легкий, хрупкий металл. На воздухе покрывается оксидной пленкой. Восстановитель.
Относительная молекулярная масса Mr = 9,012; относительная плотность для твердого и жидкого состояния d = 1,85; tпл = 1287º C; tкип = 2507º C.
Способ получения
1. В результате электролиза расплава хлорида бериллия образуются бериллий и хлор :
3. Оксид бериллия легко восстанавливается магнием при 700 — 800º С, образуя бериллий и оксид магния:
BeO + Mg = MgO + Be
4. Фторид бериллия также легко восстанавливается магнием при 700 — 750º С с образованием бериллия и фторида магния:
BeF2 + Mg = Be + MgF2
Качественная реакция
Качественная реакция на бериллий — окрашивание пламени горелки в коричнево — красный цвет.
Химические свойства
1.1. Бериллий взаимодействует с азотом при 700 — 900º С образуя нитрид бериллия:
1.2. Бериллий сгорает в кислороде (воздухе) при 900º С с образованием оксида бериллия:
2Be + O2 = 2BeO
Be + Br2 = BeBr2
1.4. С серой бериллий реагирует при температуре 1150º C с образованием сульфида бериллия:
Be + S = BeS
1.5. С углеродом бериллий реагирует при 1700 — 1900º С и вакууме, образуя карбид бериллия:
2Be + C = Be2C
2. Бериллий активно взаимодействует со сложными веществами:
2.2. Бериллий взаимодействует с кислотами:
2.2.1. Бериллий реагирует с разбавленной соляной кислотой, при этом образуются хлорид бериллия и водород :
Be + 2HCl = BeCl2 + H2 ↑
2.2.2. Реагируя с разбавленной и горячей азотной кислотой бериллий образует нитрат бериллия, газ оксид азота (II) и воду:
2.2.3. В результате реакции концентрированной фтороводородной кислоты и бериллия образуется осадок тетрафторобериллат водорода и газ водород:
2.3. Бериллий может взаимодействовать с основаниями:
2.3.1. Бериллий взаимодействует с гидроксидом натрия в расплаве при температуре 400 — 500º С, при этом образуется бериллат натрия и водород:
2.4. Бериллий вступает в реакцию с газом аммиаком при 500 — 700º С. В результате данной реакции образуется нитрид бериллия и водород:
2.5. Бериллий может вступать в реакцию с оксидами :
В результате взаимодействия бериллия и оксида магния при температуре 1075º С образуется оксид бериллия и магний:
Be + MgO = BeO + Mg
3. Бериллий взаимодействует с органическими веществами :
Бериллий может вступать в реакцию с ацетиленом при 400 — 450º С, образуя карбид бериллия и водород:
Оксид бериллия
| Оксид бериллия | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид бериллия |
| Традиционные названия | Бромеллит |
| Химическая формула | BeO |
| Эмпирическая формула | BeO |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Отн. молек. масса | 25,01158 а. е. м. |
| Молярная масса | 25,01158 г/моль |
| Плотность | 3,01 г/см³ |
| Термические свойства | |
| Температура плавления | 2530 °C |
| Температура кипения | 4120 °C |
| Молярная теплоёмкость (ст. усл.) | 25,5 Дж/(моль·К) |
| Теплопроводность (ст. усл.) | при 100°С 209,3 [1] Вт/(м·K) |
| Энтальпия образования (ст. усл.) | 589,2 кДж/моль |
| Давление пара | при 2000°С 0,003 |
| Химические свойства | |
| Растворимость в воде | 0,00005 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,719 |
| Структура | |
| Кристаллическая структура | гексагональная |
В зависимости от способа получения, при стандартных условиях, оксид бериллия представляет собой белое кристаллическое или аморфное вещество без вкуса и запаха, очень малорастворимое в воде. Растворяется в концентрированных минеральных кислотах и щелочах, хорошо растворим в щелочных расплавах. [2] [3]
Оксид бериллия является единственным бинарным соединением бериллия с кислородом, хотя в паровой фазе над ВеО при температуре около 2000°С было отмечено присутствие полимеров типа (ВеО)3 и (ВеО)4. [2]
Содержание
Получение и свойства
В природе оксид бериллия встречается в виде минерала бромеллита. [3]
Получают оксид бериллия термическим разложение гидроксида бериллия и некоторых его солей (например, нитрата, основного ацетата, карбоната и др.) при температуре от 500 до 1000°С. Полученный таким образом оксид представляет собой белый аморфный порошок. В виде кристаллов оксид бериллия может быть получен нагреванием до высокой температуры (плавлением) аморфной формы или, например, при кристаллизации из расплавленных карбонатов щелочных металлов. [2] Упругость пара ВеО незначительна, поэтому в отсутствие паров воды это наименее летучий из всех тугоплавких оксидов. Примесь таких оксидов, как MgO, CaO, Al2O3, SiO2, ещё больше понижает летучесть ВеО из-за химического взаимодействия между ними. В присутствии паров воды при 1000—1800°С летучесть оксида бериллия сильно возрастает в связи с образованием газообразного гидроксида бериллия. [2]
Оксид бериллия обладает очень высокой теплопроводностью. При 100° С она составляет 209,3 Вт / (м К), что больше, чем у любых неметаллов и даже у некоторых металлов. [4]
Химические свойства
Реакционная способность оксида бериллия зависит от способа его получения и от степени прокаливания. Повышение температуры при прокаливании ведет к увеличению размера зерен (то есть к уменьшению удельной поверхности), а, следовательно, и к уменьшению химической активности соединения. [2]
Прокаленный при температуре не выше 500°С, оксид бериллия растворяется в водных растворах кислот и щелочей (даже разбавленных), образуя соответствующие соли и гидроксобериллаты. Например: 
Оксид бериллия, прокаленный при температуре от 1200 до 1300°С растворим в растворах концентрированных кислот. Например, прокаленный таким образом ВеО реагирует с горячей концентрированной серной кислотой: 
Прокаливание оксида бериллия при температурах выше 1800° С приводит к практически полной утрате им реакционной способности. После такого прокаливая ВеО растворяется только в концентрированной плавиковой кислоте (с образованием фторида) и в расплавленных щелочах, карбонатах и пиросульфатах щелочных металлов (с образованием бериллатов): [2] [3] 

Выше 1000°С оксид бериллия реагирует с хлором, при этом в присутствии угля данная реакция идет легче и при гораздо меньших температурах (600—800°С): [2] 
При температуре выше 1000°С оксид бериллия ступает в обратимую реакцию гидрохлорирования (понижение температуры системы вызывает обратный процесс разложения образовавшегося хлорида бериллия): [2] 
При нагревании оксид бериллия способен реагировать со многими хлорсодержащими соединениями. В частности уже при 500°С начинается реакция с фосгеном: [2] 
Хлорирование тетрахлорметаном протекает при температуре 450—700°С: [2] 
Гораздо труднее оксид бериллия взаимодействует с бромом, сведений же о взаимодействии ВеО с иодом нет.
Оксид бериллия реагирует далеко не всеми обычно применяемыми восстановителями. В частности, для восстановления бериллия из оксида применимы лишь кальций, магний, титан и уголь (при высокой температуре). Кальций и магний могут быть использованы в качестве восстановителя при температуре ниже 1700°С и атмосферном давлении, титан применим при давлении ниже 0,001 мм рт. ст. и 1400°С: [2] 
В обоих случаях бериллий получается загрязненным, так как технически очень трудно разделить продукты реакции.
Использование угля более предпочтительно, но реакция с ним идет лишь при температурах выше 2000°С:
Оксид бериллия при температурах ниже 800°С устойчив по отношению к расплавленным щелочным металлам (литию, натрию и калию) и почти совсем не реагирует с Ce, Pt, Mo, Th, Ni и Fe; только при 1800° взаимодействует с Ni, Si, Ti, Zr. [2] [5]
Применение
Сочетание высокой теплопроводности и небольшой коэффициент термического расширения позволяют использовать оксид бериллия в качестве термостойкого материала, обладающего значительной химической инертностью.
Оксид бериллия: способы получения и химические свойства
Оксид бериллия BeO — бинарное неорганическое вещество . Белый, тугоплавкий, термически устойчивый, летучий в токе O2 и водяного пара. Проявляет амфотерные свойства.
Относительная молекулярная масса Mr = 25,01; относительная плотность для тв. и ж. состояния d = 3,015; tпл ≈ 2580º C; tкип = 4260º C.
Способ получения
1. Оксид бериллия получается при разложении карбоната бериллия при температуре выше 180º C. В результате разложения образуется оксид бериллия и углекислый газ:
2. В результате разложения нитрата бериллия при температуре выше 1000º С образуется оксид бериллия, оксид азота (IV) и кислород:
3. Гидроксид бериллия разлагается при 200 — 800º С с образованием оксида бериллия и воды:
4. Оксид бериллия можно получить путем разложения сульфата бериллия при температуре 547–600º C, образуется оксид бериллия и оксид серы (VI):
Химические свойства
1. Оксид бериллия реагирует с простыми веществами :
1.1. В результате реакции между оксидом бериллия и фтором при температуре выше 400º С образуется фторид бериллия и кислород:
1.2. Оксид бериллия реагирует с углеродом и образует карбид углерода и угарный газ:
2BeО + 3C = Be2C + 2CO
1.3. Магний реагирует с оксидом бериллия при 700 — 800º С. На выходе образуется оксид магния и бериллий:
BeO + Mg = MgO + Be
2. Оксид бериллия взаимодействует со сложными веществами:
2.2.1. О ксид бериллия с концентрированной соляной кислотой образует хлорид бериллия и воду:
BeO + 2HCl = BeCl2 + H2O
2.2.2. В результате реакции между оксидом бериллия и концентрированной серной кислотой образуется сульфат бериллия и вода:
2.2.3. Если смешать горячую плавиковую кислоту с оксидом бериллия при 220 º С на выходе образуется фторид бериллия и вода
BeO + 2HF = BeF2 + H2O
2.2.4. Оксид бериллия вступает в реакцию с концентрированной плавиковой кислотой образуя тетрафторобериллат водорода и воду:
2.3. При взаимодействии бериллия с оксидами образуются соли:
2.3.1. Реагируя с оксидом кремния при температуре 1500 — 1600º С оксид бериллия образует силикат бериллия:
BeO + SiO2 = BeSiO3
2.3.2. Оксид бериллия реагирует с оксидом алюминия и образует алюминат бериллия:
2.3.3. В результате взаимодействия оксида бериллия и оксида натрия при 500º С образуется бериллат натрия:
2.4. Оксид бериллия вступает в реакции с основаниями :
BeO + 2NaOH + H2O = Na2[Be(OH)4]
2.5. Оксид бериллия реагирует с солями:
Оксид бериллия взаимодействует с карбонатами при сплавлении и образует бериллат и воду:
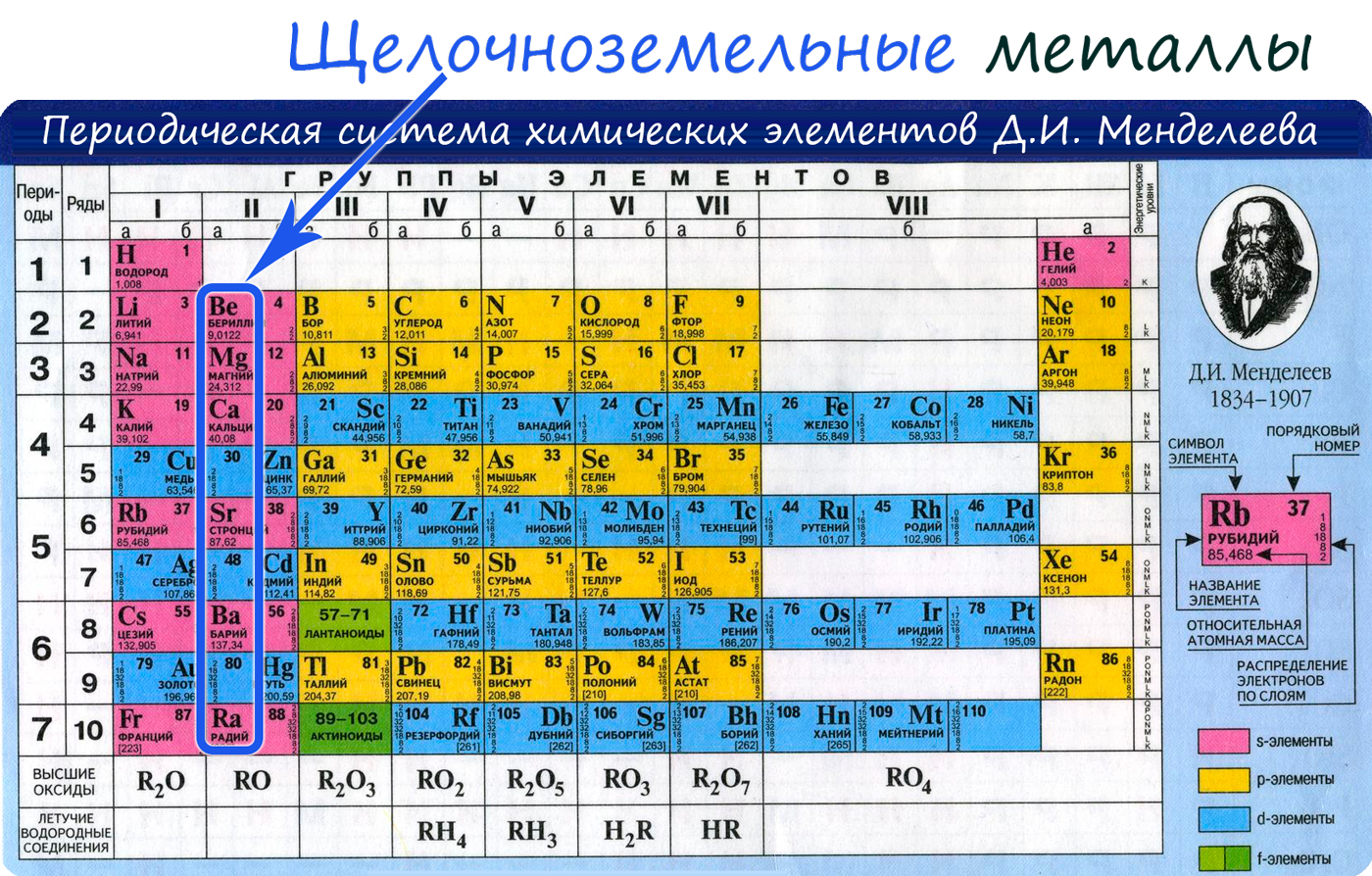
Щелочноземельные металлы
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Природные соединения
Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
Химические свойства
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании.
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
При нагревании реагируют с серой, азотом, водородом и углеродом.
Mg + S → (t) MgS (сульфид магния)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)
Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
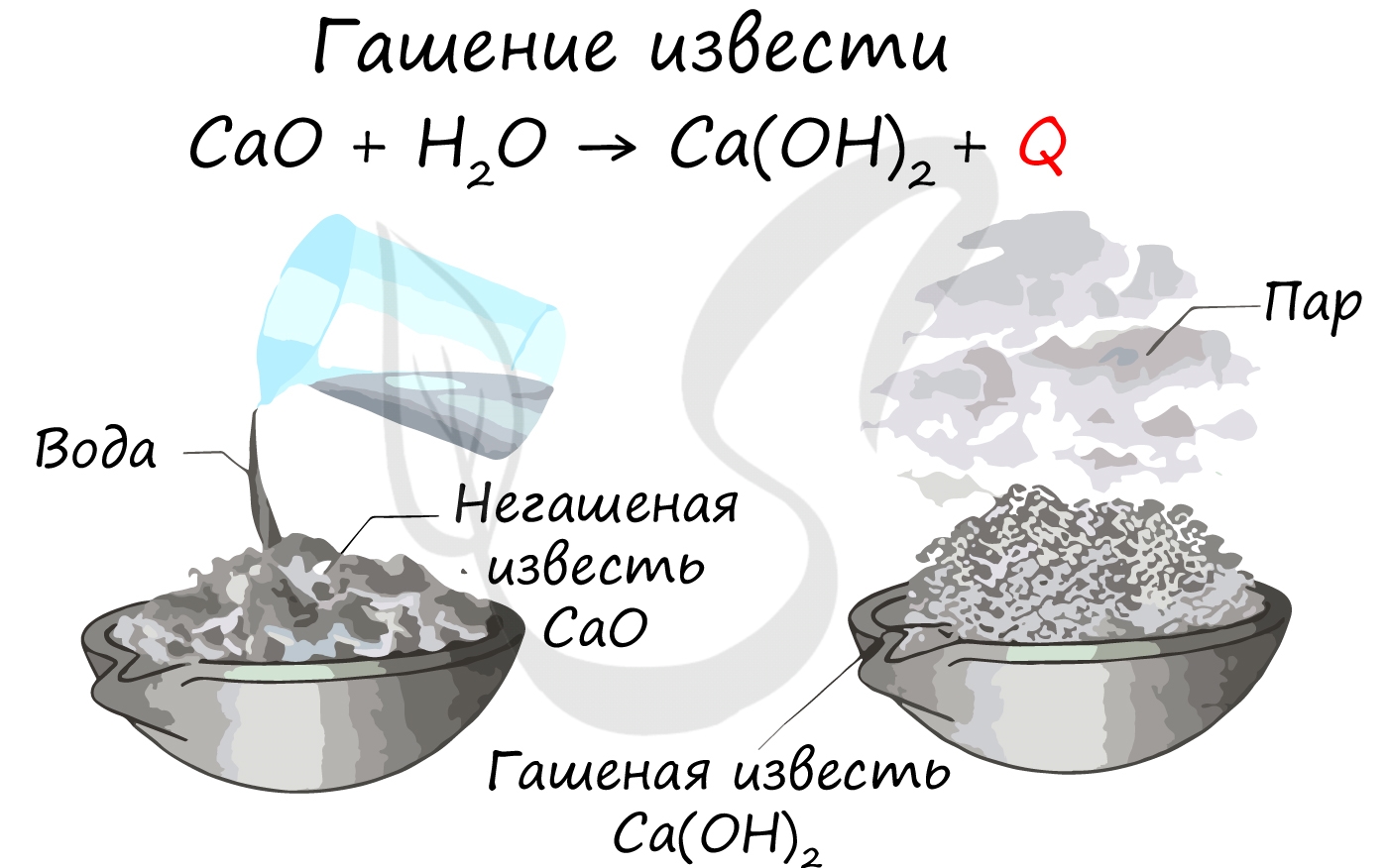
Получение
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
Рекомендую взять на вооружение общую схему разложения нитратов:
Химические свойства
В нее вступают все, кроме оксида бериллия.
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)
Гидроксиды щелочноземельных металлов
Получение
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
Химические свойства
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.
Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
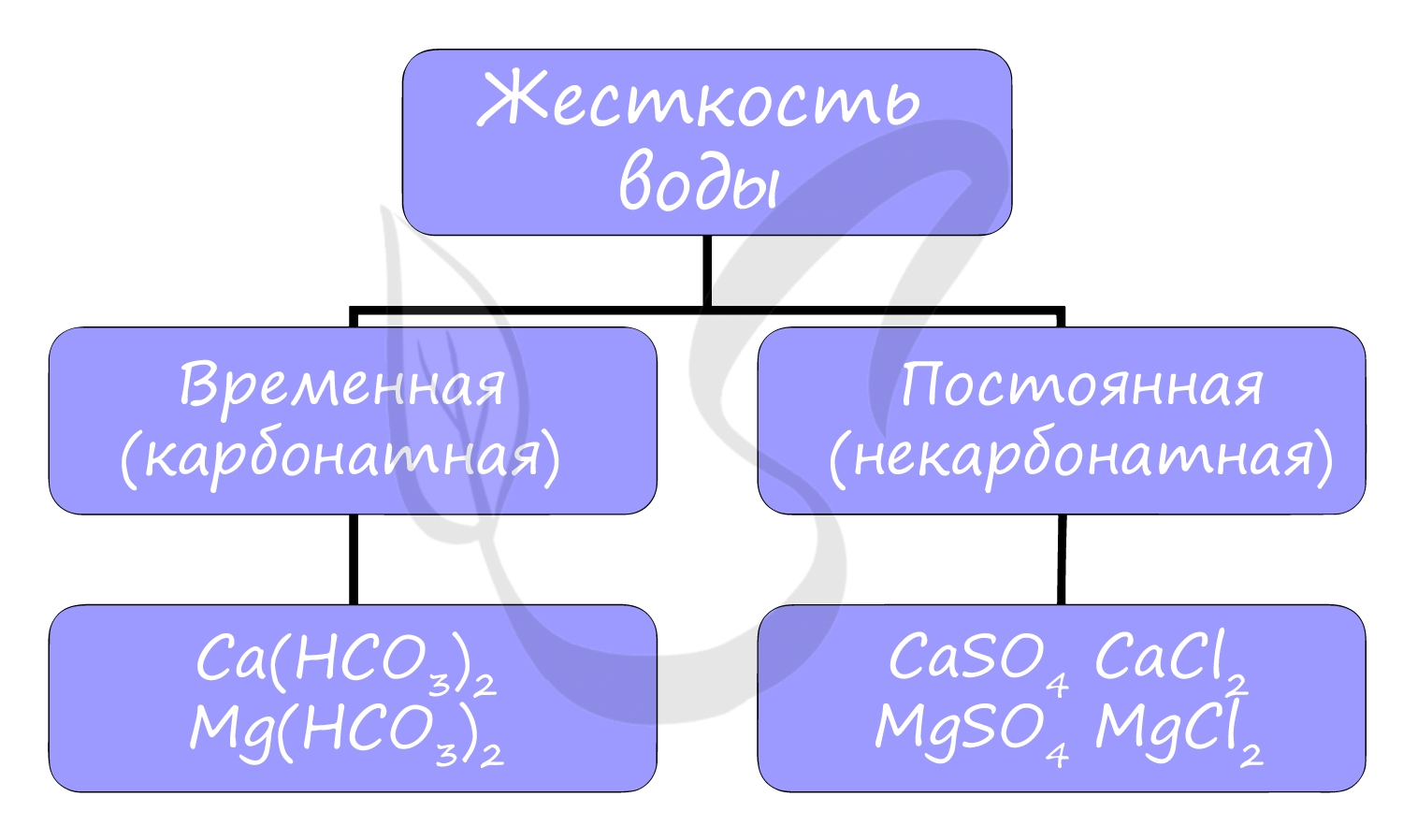
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Щелочноземельные металлы
Оксид бериллия
Оксид бериллия — неорганическая бинарное соединение бериллия и кислорода состава BeO. Представляет собой белые гексагональные кристаллы. Проявляет амфотерные свойства.
Благодаря своей тугоплавкости применяется для изготовления тиглей и облицовки печей. Распространен в составе минералов берилла, хризоберилла, фенакита и гельвин. Данное соединение является канцерогеном.
Распространение в природе
Оксид бериллия распространен в природе преимущественно в виде силикатов. Важнейшими минералами для получения BeO является берилл, хризоберилл, фенакит и гельвин. Несколько меньшее содержание BeO наблюдается также в бромелити, эвклаз, даналити.
Химические свойства
Оксид бериллия не реагирует с водой. Проявляет амфотерные свойства — взаимодействует как с кислотами, так и со щелочами (и соответствующими оксидами):



Оксид легко поддается флуоруванню:


С помощью сильных восстановителей, например, магния или графита, бериллий можно восстановить из оксида:

Получение
Кроме извлечения из минералов, оксид бериллия можно синтезировать в лабораторных условиях. Оксид образуется в результате сгорания металлического бериллия на воздухе, а также при термической диссоциации кислородсодержащих соединений бериллия:




Безопасность
Оксид бериллия, как и другие его соединения, относятся к канцерогенам. Длительный контакт с соединением способен вызывать появление бериллиевой болезни или бериллиоза.
Применение
Бериллий оксид применяют в качестве катализатора, а также как огнеупорный материал для изготовления тиглей и внутренней облицовки электрических печей.