с чем реагирует бромоводород
Соединения брома
Бромоводород (НBr)
Способы получения бромоводорода
Химические свойства бромоводорода
НВr по физическим и химическим свойствам сходен с HCl, однако молекула НВr менее устойчива, чем HCl.
Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
Кислородные кислоты и окислы брома
Бромноватистая кислота (HBrO)
HBrO — слабая неустойчивая кислота. В свободном виде не выделена. Максимально полученная концентрация HBrO в водном растворе — 30 %.
Ее соли и сложные эфиры называют гипобромитами.
Получение бромноватистой кислоты
HBrO получается при диспропорционировании брома в воде. Присутствие оксида ртути (II) смещает равновесие в сторону кислоты:
В полученном растворе концентрация бромноватистой кислоты не более 6 %.
Химические свойства бромноватистой кислоты
В темноте также при нагревании выше 60ºС:
3HBrO = HBrO3 + 2HBr
HBrO + NaOH = NaBrO + H2O
Бромистая кислота (HBrO2)
Бромистая кислота HBrO2 —неустойчивое соединение, существует только в водных растворах. Разлагается в течение 4 часов.
Образует соли — бромиты, например бромит бария Ba(BrO2)2•H2O.
Бромноватая кислота (HBrO3)
Бромноватая кислота HBrO3 — бесцветная (или слегка желтоватая) жидкость. В свободном состоянии не выделена, существует в растворе с максимальной концентрацией до 50%. Является сильной кислотой.
Получение бромноватой кислоты
Химические свойства бромноватой кислоты
Cоли бромноватой кислоты – броматы
Наиболее важными являются броматы калия и натрия – это белые вещества, хорошо растворимые в воде. Являются окислителями и слабыми восстановителями
Получение броматов
Химические свойства броматов
Бромная кислота (HBrO4)
Бромная кислота HBrO4 — сильная кислота. Cуществует только в водном растворе с максимальной концентрацией 83%. В свободном виде не выделена, устойчива в растворе с концентрацией менее 55%.
Соли кислоты — перброматы.
Получение бромной кислоты
NaBrO3 + F2 + 2NaOH = NaBrO4 + 2NaF + H2O
Химические свойства бромной кислоты
Соли бромной кислоты – перброматы
Наиболее выжный – пербромат калия. Белое вещество, умеренно растворимое в воде.
Получение перброматов
Химические свойства перброматов
Оксиды брома
Известны оксиды брома — Вr2O, ВrO2 и Вr3O8, которые крайне неустойчивы.
Ни одно из кислородных соединений брома не нашло важного практического применения
С чем реагирует бромоводород водород вода
Бромоводород
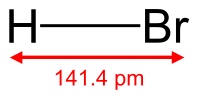 |  |
Бромоводород (HBr) — соединение брома с водородом. Бесцветный тяжёлый токсичный газ, образует туман в сыром воздухе.
Содержание
Получение
В промышленности бромоводород получают непосредственным взаимодействием простых веществ:
Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений
В лаборатории получают гидролизом трибромида или пентабромида фосфора:
Восстановление брома несколькими способами:
Вытеснение из бромидов щелочных металлов разбавленной кислотой:
Физические свойства
Бромистый водород — это бесцветный ядовитый газ с резким запахом, сильно дымящий на воздухе. Термически очень устойчив.
Хорошо растворим в воде: 221 г/100 г воды при 0 °C (193 при 25°, 130 при 100 °C). Водный раствор образует азеотропную смесь с 47,63 % HBr, которая кипит при 124,3 °C.
Растворяется в этаноле, образуя слабый электролит.
При охлаждении водных растворов HBr можно получить кристаллогидраты:
Чистый HBr образует кристаллы орторомбической сингонии, пространственная группа F mmm, параметры при −173 °C a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4.
Химические свойства
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
Как кислота реагирует с металлами, их оксидами, основаниями:
Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы со временем окрашиваются в бурый цвет:
Применение
Применяют для приготовления бромидов, синтеза различных органических бромпроизводных и для реактивного ионного травления.
Транспортировка
Безводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм.
Токсичность
Бромистый водород — едкое, весьма токсичное вещество, обладающее удушающим действием. Предельно допустимая концентрация = 10 мг/м³, поражающая токсодоза = 2,4 мг/л·мин.
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время.
Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте.
Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши.
Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить».
Этим вы поможете сделать сайт лучше.
К сожалению, регистрация на сайте пока недоступна.
На сайте есть сноски двух типов:
Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего.
Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения.
Здесь вы можете выбрать параметры отображения органических соединений.
Бромоводород
| Бромоводород | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | бромоводород |
| Традиционные названия | Бромистый водород |
| Химическая формула | HBr |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветный газ |
| Отн. молек. масса | 80,91 а. е. м. |
| Молярная масса | 80,91 г/моль |
| Плотность | газ (25 °C), 3,307 г/л, жидкий (−68 °C) 2,17 г/см³ |
| Термические свойства | |
| Температура плавления | –86.80 °C |
| Температура кипения | –66.38 °C |
| Критическая точка | 90,0 °C, 8,54 МПа |
| Энтальпия образования (ст. усл.) | -34,1 кДж/моль |
| Удельная теплота испарения | 17,61 кДж/моль |
| Удельная теплота плавления | 2,3 кДж/моль |
| Химические свойства | |
| pKa | ≈ –9 |
| Растворимость в воде | 193 (20 °C) г/100 мл |
| Структура | |
| Дипольный момент | 0,24 Д |
| Классификация | |
| Рег. номер CAS | 10035-10-6 |
| Рег. номер EINECS | 233-113-0 |
Бро́моводоро́д (HBr) — соединение брома с водородом. Бесцветный газ, образует туман в сыром воздухе.
Содержание
Получение
В промышленности бромоводород получают непосредственным взаимодействием элементов:
Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений
В лаборатории получают гидролизом трибромида или пентабромида фосфора:

Восстановление брома несколькими способами:

Вытеснение из бромидов щелочных металлов разбавленной кислотой:
Физические свойства
Бромистый водород это бесцветный газ с резким запахом, сильно дымящийся на воздухе. Термически очень устойчив.
Хорошо растворим в воде: 221 г/100 г воды при 0 °C (193 при 25°, 130 при 100 °C). Водный раствор образует азеотропную смесь с 47,63 % HBr, которая кипит при 124,3 °C.
Растворяется в этаноле, образуя слабый электролит.
При охлаждении водных растворов HBr можно получить кристаллогидраты:
Чистый HBr образует кристаллы орторомбической сингонии, пространственная группа F mmm, параметры при −173 °C a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4.
Химические свойства
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
Как кислота реагирует с металлами, их оксидами, основаниями:


Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы, со временем, окрашиваются в бурый цвет:
Применение
Применяют для приготовления бромидов, синтеза различных органических бромпроизводных.
Транспортировка
Безводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм.
Токсичность
Предельно допустимая концентрация = 10 мг/м³, поражающая токсодоза = 2,4 мг/л·мин.
Литература
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | — | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Бромоводород» в других словарях:
бромоводород — vandenilio bromidas statusas T sritis chemija formulė HBr atitikmenys: angl. hydrobromic acid; hydrogen bromide rus. бромоводород; водорода бромид … Chemijos terminų aiškinamasis žodynas
бромоводород — (бромистый водород), HBr, бесцветный дымящий на воздухе газ с резким неприятным запахом, tпл –86,91°C, tкип –66,7°C. Водный раствор бромоводородная кислота. Применяют для синтеза бромидов, органических бромпроизводных … Энциклопедический словарь
БРОМОВОДОРОД — (бромистый водород), НВr, бесцв. дымящий на воздухе газ с резким неприятным запахом, tпл 86,91 °С, tкип 66,7 °С. Вод. р р бромоводородная кислота. Применяют для синтеза бромидов, органич. бромпроизводных … Естествознание. Энциклопедический словарь
бромоводород — бромистый водород … Cловарь химических синонимов I
бромистый водород — бромоводород … Cловарь химических синонимов I
Бромистый водород — Бромоводород Общие Систематическое наименование бромоводород Химическая формула … Википедия
Бромоводородная кислота — Бромоводород Общие Систематическое наименование бромоводород Химическая формула … Википедия
Пенополистирол — Структура пенополистирола при большом увеличении Пенополистирол лёгкий газонаполненный ма … Википедия
Галогены — фтор, хлор, бром, йод; входят в VII группу периодической системы. Все члены группы образуют соединения с водородом, причем связь их повышается с уменьшением атомной массы; температура образования различных солей уменьшается с увеличением атомной… … Российская энциклопедия по охране труда
Йод — (хим.) один из элементов группы галоидов, химический знак J, атомный вес 127, по Стасу 126,85 (О = 16), открыт Куртуа в 1811 г. в маточном рассоле золы морских водорослей. Природа его, как элемента, установлена Гей Люссаком и им же ближе… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона











