ингибиторы интерлейкина что это
Ингибитор интерлейкина-6 (тоцилизумаб) для лечения васкулита крупных сосудов с тяжелой коморбидной патологией
Артериит Такаясу (АТ) и гигантоклеточный артериит (ГКА) относят к группе системных васкулитов с преимущественным поражением крупных сосудов, аорты и ее главных ветвей. Прогресс в ревматологии, вызванный внедрением генно-инженерных биологических препаратов (ГИБП) и расширением представлений о механизмах развития системных васкулитов, создал предпосылки для разработки нового направления фармакотерапии этих заболеваний, связанного с ингибированием интерлейкина (ИЛ)-6 (тоцилизумаб, ТЦЗ). По данным двух рандомизированных клинических исследований, у больных ГКА частота достижения ремиссии в результате лечения ТЦЗ была достоверно выше, чем в группе плацебо (р=0,03-0,0001), как и безрецидивная выживаемость через 52 недели (85% и 20%, соответственно, р≤0,001), а частота серьезных нежелательных реакций составила 14-35%. В единственном рандомизированном клиническом исследовании у больных АТ безрецидивная выживаемость через 6 месяцев поддерживающего лечения ТЦЗ была выше, чем в группе плацебо (51% и 23%, соответственно), но различия не достигли статистической значимости (р=0,0596). При этом серьезные нежелательные реакции на фоне лечения ТЦЗ встречались в два раза реже, чем в группе плацебо (5,6% и 11,1%, соответственно). В 2017 г. ТЦЗ был одобрен для лечения ГКА в США и Европе. В собственной серии наблюдений у 8 больных ГКА и 2 пациентов с АТ (у всех пациентов имелась тяжелая коморбидная патология, повышавшая риск нежелательных эффектов глюкокортикоидов) применение ТЦЗ в дозе 2,3-8,8 мг/кг в течение 1-10 месяцев позволило уменьшить дозу преднизолона и относительно быстро достичь ремиссии (у 8 из 10) или улучшения (у 2 из 10) системного васкулита. Рецидив после прекращения терапии ТЦЗ развился у 1 из 8 больных ГКА и у обеих пациенток с АТ, однако возобновление терапии ТЦЗ в двух случаях позволило вновь достичь ремиссии. Лечение ТЦЗ сопровождалось одним серьезным нежелательным явлением (гнойный локтевой бурсит). Случаев смерти не было. Применение ингибиторов ИЛ-6 у больных системными васкулитами с преимущественным поражением крупных сосудов, прежде всего ГКА, в том числе с тяжелой коморбидной патологией, можно рассматривать как потенциально эффективную и относительно безопасную лечебную стратегию при неэффективности, непереносимости или наличии противопоказаний к стандартной терапии.
Артериит Такаясу (АТ) и гигантоклеточный артериит (ГКА) относят к группе системных васкулитов с преимущественным поражением крупных сосудов [1]. АТ, как правило, развивается у пациентов моложе 50 лет и характеризуется артериитом, часто гранулематозным, с преимущественным поражением аорты и/или ее главных ветвей. ГКА, ранее известный под названием болезнь Хортона, – это артериит, часто гранулематозный, с поражением аорты и/или ее главных ветвей (преимущественно сонных и позвоночных артерий, с частым поражением височной артерии), который, как правило, развивается у пациентов старше 50 лет и нередко (у 40-60% больных) сочетается с ревматической полимиалгией (РПМ). При ГКА возможно тяжелое поражение коронарных артерий (коронарит), грудной и брюшной аорты с формированием аневризмы и диссекцией, краниальных артерий с развитием ишемической нейропатии зрительного нерва, которая при отсутствии лечения приводит к потере зрения.
Стандартная терапия системных васкулитов с преимущественным поражением крупных сосудов предполагает прежде всего применение глюкокортикоидов (ГК). Рекомендуемая начальная доза преднизолона при неосложненном ГКА составляет 0,7 мг/кг/сут, при ГКА с поражением органа зрения и при АТ – 1 мг/кг/сут [2,3]. Присоединение МТ показано при наличии ограничений для применения ГК, рефрактерном течении ГКА (в дозе 10-15 мг в неделю) [2] и АТ (20-25 мг в неделю) [4]. По данным мета-анализа, у больных ГКА назначение МТ снижает риск рецидива заболевания и уменьшает кумулятивную дозу ГК [5], в то как применение ГК и МТ у больных АТ может быть недостаточным для достижения полной устойчивой ремиссии [6]. Так, D.Freitas и соавт. при инструментальном об следовании на фоне лечения ГК и МТ в 75% случаев выявляли прогрессирование заболевания с новой локализацией сосудистого поражения [7]. По данным других авторов, при снижении дозы ГК у 22-72% больных АТ развиваются рецидивы заболевания 8.
Дальнейшее совершенствование методов лечения системных васкулитов с преимущественным поражением крупных сосудов относится к актуальным вопросам ревматологии, поскольку разнообразные нежелательные реакции при терапии ГК и МТ могут конкурировать по тяжести с проявлениями системного васкулита, в частности у пожилых пациентов с ГКА, и различными сопутствующими заболеваниями или вторичной артериальной гипертонией, обусловленной поражением почечных артерий, у больных АТ. При этом стандартное лечение может быть недостаточным для достижения полной устойчивой ремиссии и возможна рефрактерность системного васкулита к терапии ГК и МТ [6].
Прогресс в ревматологии, вызванный внедрением генно-инженерных биологических препаратов (ГИБП), создал предпосылки для разработки нового направления фармакотерапии системных васкулитов с преимущественным поражением крупных сосудов, связанного с ингибированием интерлейкина (ИЛ)-6. Значение ИЛ-6 как потенциальной мишени для лечения системных васкулитов с преимущественным поражением крупных сосудов подтверждается наличием выраженной экспрессии РНК ИЛ-6, продукции ИЛ-6 в тканях пораженных сосудов у больных ГКА [11,12] и АТ [13,14], повышением в сыворотке крови концентрации ИЛ-6 и его растворимого рецептора (ИЛ-6Р) 17. При этом с активностью ГКА коррелирует уровень сывороточного ИЛ-6 [16,17], а с активностью АТ – растворимого ИЛ-6Р [16].
ИЛ-6 является плейотропным цитокином, который синтезируется многими клетками и обладает широким спектром провоспалительных биологических эффектов 23. Эффекты ИЛ-6 ассоциируются с увеличением концентрации белков острой фазы воспаления, анемией, тромбоцитозом и лихорадкой, характерными для активной стадии системных васкулитов с преимущественным поражением крупных сосудов. ИЛ-6 осуществляет передачу внутриклеточного сигнала двумя путями: классической сигнализацией, обусловленной связыванием ИЛ-6 с мембранным ИЛ-6Р, и транс-сигнализацией (trans-signalling), механизмы которой определяются следующими факторами. Поскольку ИЛ-6Р не имеет тирозинкиназного домена и не способен участвовать в передаче внутриклеточного сигнала, для чего необходим другой белок (мембранный гликопротеин с молекулярной массой 130 кДа, gp130), принципиально важное значение имеет тот факт, что наряду с мембранным ИЛ-6Р, существует растворимая форма ИЛ-6Р (без трансмембранного и цитоплазматического доменов). Связывание растворимого ИЛ-6Р с ИЛ-6 приводит к образованию комплекса, который обладает способностью связываться с gp130 и индуцировать передачу ИЛ-6 зависимого активационного сигнала (транс-сигнализация) в клетках, не экспрессирующих мембранный ИЛ-6Р. Оба пути сигнализации приводят к активации JAK (Janus family tyrosine kinase) тирозин киназы, вызывающей рекрутирование и фосфорилирование латентных факторов транскрипции STAT (signal transducers and activators of transcription)-1 и STAT-3, регулирующих синтез широкого спектра провоспалительных медиаторов. Полагают, что транс-сигнализация ИЛ-6, связанная с экспрессией gp130, лежит в основе патологических провоспалительных эффектов ИЛ-6, в то время как классическая сигнализация, опосредуемая ИЛ-6Р, в большей степени участвует в регуляции иммунного гомеостаза, в том числе подавлении воспаления, гемопоэзе, метаболизме липидов, глюкозы и поддержании целостности эпителиального барьера. В то же время необходимо учитывать, что ИЛ-6Р зависимая классическая сигнализация также участвует в индукции острофазового ответа, образовании Th17 и Th22 клеток, пролиферации Th1 клеток и подавлении образования патогенных Foxp3 (Forkhead box P3) Трег клеток.
Тоцилизумаб (ТЦЗ) – рекомбинантное гуманизированное моноклональное антитело к человеческому рецептору ИЛ-6 из подкласса иммуноглобулинов IgG1, которое селективно связывается с растворимыми и мембранными рецепторами ИЛ-6 и подавляет классический и транс-сигнальный рецепторные пути ИЛ-6. Показано, что у больных ГКА на фоне лечения ТЦЗ, но не ГК, наблюдается нормализация популяции Трег с увеличением числа активированных Трег (CD45RAFoxp3high) и Трег, экспрессирующих хемокиновый рецептор CCR4 и CTLA-4 (cytotoxic T-lymphocyte-associated protein 4), обеспечивающий супрессорные эффекты Трег [23]. Для ГКА характерно ослабление пролиферации Трег и увеличение числа патогенных Трег, синтезирующих ИЛ-17, что связывают с экспрессией гипофункциональной изоформы Foxр3 – основного фактора транскрипции, определяющего активность Трег.
Расширение представлений о ключевых механизмах развития системных васкулитов с преимущественным поражением крупных сосудов в последнее время дополняется доказательной базой эффективности терапии, направленной на ингибирование ИЛ-6. Начиная с 2008 года, появляются отдельные сообщения об успешном применении ТЦЗ для лечения АТ [24,25], а с 2011 г. – ГКА и РПМ [26,27], прежде всего при рефрактерности к стандартной терапии или противопоказаниях к ее назначению. В 2016 г. опубликованы результаты рандомизированного, плацебо-контролируемого исследования III фазы [28], в котором изучались безопасность и эффективность ТЦЗ для поддержания ремиссии рефрактерного АТ, и двух двойных-слепых рандомизированных, плацебо-контролируемых исследований, в которых оценивали безопасность и эффективность индукционной и поддерживающей терапии ТЦЗ у больных ГКА (табл. 1) 29.
| ГКА, активная стадия | АТ, ремиссия | |||||||
| Двойное-слепое III фазы (GiACTA), 2016 [30,31] | Двойное-слепое II фазы, 2016 [29] | Двойное-слепое III фазы, 2016 [32] | ||||||
| Плацебо + ГК коротко (n=50) | Плацебо + ГК длительно (n=51) | ТЦЗ п/к 162 мг/нед + ГК (n=100) | ТЦЗ п/к 162 мг/2 нед + ГК (n=49) | Плацебо + ГК (n=10) | ТЦЗ в/в 8 мг/кг/мес + ГК (n=20) | Плацебо + ПЗ 0,52 мг/кг/сут (n=18) | ТЦЗ п/к 162 мг/нед + ПЗ 0,57 мг/кг/сут (n=18) | |
| Примечание:* р | ||||||||
| Средний возраст, пол | 69 лет; М:Ж=1:3 | 70 лет; М:Ж=1:2,3 | 31 год; М:Ж=1:8 | 31 год; М:Ж=1:5 | ||||
| Эффект лечения | Ремиссия через 52 недели | Ремиссия через 12 недель | Рецидивы | |||||
| 14,0% | 17,6% | 56,0%* | 53,1%* | 40% | 85%** | 61,1% | 44,4% | |
| Безрецидивная выживаемость через 52 недели | Безрецидивная выживаемость через 24 недели | |||||||
| 20% | 85% *** | 22,9% | 50,6% | |||||
| Средняя кумулятивная доза ПЗ через 52 нед. | 3296 мг | 3817 мг | 1862 мг *** | 1862 мг *** | 110 мг/кг | 43 мг/кг | нет данных | |
| Нежелательные реакции | 96% | 92,2% | 98,8% | 95,9% | 70% | 75% | 61,1% | 77,8% |
| Серьезные | 22% | 25,5% | 15,0% | 14,3% | 50% | 35% | 11,0% | 5,5% |
В рандомизированном клиническом исследовании у больных АТ на фоне поддерживающей терапии ТЦЗ безрецидивная выживаемость через 6 месяцев составила 50,6% и была выше, чем в группе плацебо (22,9%), но различия не достигли статистической достоверности (р=0,0596) [32]. В соответствии с результатами двух рандомизированных клинических исследований у боль ных ГКА частота достижения ремиссии в результате лечения ТЦЗ была достоверно выше, чем в группе плацебо (р=0,03-0,0001), как и безрецидивная выживаемость через 52 недели (соответственно, 85% и 20%, р≤0,001) 29. Результаты одного из этих исследований III фазы (GiACTA [30]) стали основанием для одобрения ТЦЗ для лечения ГКА управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA) и регулирующим органом Новой Зеландии (Medsafe) в мае 2017 г., а также Европейской комиссией в ноябре 2017 г.
Мы применяли ТЦЗ у 8 больных ГКА и 2 пациентов с АТ, у которых имелись тяжелые сопутствующие заболевания, потенциально повышавшие риск нежелательных эффектов ГК (табл. 2). В половине случаев ТЦЗ назначали в дебюте заболевания, у остальных 5 пациентов – в связи с недостаточной эффективностью стандартной терапии или рецидивом заболевания.
| Возраст, пол, диагноз | До лечения ТЦЗ | В период назначения ТЦЗ | Результаты лечения ТЦЗ | ||||||
| Особенности течения | Длит. васкулита, макс. доза ПЗ, др. лечение | Коморбидная патология | Доза ПЗ, мг/сут | СРБ мг/л | ИЛ-6 пг/мл | Длит. терапии и доза | Эффект/ длительность наблюдени | НР | |
| Примечание: ремиссия: 8/10, улучшение: 2/10, отмена ГК: 3/9, рецидив: 3/10, нежелательные реакции (НР): 4/10, серьезные: 1/10; средняя длительность наблюдения 23 мес (2-60) мес.Верхняя граница нормы ИЛ-6 – 7 пг/мл, верхняя граница нормы СРБ – 5 мг/л; ХОБЛ – хроническая обструктивная болезнь легких; АЗА – азатиоприн; МТ – метотрексат; ВАШ – визуальная аналоговая шкала интенсивности головной боли по оценке пациента, ГК – глюкокортикоиды, ТЦЗ – тоцилизумаб, ПЭТ – позитронно-эмиссионная томография | |||||||||
| 84/М ГКА | Задняя ишемическая нейропатия правого глаза, амавроз | 4 мес 40 мг МТ 7,5 мг | Синдром Иценко-Кушинга, стероидный СД инсулинопотребный, тяжелая стероидная миопатия, ХОБЛ, гнойный бронхит, гипертоническая болезнь, ИБС | 32,5 | 22,5 | 21,9 | 11 мес 7,1-2,3 мг/кг | Ремиссия с отменой ГК 28 мес | Розацеа через несколько месяцев после отмены ТЦЗ |
| 71/Ж ГКА+ РПМ | Преходящие нарушения зрения | 1 мес 20 мг | Реэндопротезирование сустава, остеомиелит, дивертикулез, кишечная непроходимость | 20 | 124 | 12,2 | 3 мес 5,3 мг/кг | Ремиссия с отменой ГК 29 мес | Нет |
| 61/Ж ГКА | Поражение аорты и крупных артерий по данным ПЭТ | 10 мес 20 мг | Синдром Иценко-Кушинга, ожирение, катаракта | 20 | 9,5 | 16,7 | 2 мес 5 мг/кг | Ремиссия, ПЗ 2,5 мг 22 мес | Нет |
| 67/Ж ГКА | Преходящие расстройства зрения | 2 мес 20 мг | Синдром Иценко-Кушинга, стероидные миопатия и СД, катаракта, гипертоническая болезнь | 20 | 2,0 | 2,4 | 4 мес 4-8 мг/кг | Ремиссия, ПЗ 2,5 мг 14 мес | Гнойный локтевой бурсит через 1 мес после отмены ТЦЗ |
| 77/Ж ГКА+ РПМ | Ишемическая нейропатия правого глаза, амавроз | 19 мес 30 мг МТ 10 мг | ИБС, гипертоническая болезнь, бронхиальная астма, прогрессирующий остеопоро | 10 МТ 10 мг | 7,7 | 7,5 | 1 мес 4,3-8,5 мг/кг | Ремиссия, ПЗ 2.5 мг, МТ 7,5 мг. Рецидив через 4 мес (отмена МТ). | Нет |
| 73/Ж ГКА | Ишемическая нейропатия правого глаза | 1 мес Дипроспан в/м №1 МТ 10 мг | Гипертоническая болезнь, глаукома | нет | 127 | — | 1 мес 4 мг/кг | 6 мес Ремиссия, МТ 10 мг/нед 10 мес | Липодерматосклероз голени через 4 месяца после отмены ТЦЗ |
| 66/Ж ГКА | Ишемическая нейропатия левого глаза, амавроз, коронарит | 6 мес 60 мг | Синдром Иценко-Кушинга, катаракта, осложненный остеопороз | 15 | 38,9 | — | 5 мес 4,4-8,8 мг/кг | Ремиссия, ПЗ 2,5 мг 24 мес | Нет |
| 80/Ж ГКА | Ишемическая нейропатия левого глаза, амавро | 0,5 мес 70 мг | Гипертоническая болезнь | 70 | 1 | 7,9 | 2 мес 5,3 мг/к | Улучшение, ПЗ 47,25 мг 2 мес | Нет |
| 28/Ж АТ | Рефрактерное течение, окклюзия протеза сонной артерии | 11 мес 40 мг АЗА 100 мг | Синдром Иценко-Кушинга, артериальная гипертония, ожирение | 40 АЗА 75 мг | 108 | — | 4 мес, затем 10 мес 8-6 мг/кг | Ремиссия, рецидив с последующей ремиссией, ПЗ 10 мг, роды. 60 мес | Герпес |
| 24/Ж АТ | Поражение грудной и брюшной аорты по данным ПЭТ | Нет | Туберкулез легких | Нет | 21,2 | — | 4 мес 8 мг/кг | Улучшение, ухудшение после отмены ТЦЗ. 54 мес | Нет |
У 6 пациентов ГКА наблюдалось поражение органа зрения, в 4 случаях осложнившееся амаврозом, в одном случае ГКА при позитронно-эмиссионной томографии (ПЭТ) диагностировано поражение аорты и крупных артерий, еще в одном случае обсуждалось развитие коронарита, а у двух пациентов отмечалось сочетание ГКА и РПМ. В одном случае АТ развился тромбоз протеза сонной артерии, в другом отмечалось распространенное поражение сосудов с вовлечением грудной и брюшной аорты, подтвержденное при ПЭТ. Сопут ству ющие заболевания имелись у всех 10 пациентов и включали в себя туберкулез (у пациентки с АТ), остеопороз (у 2 больных ГКА), в одном случае осложненный, продолжительную артериальную гипертонию (у 6), ишемическую болезнь сердца (у 2), заболевания глаз, в том числе глаукому и катаракту (у 3), остеомиелит и дивертикулит, недавно осложнившийся эпизодом кишечной непроходимости (у 1), хроническую обструктивную болезнь легких с недавно перенесенным гнойным бронхитом (у 1), бронхиальную астму (у 1), ожирение (у 2). У 4 больных выявили выраженный медикаментозный синдром Иценко-Кушинга, который в двух случаях сопровождался стероидной миопатией, а у одного пациента – стероидным инсулинопотребным сахарным диабетом (СД). У 4 из 10 пациентов имелись по крайней мере три клинически значимых сопутствующих заболевания.
Внутривенное введение ТЦЗ в дозе 2,3-8,8 мг/кг в течение 1-10 месяцев позволило уменьшить дозу преднизолона (до 2,5 мг в сутки у 4 из 9 больных) или отменить его (у 3 из 9), тем самым предотвратив развитие или прогрессирование нежелательных реакций, и относительно быстро добиться ремиссии системного васкулита (у 8 из 10 пациентов) или клинического улучшения (у 2 из 10). Рецидив после прекращения терапии ТЦЗ развился у 1 из 8 больных ГКА и у 2 пациенток с АТ, однако возобновление терапии ТЦЗ в двух случаях позволило вновь достичь ремиссии. Лечение ТЦЗ лишь в 1 из 10 случаев сопровождалось серьезной нежелательной реакцией (гнойный локтевой бурсит у пациентки с ГКА). Случаев смерти не было.
Одним из важных аспектов системных васкулитов с преимущественным поражением крупных сосудов является нередкое наличие разнообразной, в том числе тяжелой, коморбидной патологии, осложнений заболевания или нежелательных эффектов терапии, оказывающих существенное влияние на выбор схемы лечения и ограничивающих возможности применения стандартной терапии ГК. Так, по данным J. Schmidt и соавт., у больных ГКА смертность от инфекций была выше, чем в контрольной популяции (р
АНАКИНРА (ANAKINRA) ОПИСАНИЕ
Фармакологическое действие
Иммунодепрессант, ингибитор интерлейкина. Представляет собой рекомбинантную версию антагониста рецептора интерлейкина-1 (IL-1ra) человеческого, продуцированного штаммом E.coli с использованием технологии рекомбинантной ДНК.
Блокирует биологическую активность интелейкина-1α (ИЛ-1α) и интерлейкина-1β (ИЛ-1β) путем конкурентного ингибирования их связей с рецептором интерлейкина-1 типа I. Интерлейкин-1 (ИЛ-1) является ключевым провоспалительным цитокином, медиатором многих клеточных ответов, включая те, которые имеют важное значение при синовиальном воспалении.
Анакинра ингибирует реакции, индуцированные ИЛ-1 in vitro, в т.ч. индукцию оксида азота и простагландина Е 2 и/или синтез коллагеназы синовиальными клетками, фибробластами и хондроцитами.
Спонтанные мутации в гене CIAS1/NLRP3 былии обнаружены у большинства пациентов с криопирин-ассоциированными периодическими синдромами (CAPS). CIAS1/NLRP3 кодирует криопирин, компонент инфламмасомы. Активация инфламмасомы приводит к протеолитической матурации и секреции ИЛ-1β, который вызывает широкий спектр реакций, включая системное воспаление. У пациентов с CAPS, не получавших лечение, отмечают повышенный уровень С-реактивного белка (СРБ), амилоида А (САА) и ИЛ-6 в сыворотке крови по сравнению с нормальными уровнями. Было отмечено, что применение анакинры приводит к снижению уровней острофазных белков и уменьшению экспрессии ИЛ-6. Снижение уровней острофазных белков было зарегистрировано в течение первых недель лечения.
Фармакокинетика
После п/к введения анакинры в дозе 70 мг абсолютная биодоступность у здоровых добровольцев (n = 11) составляет 95%. Процесс абсорбции является фактором, ограничивающим скорость выведения анакинры из плазмы после п/к инъекции.
У пациентов на фоне лечения C max анакинры в плазме достигалась через 3-7 ч после п/к введения в клинически значимых дозах (от 1 до 2 мг/кг; n=18). Концентрация в плазме уменьшалась без очевидной фазы распределения, а T 1/2 составлял от 4 до 6 ч. У пациентов, получавших анакинру кумуляция не наблюдалась после ежедневного п/к введения в течение до 24 недель. Средние (SD) показатели клиренса и V d по результатам популяционного фармакокинетического анализа данных 35 пациентов составили 105 (27) мл/мин и 18.5 (11) л соответственно. Выводится почками. Клиренс анакинры возрастает с увеличением КК.
Показания активного вещества АНАКИНРА
Взрослым, подросткам и детям в возрасте от 8 месяцев и старше с массой тела от 10 кг и выше: лечение криопирин-ассоциированных периодических синдромов (CAPS), включая мультисистемное воспалительное заболевание неонатального возраста (NOMID)/хронический младенческий неврологический кожно-артикулярный синдром (CINCA); cиндром Макла-Уэллса (MWS); семейный холодовой аутовоспалительный синдром (FCAS).
Режим дозирования
Лечение проводит врач-специалист, имеющий опыт диагностики и лечения CAPS.
Для взрослых, подростков и детей в возрасте от 8 месяцев и старше с массой тела от 10 кг и выше начальная доза составляет 1-2 мг/кг/сут.
В течение 1-2 месяцев может потребоваться увеличение дозы с учетом терапевтического ответа и клинической ситуации.
Побочное действие
Противопоказания к применению
Повышенная чувствительность к анакинре или производным белка E.coli; нейтропения (АЧН 9 /л).
Указания в анамнезе на рецидивирующие инфекции или предрасполагающие факторы, которые могут привести к развитию инфекции; повышение активности печеночных ферментов в анамнезе или печеночную недостаточность тяжелой степени тяжести; почечную недостаточность средней степени тяжести (КК 30-59 мл/мин); бронхиальную астму; злокачественные новообразования; при необходимости применения вакцинации; пациенты пожилого возраста; у пациентов, принимающих одновременно варфарин или фенитоин.
Применение при беременности и кормлении грудью
Данные о применении анакинры при беременности ограничены. Результаты исследований на животных не указывают на наличие прямой или косвенной репродуктивной токсичности. В качестве меры предосторожности рекомендуется избегать применения анакинры во время беременности, а также женщинам детородного возраста, не использующих контрацепцию.
Неизвестно, выделяется ли анакинра/метаболиты с грудным молоком у человека. Риск для новорожденного ребенка/младенца не может быть исключен. Во время лечения анакинрой грудное вскармливание следует прекратить.
Эффективность тоцилизумаба у пациентов с COVID-19, госпитализированных в ОРИТ: ретроспективное когортное исследование
Изучить эффективность более раннего или позднего применения тоцилизумаба, т.е. до или после начала искусственной вентиляции легких (ИВЛ), в профилактике смерти у больных тяжелой COVID-19 ассоциированной пневмонией, которым потребовалась госпитализация в отделения реанимации и интенсивной терапии (ОРИТ) для респираторной поддержки.
Материалы и методы
В ретроспективное когортное исследование включали пациентов с тяжелой COVID-19 пневмонией, госпитализированных в связи с ухудшением оксигенации в ОРИТ российских лечебных учреждений с 16 марта по 5 мая 2020 г. Всем пациентам проводилась стандартная терапия, а часть больных получили также тоцилизумаб внутривенно в дозе 400 мг. Госпитальную летальность от любых причин сравнивали между группами пациентов, которым вводили и не вводили тоцилизумаб, с помощью модели логистической регрессии с поправкой на возраст и пол.
В исследование были включены 328 пациентов (57,0% мужчин, медиана возраста 59 лет), 159 из которых получили по крайней мере одну инфузию тоцилизумаба. Препарат применяли у 83 (60,1%) из 137 больных, находившихся на оксигенотерапии или неинвазивной вентиляции легких (более раннее введение), и 76 (39,8%) из 191 интубированного пациента (позднее введение). Ни более раннее, ни позднее введение тоцилизумаба не привело к снижению риска смерти по сравнению с соответствующими контрольными группами больных, не получавших ингибитор интерлейкина-6 (скорректированные по возКЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ И ТЕРАПИЯ, 2020, 29 (4) расту и полу отношения шансов составили 2,370, 95% ДИ 0,969-5,798; р=0,059, и 0,996, 95% ДИ 0,539-1,839; р=0,989, соответственно).
Более раннее введение тоцилизумаба у неинтубированных пациентов с тяжелой COVID-19 пневмонией и поздняя инфузия препарата после начала ИВЛ не привели к снижению летальности от всех причин.
Число пациентов с COVID-19 во многих странах продолжает быстро увеличиваться, а общее число зарегистрированных в мире случаев инфекции в ноября 2020 г. превысило 60 млн. Хотя в большинстве случаев инфекция, вызванная SARSCoV-2, характеризуется благоприятным течением, у 5-10% госпитализированных больных с вирусной пневмонией развивается острый респираторный дистресс синдром (ОРДС), требующий респираторной поддержки в отделении реанимации и интенсивной терапии (ОРИТ) 1. В российских ОРИТ летальность больных с ОРДС, вызванным SARS-CoV-2, составила в среднем около 65%, а основными предикторами неблагоприятного исхода были пожилой возраст, мужской пол и некоторые сопутствующие заболевания, в том числе ожирение, сахарный диабет 2 типа и коронарная болезнь сердца [4]. Летальность была достаточно низкой у пациентов, находившихся на оксигенотерапии (10,1%), и значительно уве личивалась у больных, которых приходилось переводить на неинвазивную (36,8%) и особенно искусственную (76,5%) вентиляцию легких.
Причиной развития быстро прогрессирующего поражения легких при COVID-19 считают гипериммунный воспалительный ответ, сопровождающийся выбросом различных цитокинов [5]. Ранее синдром выделения цитокинов, или «цитокиновый шторм», был описан при первичном и вторичном гемофагоцитарном лимфогистиоцитозе и синдроме активации макрофагов, а также при CAR-T-клеточной терапии онкологических заболеваний [6]. Хотя «цитокиновый шторм» упоминается практически во всех статьях, посвященных COVID-19, общепринятые критерии его диагностики до сих пор отсутствуют. На практике синдром выброса цитокинов предполагают у пациентов с SARS-CoV-2 пневмонией 3-4 стадии (т.е. с поражением более 50% легочной ткани), сопровождающейся снижением SpO2≤93%, стойкой лихорадкой и повышением содержания лабораторных маркеров воспаления, в том числе С-реактивного белка (до 100-400 мг/л и более), ферритина, фибриногена, интерлейкина (ИЛ)-6, а также Dдимера. R. Caricchio и соавт. при анализе лабораторных показателей и клинических проявлений более чем у 500 пациентов c COVID-19 пришли к выводу, что существующие критерии синдрома выброса цитокинов, такие как HScore и др., не позволяют идентифицировать это осложнение SARS-CoV-2 инфекции, и предложили собственные критерии, отражающие (1) воспаление, (2) гибель клеток и повреждение ткани и (3) преренальные электролитные нарушения (табл. 1). Эти критерии позволяли с достаточной точностью предсказать более длительную госпитализацию и летальность [7]. Следует отметить, что к числу критериев синдрома выброса цитокинов авторы отнесли увеличение абсолютного количества нейтрофилов, которое, по-видимому, указывает на важную роль врожденного иммунитета в развитии «цитокинового шторма» при COVID-19 и во многих случаях не является признаком вторичной бактериальной инфекции, требующим назначения антибиотиков.
| Необходимые критерии (все) | Значения |
| Симптомы COVID-19 | + |
| ПЦР на SARS-CoV-2 | ± |
| Матовые стекла на КТ | + |
| Ферритин | >250 нг/мл |
| СРБ | >46 мг/л |
| И (один показатель из каждого кластера) | |
| Кластер I | |
| Альбумин | 11400 в мм 3 |
| Кластер II | |
| АЛТ | >60 Ед/л |
| АСТ | >87 Ед/л |
| D-димер | >4930 нг/мл |
| ЛДГ | >416 Ед/л |
| Тропонин I | >1,09 нг/мл |
| Кластер III | |
| Анионный разрыв | 106 ммоль/л |
| Калий | >4,9 ммоль/л |
| Азот мочевины/креатинин | >29 |
Предполагаемая роль синдрома выброса цитокинов в патогенезе тяжелого поражения легких и других органов при COVID-19 послужила основанием для изучения эффективности различных антицитокиновых средств, в том числе ингибиторов интерлейкина (ИЛ)-6 (тоцилизумаба, сарилумаба, олокизумаба), ИЛ-1 (канакинумаба, анакинры) и янус-киназ (тофацитиниба, барицитиниба). Хотя ни один из перечисленных препаратов официально не зарегистрирован для лечения СOVID-19, во многих странах ингибиторы ИЛ-6 применяют в клинической практике (off-label) у больных с наиболее тяжелым течением этого заболевания. Дополнительным доводом в пользу возможной эффективности ингибиторов ИЛ-6 при COVID-19 послужил и тот факт, что в 2017 г. тоцилизумаб был зарегистрирован для лечения угрожающего жизни синдрома высвобождения цитокинов, вызванного химерным антигенным рецептором (CAR) T-клеток у пациентов с гемобластозами [8].
Первые сообщения об успешном опыте применения тоцилизумаба у больных с тяжелым течением COVID19 были опубликованы китайскими исследователями уже вскоре после начала пандемии SARS-CoV-2 инфекции [14,15]. В последующем эффективность препарата была продемонстрирована в многочисленных наблюдательных исследованиях, которые проводились в разных странах, в том числе России [16,17]. По данным недавно опубликованного мета-анализа 10 исследований (n=1358), введение тоцилизумаба у пациентов с тяжелым течением COVID-19 ассоциировалось со снижением смертности по сравнению с таковой в контрольной группе больных, которым не вводили ингибитор ИЛ-6 [18]. В то же время эффективность тоцилизумаба в профилактике неблагоприятных исходов COVID-19 не была подтверждена в нескольких недавно завершенных рандомизированных контролируемых исследованиях [19].
Результаты терапии у пациентов с COVID-19 могут зависеть от сроков введения противовоспалительных препаратов [20]. Соответственно, целью ретроспективного когортного исследования было изучение эффективности более раннего или позднего применения тоцилизумаба, т.е. до или после начала искусственной вентиляции легких (ИВЛ), в профилактике смерти у больных тяжелой COVID-19 ассоциированной пневмонией, которым потребовалась госпитализация в ОРИТ для респираторной поддержки.
Материал и методы
Дизайн исследования и критерии отбора пациентов. Ретро спективное когортное исследование проводилось в Федеральном дистанционном консультативном центре анестезиологии и реаниматологии для взрослых, созданном по приказу Минздрава РФ 16.03.2020 на базе Первого МГМУ им. И.М. Сеченова (Сеченовский Университет). В центр по интернет поступают заявки на консультацию больных с тяжелым течением COVID-19, госпитализированных в ОРИТ лечебных учреждений Москвы, Московской области и других регионов Российской Федерации. В ретроспективное исследование включали пациентов, которым консультанты центра рекомендовали введение тоцилизумаба, учитывая наличие двусторонней пневмонии, поражающей более 50% легочной ткани (т.е. 3-4 стадии) и требующей респираторной поддержки, особенно при наличии повышенной концентрации СРБ. Окончательное решение о введении тоцилизумаба принимали лечащие врачи. Следует отметить, что консультанты центра не имели информации о доступности ингибиторов ИЛ-6 в соответствующих регионах Российской Федерации и лечебных учреждениях и, соответственно, не могли предсказать, будет ли пациенту введен тоцилизумаб или нет.
Пациенты, включенные в исследование, были распределены на две когорты с учетом уровня респираторной поддержки (оксигенотерапия/неинвазивная вентиляция легких или ИВЛ) на момент инфузии тоцилизумаба или получения заявки на консультацию, если ИЛ-6 в конечном итоге не вводился.
Все пациенты подписывали информированное согласие на применение тоцилизумаба и других «экспериментальных» препаратов для лечения COVID-19 в лечебном учреждении.
Процедуры и исходы. На основании полученных заявок на консультацию регистрировали демографические показатели и сопутствующие заболевания, диагностированные до развития COVID-19 (артериальная гипертония, ишемическая болезнь сердца [ИБС], инсульт в анамнезе, фибрилляция предсердий, ожирение, сахарный диабет, бронхиальная астма, хроническая обструктивная болезнь легких [ХОБЛ], ревматические аутоиммунные заболевания, злокачественные опухоли, диагностированные в течение последних 5 лет, гемобластозы, ВИЧ-инфекция). Критериями диагноза ИБС считали острый инфаркт миокарда и/или вмешательства на коронарных артериях (стентирование или аортокоронарное шунтирование) в анамнезе. Ожирение диагностировали на основании индекса массы тела: 2 – нормальная масса тела, 25,0-29,9 кг/м 2 – избыточная масса тела, ≥30,0 кг/м 2 – ожирение. При анализе частоты ревматических заболеваний учитывали только аутоиммунные заболевания, такие как ревматоидный артрит, системная красная волчанка, системная склеродермия, псориатический артрит, анкилозирующий спондилит, системные васкулиты.
Лечение COVID-19 проводилось в соответствии с временными рекомендациями Минздрава РФ. С марта по май 2020 г. в качестве противовирусных препаратов чаще всего применяли гидроксихлорохин/хлорохин, азитромицин и лопинавир/ритонавир, реже – интерферон-β, в то время как глюкокортикостероиды в начала вспышки инфекции не рекомендовались. Доза тоцилизумаба составляла 400 мг внутривенно. Допускалось введение второй дозы препарата по решению лечащих врачей.
Результаты
C 16 марта по 5 мая 2020 г. были получены заявки на консультацию 2066 пациентов с COVID-19, которые были госпитализированы в ОРИТ в связи с ухудшением оксигенации (рис. 1). В этой выборке 328 больным (57,0% мужчин, медиана возраста 59 лет) было рекомендовано введение тоцилизумаба. Относительно невысокая частота назначения ингибитора ИЛ-6 объяснялась тем, что в начале вспышки SARS-CoV-2 инфекции в Российской Федерации данных о возможной эффективности препарата было недостаточно.
159 из 328 пациентов получили по крайней мере одну дозу препарата 400 мг (у 21 была выполнена вторая инфузия в той же дозе с интервалом около 24 ч), в то время как оставшимся 169 больных не вводили ингибитор ИЛ-6, как правило, из-за отсутствия препарата в лечебном учреждении. Тоцилизумаб был введен 83 (60,1%) из 137 больных, которым проводились оксигенотерапия или неинвазивная вентиляция легких (НИВЛ) на момент инфузии или отправки заявки лечебным учреждением (более раннее введение тоцили зумаба), и 76 (39,8%) из 191 интубированного пациента (позднее введение тоцилизумаба) (рис. 1). В первой когорте тоцилизумаб был введен через 6 дней (интерквартильный размах 3-9) после госпитализации, а во второй – через 2 дня (интерквартильный размах 1-4) после начала ИВЛ.
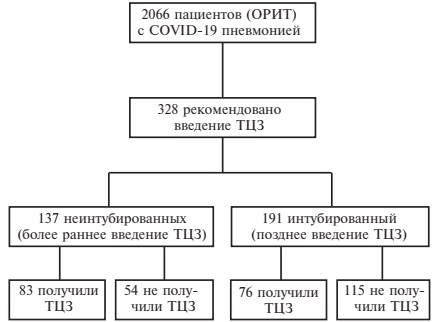
Группы больных, получивших или не получивших ингибитор ИЛ-6 на фоне оксигенотерапии или НИВЛ, были сопоставимы по возрасту и полу. У больных, которым вводили тоцилизумаб, частота некоторых заболеваний, которые могут ухудшить течение COVID-19, в том числе коронарной болезни сердца, инсульта в анамнезе и сахарного диабета 2 типа, была несколько выше, чем в группе сравнения, хотя разница не достигла статистической значимости (табл. 1). В когорте интубированных пациентов группы сравнения были сопоставимы как по демографическим показателям, так и по частоте всех сопутствующих заболеваний.
Во всей выборке летальность больных, получивших и не получивших тоцилизумаб, достоверно не отличалась (46,5% и 50,3%, соответственно, p=0,509). В обеих когортах основными причинами смерти были ОРДС (91,9% и 77,6%, соответственно), сердечно-сосудистые осложнения (5,4% и 12,9%) и тромбоэмболия легочной артерии (1,4% и 2,4%). Среди неинтубированных пациентов летальность была примерно в два раза ниже, чем среди больных, находившихся на ИВЛ (32,5% и 61,8%, соответственно; p
Обсуждение
В наблюдательном когортном исследовании у больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в ОРИТ, внутривенное введение тоцилизумаба в фиксированной дозе 400 мг не сопровождалось снижением летальности. Тоцилизумаб не увеличивал выживаемость ни у больных, находившихся на оксигенотерапии или НИВЛ, ни у пациентов, которым ингибитор ИЛ-6 вводили после начала ИВЛ. Более того, введение тоцилизумаба у неинтубированных пациентов ассоциировалось с увеличением потребности в ИВЛ. Последний результат мог частично объясняться несколько более высокой частотой некоторых сопутствующих заболеваний, ухудшающих течение COVID-19, в группе тоцилизумаба. В то же время группы интубированных пациентов, получивших и не получивших тоцилизумаб, были сопоставимы по демографическим показателям и частоте сопутствующих заболеваний. Соответственно, различия между группами не могли объяснить негативные результаты исследования в этой выборке.
Наши данные контрастируют с результатами многочисленных наблюдательных исследований, которые показали, что введение тоцилизумаба может привести к снижению потребности в ИВЛ и летальности больных с тяжелым течением COVID-19 ассоциированной пневмонии 23. В ретроспективном исследовании, проводившемся в 13 американских больницах, эффективность тоцилизумаба изучали у 630 больных с COVID-19, госпитализированных в ОРИТ для респираторной поддержки [24]. Основную группу составили 210 пациентов, которым вводили тоцилизумаб в дозе 400 мг внутривенно, контрольную – 420 больных, не получавших ингибитор ИЛ-6 и подобранных по демографическим и клиническим показателям. Во всей когорте, как и в нашем исследовании, преобладали люди пожилого возраста (в основном мужчины), страдавшие различными сопутствующими заболеваниями. Около 45% больных получали глюкокортикостероиды. Летальность в целом составила 57%, в том числе 49% в группе тоцилизумаба и 61% в контрольной группе. По данным регрессионного анализа Кокса, введение тоцилизумаба ассоциировалось с достоверным снижением риска смерти (отношение рисков 0,64, 95% ДИ 0,47-0,87; p=0,0040). Сходная ассоциация была выявлена также в подгруппах больных, находившихся на ИВЛ, и пациентов с исходным уровнем СРБ ≥150 мг/л.
В другом крупном ретроспективном американском исследовании STOP-COVID эффективность тоцилизумаба изучали у 3924 пациентов с COVID-19, поступивших в ОРИТ (62,8% мужчин, медиана возраста 62 года) [25]. 433 (11,0%) из них получили тоцилизумаб в течение первых 2 дней после госпитализации в ОРИТ. Больные группы тоцилизумаба были моложе пациентов группы сравнения (медианы 58 и 63 года, соответственно), чаще получали глюкокортикостероиды (18,7% и 12,6%) и чаще находились на ИВЛ (47,3% и 37,9%). Летальность во всей выборке составила 39,3%, в том числе 28,9% в группе тоцилизумаба и 40,6% в группе сравнения. Лечение ингибитором ИЛ-6 ассоциировалось с достоверным снижением риска смерти по сравнению с контролем (отношение рисков 0,71, 95% ДИ 0,56-0,92).
Статистически значимая ассоциация между введением тоцилизумаба (внутривенно в дозе 8 мг/кг в виде двух инфузий с интервалом 12 ч или подкожно в дозе 324 мг) и снижением риска перевода на ИВЛ или смерти (скорректированное отношение рисков 0,61, 95% ДИ 0,40–0,92; p=0,020) была выявлена и в итальянском исследовании у 544 больных с тяжелой COVID-19 ассоциированной пневмонией, 179 из которых получили ингибитор ИЛ-6 [21]. В этом исследовании доля больных, нуждавшихся в ИВЛ (18% и 16% в группах тоцилизумаба и сравнения, соответственно) и летальность (7% и 20%) были значительно ниже, чем в нашем исследовании, в том числе у пациентов, получивших более раннюю инфузию тоцилизумаба, и в описанных выше исследованиях. Таким образом, данные итальянских авторов позволяют судить об эффективности тоцилизумаба у пациентов с менее тяжелым течением COVID-19.
Заключение
В ретроспективном когортном исследовании у пациентов с тяжелой COVID-19 пневмонией, нуждавшихся в респираторной поддержке в ОРИТ, мы не выявили снижения летальности как при более раннем (до интубации), так и позднем (после начала ИВЛ) внутривенном введении тоцилизумаба в дозе 400 мг по сравнению с контрольными группами больных, получавших только стандартную терапию. Хотя полученные данные не позволяют отвергнуть эффективность тоцилизумаба, они согласуются с результатами нескольких рандомизированных клинических исследований, в которых изучался ингибитор ИЛ-6. В настоящее время продолжаются еще несколько рандомизированных контролируемых исследований, в частности RECOVERY, которые позволят оценить эффективность тоцилизумаба у пациентов с COVID-19 и возможные показания к его применению. Если по мнению врача больной с тяжелой COVID-19 пневмонией нуждается в противовоспалительной терапии, то лечение целесообразно начинать с дексаметазона, в то время как введение тоцилизумаба может обсуждаться при неэффективности глюкокортикостероидов.