иммунофенотип опухоли что это такое
Иммунофенотип опухоли что это такое
Это комплекс лабораторных исследований биоптата, включающий морфологическое исследование с использованием стандартных методик окраски, а также определение иммуномаркеров.
Гистологическая и ИГХ диагностика с определением дифференцировки и гистогенеза опухоли.
Comprehensive histological and immunohistochemical study with the use of immunohistochemical stains is necessary to determine: the immunophenotype of the tumor; the histogenesis of metastases in unknown primary tumor; the possibility of targeted therapy, etc.
Какой биоматериал можно использовать для исследования?
Образец ткани (биоптат) опухолевого образования любой локализации.
Общая информация об исследовании
Для подтверждения онкологического заболевания обязательно проводится гистологическое исследование. Лечащий врач путем биопсии получает биоматериал из исследуемого органа и отправляет его в лабораторию, где из биоптата готовят парафиновые блоки, затем нарезают из них тончайшие срезы, крепят к предметным стеклам и красят специальными красителями. Врач-патоморфолог с помощью микроскопа изучает полученный биоматериал, оценивая состояние клеточных структур, их взаимосвязь, наличие фоновых изменений и т.д. Гистологическое исследование позволяет верифицировать патологические изменения, определить форму, стадию заболевания, фон, на котором оно протекает.
Следующим этапом проводят иммуногистохимическое (ИГХ) исследование, которое включает в себя выявление онкомаркеров и позволяет получить дополнительную информацию об исследуемых тканях, определить злокачественный потенциал опухолевых клеток, спрогнозировать их дальнейшие развитие. Для клинического применения разработано более 20 маркеров опухолей, большинство из которых являются белками. Один вид рака может быть представлен одним или несколькими онкомаркерами.
Для проведения ИГХ-исследования полученные срезы окрашивают растворами антител, меченных флюоресцирующими метками, специфичными к одному из исследуемых маркеров. Если в биоматериале присутствует искомый рецептор, антитела связываются с ним и в таком случае под специальным микроскопом можно увидеть свечение. Количество используемых в ходе исследования растворов с антителами соответствует количеству маркеров, которые исследуются в образце. Степень флюоресценции и процент клеток, в которых она есть, лежат в основе интерпретации результатов анализа.
С помощью иммуногистохимического исследования можно идентифицировать иммунофенотип патологических клеток, происхождение метастазов (найти первичную опухоль), оценить онкогенез и спрогнозировать ответ на терапию. Иммунофенотипирование опухоли позволяет подобрать таргетную терапию, если это возможно. Например, таргетные препараты успешно применяются при лечении рака молочной железы, стромальных и нейроэндокринных опухолей желудочно-кишечного тракта, рака легких и ряда других патологий. Множество различных неопластических заболеваний и состояний диагностируется с использованием ИГХ в качестве основного инструмента или в качестве подтверждающего исследования.
В современной медицине комплексное использование гистологического исследования и иммуногистохимии с панелью маркеров считается наилучшим подходом в диагностике и лечении новообразований.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Результат представлен в виде морфологического описания исследуемой ткани после окрашивания стандартными красителями и характера найденных изменений, а также иммуногистохимической оценки искомых маркеров. Значение результата зависит от типа опухоли, анамнеза, проведенного лечения и других факторов. Окончательную интерпретацию проводит врач в каждом конкретном случае.
Материалы конгрессов и конференций
VII РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ВАРИАНТЫ ИММУНОФЕНОТИПА РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ И ИХ КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ДЛЯ ПРОГНОЗА
В.П. Летягин, Н.Н. Тупицын, Е.В. Артамонова
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Во всем мире с каждым годом констатируют увеличение числа регистрируемых случаев рака молочной железы. При таком развитии в ХХI веке возникает высокая вероятность появления на планете более 1000.000 заболевших раком этой локализации. Так, в США в 1998 г. зарегистрировано 180.300 новых случаев рака молочной железы и 43.900 летальных исходов этого заболевания. В 2000 г. в России заболели 44.800 женщин. Средний возраст заболевших составил 55-74 года. За 2000 г. в России от рака молочной железы умерли 21.994 человек, причем показатели смертности и заболеваемости имеют тенденцию к росту (Давыдов М.И., Аксель Е.М., 2002).
В структуре научных изысканий опухолей молочной железы большое место занимают иммунологические исследования. Они ведутся по двум направлениям: изучение иммунофенотипа опухоли и изучение противоопухолевого иммунитета.
Исследования в этом направлении стали широко проводиться с внедрением в клиническую практику моноклональных антител (МКА) как к лейкоцитарным молекулам, так и к антигенам и рецепторам, специфичным для эпителиальных клеток (2, 3, 4, 5).
Иммунофенотип рака молочной железы был изучен у 239 больных с помощью панели МКА. Мы оценили экспрессию злокачественными клетками эпителиальных антигенов (Egp34, MUC-1, РЭА), молекул главного комплекса гистосовместимости I и II классов и антигенов кластеров лейкоцитарной дифференцировки (сюда вошли рецепторы трансферрина CD71 и молекулы адгезии CD29), которые играют определенную роль в регуляции процессов опухолевого роста.
Иммуногистохимическое исследование первичных опухолей проведено на криостатных срезах 239 опухолей молочных желез, полученных в ходе операции (230 больных) и с помощью трепанбиопсий (9 больных).
Результаты нашего исследования позволили выделить два типа гетерогенности экспрессии маркеров: в группе «рак молочной железы» и в пределах одного случая.
Общеэпителиальный антиген Egp34 отличается мономорфностью экспрессии при раке молочной железы. Этот маркер выявляется в 100% случаев рака молочной железы и отличается исключительно высокой частотой мономорфных реакций (98,7%), что позволяет успешно локализовать все опухолевые зоны в препарате для их дальнейшего детального изучения с помощью других МКА.
С другой стороны, Egp34 отсутствует на клетках неэпителиального происхождения, что позволяет использовать МКА НЕА-125 для дифференциальной диагностики недифференцированных опухолей эпителиального и неэпителиального происхождения, а также для иммуноморфологического выявления микрометастазов рака молочной железы в регионарные лимфоузлы и костный мозг. Применение МКА НЕА-125 к Egp34 позволило увеличить частоту выявления метастазов на 6,8% по сравнению с морфологическим исследованием.
Вторым изученным нами маркером был муциноподобный антиген MUC-1. Он также часто (в 94,0% случаев) выявлялся при раке молочной железы, однако гораздо реже, чем Egp34, отличался мономорфным типом реакции (МКА ICO-25 реагировал с большинством опухолевых клеток лишь в 56,3% наблюдений).
При оценке взаимосвязи экспрессии различных антигенов клетками рака молочной железы мы обнаружили значимую положительную корреляцию между муциноподобным антигеном MUC-1 и РЭА. Все 100% опухолей, мономорфно экспрессирующих РЭА, также мономорфно экспрессировали MUC-1. Вероятно, появление РЭА-положительных и MUC-1-положительных фенотипов взаимосвязано между собой, является отражением злокачественной трансформации и связанных с ней процессов анаплазии и дедифференцировки и может оказаться фактором неблагоприятного прогноза заболевания.
Применение МКА ICO-25 для исследования регионарных лимфоузлов у больных раком молочной железы с N0 позволило увеличить частоту выявления метастазов на 8,3% по сравнению с гистологическим исследованием, поэтому иммуногистохимическое исследование регионарных лимфоузлов с МКА ICO-25 целесообразно проводить в дополнение к стандартному гистологическому исследованию у больных раком молочной железы группы N0, что совпадает с мнением других авторов (6, 7, 8, 9).
Показатель общей 5-летней выживаемости составил при отсутствии MUC-1 на опухолевых клетках 75,0±21,6%; при мозаичной экспрессии – 74,8±5,9% и в группе мономорфной экспрессией – 67,0±5,4%.
Третьим эпителиальным маркером, оцененным нами при раке молочной железы, был раково-эмбриональный антиген (РЭА). Он характеризуется гетерогенностью экспрессии, как в нозологической группе, так и в пределах одного случая и наиболее редко, по сравнению с Egp34 и MUC-1, выявляется на клетках первичной опухоли (29,5% случаев).
При исследовании местных иммунных реакций в группах с РЭА-мономорфным, мозаичным и отрицательным фенотипом выяснилось, что экспрессия РЭА приводила к достоверному снижению инфильтрации опухоли CD7+ T-лимфоцитами, что отражалось и на снижении общего уровня инфильтрации опухоли лимфоцитами, оцененного по общелейкоцитарному антигену CD45.
Наличие РЭА на клетках рака молочной железы вызывало достоверное увеличение частоты метастатического поражения регионарных лимфоузлов независимо от количества антигенположительных клеток (мономорфная и мозаичная реакция) (10).
При отсутствии антигена общая 5-летняя выживаемость составила 83,2±4,5%, при мозаичной реакции – 79,7±10,9% и мономорфной – 52,4±14,4%.
В целом частота обнаружения метастазов в регионарные лимфоузлы методом иммуногистохимии по совокупному показателю, достигнутому на основании применения трех МКА к эпителиальным антигенам (НЕА-125, НЕА-19 и ICO-25), была на 13,5% выше, чем при гистологическом исследовании.
Комплекс МКА (НЕА-125, НЕА-19 и ICO-25) оказался пригодным и для обнаружения раковых клеток в стернальном пунктате больных раком молочной железы.
Антигенный профиль опухолевых клеток существенно отличается от нормальной ткани молочной железы. Фенотип нормальных эпителиальных клеток во всех случаях соответствует HLA-I+ HLA-DR-. При раке молочной железы подобный нормальный фенотип наблюдался лишь в 18,1% наблюдений, а чаще всего рак молочной железы характеризовался полным отсутствием антигенов главного комплекса гистосовместимости на опухолевых клетках (41,4%).
Экспрессия HLA-I также статистически значимо положительно коррелировала с выявлением на опухолевых клетках молекул адгезии (CD29). В норме на эпителии молочной железы молекулы VLA-? экспрессированы во всех случаях и, следовательно, их утрата может являться косвенным отражением нарушения механизмов адгезии и связанной с этим активизацией процессов инвазии и метастазирования.
При исследовании HLA-I показатели 5-летней общей выживаемости существенно не отличались и составили при HLA-I(-) – 73,3±5,9%, при HLA-I(±) – 78,4±7,4% и при HLA-I(+) – 73,5±7,0%.
Проведенное исследование HLA-II класса показало, что при отсутствии экспрессии 5-летняя общая выживаемость составила 77,8±4,2%, при мозаичной – 81,7±7,4% и мономорфной – 58,8±12,1%.
Изучение местных иммунных реакций в группах с HLA-I положительным, мозаичным и негативным фенотипами установлено, что экспрессия молекул I класса статистически значимо коррелирует с увеличением инфильтрации опухоли T-лимфоцитами (CD5+, CD7+), их субпопуляциями (CD4+, CD8+) и макрофагами (CD163+), что отражается на увеличении общего уровня лейкоцитарной инфильтрации, оцененного по CD45. Молекулы HLA-I не влияют на реакцию В-лимфоцитов (CD19+, CD37+) и плазматических клеток (CD38+).
При изучении местных иммунных реакций в группах с HLA-DR положительным, мозаичным и негативным фенотипами установлено, что экспрессия молекул II класса при раке молочной железы статистически значимо коррелирует с увеличением инфильтрации опухоли по большинству субпопуляций иммунокомпетентных клеток. Отмечена положительная связь с общим уровнем лейкоцитарной инфильтрации (CD45+), реакцией CD7+ T-лимфоцитов и их субпопуляций (CD4+, CD8+), макрофагов (CD163+), CD19+ и CD37+ В-лимфоцитов и CD38+ плазматических клеток.
Таким образом, в целом экспрессия антигенов главного комплекса гистосовместимости клетками рака молочной железы была ассоциирована с увеличением степени выраженности местных иммунных реакций (11).
Особый интерес клиницистов должны вызвать данные, полученные нами при изучении рецептора трансферрина (CD71). Маркер CD71 обнаруживался сравнительно часто: в 75,7% случаев рака молочной железы. Мономорфная экспрессия отмечена в 53,7% наблюдений, мозаичная – в 22,0%. Только 24,4% опухолей были полностью антиген-негативными. CD71 не был достоверно взаимосвязан с другими изученными маркерами.
При отсутствии этого маркера на раковых клетках регионарные лимфоузлы статистически значимо чаще оставались интактными (N0). Напротив, экспрессия CD71, независимо от количества антигенположительных клеток, приводила к достоверному увеличению частоты метастатического поражения регионарных лимфоузлов.
При отсутствии экспрессии общая 5-летняя выживаемость составила 96,4±3,5%, при мозаичном варианте – 63,9±10,4% и мономорфном – 69,1±7,5%.
Особое значение приобретает тот факт, что экспрессия CD71 оказывает неблагоприятное прогностическое влияние при ранних (I и IIa) стадиях рака молочной железы: прогрессирование в этой группе больных наблюдалось нами только при наличии на мембране злокачественных клеток рецепторов трансферрина. Очевидно, что эта категория пациенток нуждается в пристальном внимании клиницистов с позиции возможной целесообразности адъювантной терапии при ранних (N0) стадиях рака молочной железы.
Определение CD45 показало, что при слабой реакции общая 5-летняя выживаемость составила 61,4±9,3%; при умеренной – 72,7±7,0% и при выраженной – 77,9±5,3%.
Выраженная и умеренная реакция CD7+ Т-лимфоцитов отмечалась сравнительно редко: в 17,3% и в 32,7% случаев соответственно, а преобладал слабый тип реакции – 50,0% наблюдений.
Аналогичная тенденция отмечена и для субпопуляций Т-лимфоцитов. Выраженная, умеренная и слабая реакция CD4+ клеток отмечена в 14,2%; 29,1% и 56,7% случаев соответственно, CD8+ клеток – в 14,9%; 30,6% и 54,5% случаев соответственно.
Общая 5-летняя выживаемость при выраженной реакции на CD7 составила 74,1±8,0%; умеренной – 58,4±7,3% и слабой – 58,4±5,6%.
При исследовании CD8 выявлено, что при выраженной реакции общая 5-летняя выживаемость составила 88,9±7,4%, а при слабой – 57,2±7,3%;при исследовании CD4 показатель 5-летней общей выживаемости составил при выраженной реакции 88,2±7,8%, умеренной – 77,6±7,5% и слабой – 63,3±6,9%.
Изучение взаимосвязей между различными иммунокомпетентными клетками показало, что реакция Т-лимфоцитов и их субпопуляций (CD4+ и CD8+) высоко достоверно коррелировали между собой, а так же с реакцией В-лимфоцитов (CD19+ и CD37+), CD38+ лимфоцитов и плазматических клеток и макрофагов (CD163). Общий уровень иммунной реакции, оцененный по CD45, также высоко достоверно коррелировал с инфильтрацией опухоли Т-лимфоцитами и их субпопуляциями и зависел от последних.
Инфильтрация опухоли CD7+ Т-лимфоцитами и их субпопуляциями (CD 4+ и CD 8+) достоверно отрицательно коррелировала с величиной первичной опухоли.
С уменьшением реакции CD 4+ Т-хелперов/индукторов и CD8+ супрессоров/цитотоксических клеток достоверно увеличивалась частота обнаружения метастазов в регионарные лимфоузлы.
Частота выявления отдаленных метастазов также достоверно отрицательно коррелировала с инфильтрацией опухоли субпопуляцией CD8+ Т-лимфоцитов.
Стадия заболевания достоверно отрицательно коррелировала с реакцией CD8+ супрессоров/цитотоксических клеток.
Таким образом, исследование иммунофенотипа рака молочной железы является необходимым дополнением, позволяющим более четко определить прогноз заболевания и на этом основании выработать оптимальную тактику лечения и наблюдения за больной.
1. Давыдов М.И., Аксель Е.М. // М. – 2002. – 281 стр.
2. Тупицын Н.Н. и др. // Экспер. онкология. – 1990. – т.12, №2. – с. 54-58.
3. Артамонова Е.В. // Вопросы онкологии. – 1994. – т.40, №7-12. – с. 314-318.
4. Доросевич А.Е. и др. // Архив патологии. – 1994. – т.55, №3. – с.51-55.
5. Барышников А.Ю., Топевицкий А.Г. // Моноклональные антитела в лаборатории и клинике. // М. – 1997. – с.99-105.
6. Cote R.J. et al. // Lancet. – 1999. – v.354, №9182. – p. 896-900.
7. Masser et al. // Hum.Pathol. – 1993. – v.24, №9. – p. 950-987.
8. Rampaul R.S. // Breast Cancer Res. – 2001. – v.3, №2. – p. 113-116.
9. Nayak S.K. et al. // In Vitro Cell. Dev. Biol. Anim. – 2000. – v. 36, №3. – p. 188-193.
10. Mori M. et al. // J. Clin. Oncol. – 1998. – v.16, №1. – p. 128-132.
11. Takahashi et al. // Br. J. Cancer. – 1999. – v.81, №2. – p. 342-349.
Прогностическое значение иммунофенотипа злокачественных клеток (на примере острых нелимфобластных лейкозов)
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
к.м.н. Л.Ю. Андреева, профессор М.А. Волкова, профессор М.А. Френкель
Российский онкологический научный центр им. Н.Н. Блохина РАМН
В ыделение на основании исходных прогностических факторов группы больных, имеющих низкую вероятность достижения ремиссии или высокий риск развития рецидива с целью индивидуализации лечения, является перспективным направлением в современной терапии злокачественных новообразований. Необходимость разработки индивидуальных подходов к терапии различных по прогнозу групп больных продиктована потребностями клиники. Такой подход может основываться только на углубленном изучении молекулярно–биологических особенностей опухолевой клетки. Одним из методов, раскрывающим новые перспективы в понимании антигенных, биохимических и гистогенетических характеристик клеточных структур и дающих возможность глубже понять природу опухоли, особенности ее возникновения, развития и прогрессирования, является иммунофенотипирование. С появлением высокоспецифичных реагентов – моноклональных антител (мкАТ), позволяющих определять и разграничивать специфические антигенные детерминанты, онкологи получили возможность более точного определения диагноза и прогноза заболевания, а также выбора наиболее оптимальной тактики лечения пациента. Неоспоримыми достоинствами иммунофенотипирования являются его высокая чувствительность, специфичность и относительная простота. Данный метод обеспечивает детальную характеристику фенотипа опухоли при диагностике, позволяет идентифицировать отдельные остаточные опухолевые клетки, персистирующие в организме больного во время ремиссии.
Наибольшее развитие метод иммунофенотипирования получил при опухолях крови. Основным и, пожалуй, единственным на сегодняшний день методом лечения гемобластозов является химиотерапия. На примере острых лейкозов наглядно демонстрируется возрастание роли молекулярно–биологических (иммунофенотипических) факторов прогноза по мере интенсификации программ химиотерапии. При этом стандартные прогностические факторы (клинические, гематологические, морфоцитохимические) утрачивают свое значение и отходят на второй план. Эволюция взглядов на факторы прогноза, наблюдаемая при гемобластозах человека и указывающая на возрастание роли иммунофенотипа в условиях современных схем химиотерапии, может явиться своего рода моделью и для ряда соматических опухолей, являющихся объектами химиотерапии, при которых иммунофенотипические подходы пока еще разработаны недостаточно.
Иммунофенотипирование является обязательным методом исследования при гемобластозах в целом и при острых нелимфобластных лейкозах (ОНЛЛ), в частности. Помимо диагностического аспекта, значение изучения иммунофенотипа бластных клеток при ОНЛЛ заключается в том, что наличие некоторых антигенных детерминант ассоциируется с агрессивностью течения и результатами терапии [4, 7, 8, 13, 15, 20]. На сегодняшний день решены еще не все вопросы относительно прогностической ценности экспрессии тех или иных антигенов при ОНЛЛ и последствий, которые влечет за собой их обнаружение с точки зрения лечебной тактики. Представленные в нашей работе результаты отражают общие тенденции комплексного и углубленного изучения иммунофенотипической характеристики ОНЛЛ во взаимосвязи с прогнозом заболевания, которое ведется в крупнейших клиниках мира.
Характеристика больных и методы исследования
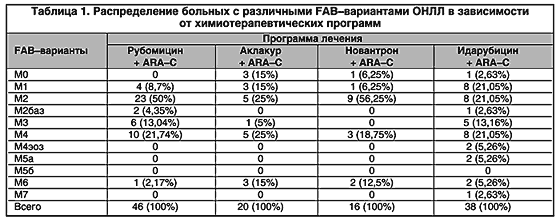
Результаты иммунологического исследования и их сопоставление с FAB–вариантами и результатами терапии базируются на данных изучения иммунологического фенотипа бластных клеток 120 больных ОНЛЛ в возрасте от 14 до 67 лет за период с 1981 по 1996 годы, получивших лечение в отделении химиотерапии гемобластозов (руководитель – канд. мед. наук Д.Ш. Османов) РОНЦ им. Н.Н. Блохина РАМН. Все пациенты лечились по программам «3+7» стандартными дозами цитозара с различными антрациклиновыми производными – рубомицином (46), аклакуром (20), новантроном (16), идарубицином (38).
Установление диагноза ОНЛЛ и определение морфоцитохимического варианта заболевания осуществлялось в соответствии с критериями FAB–классификации.
Определение иммунологического фенотипа бластных клеток проводилось методом непрямой иммунофлюоресценции с использованием широкой панели моноклональных антител (мкАТ). Набор мкАТ варьировал в разные годы проведения исследований и в наиболее полном виде включал миелоидные (CD11b, CD13, CD14, CD15, CD33), эритроидные (HAE–3, HAE–9), линейно не рестриктированные (CD10, CD34, CD38, HLA–DR), Т–клеточные (CD2, CD4, CD5, CD7) и В–клеточные (CD19, CD22) антигены. Мегакариоцитарные маркеры (CD41, CD61) исследовались по показаниям. Оценка результатов проводилась на проточном цитометре FАСScan (Becton Dickinson, CША) в гейте бластных клеток, идентифицируемых на основании характеристик светорассеяния. Антиген–положительными считались случаи с экспрессией маркера на более чем 20% лейкемических клеток.
Сравнение влияния иммунологических маркеров на частоту полных ремиссий (ПР) больных с наличием или отсутствием экспрессии антигенов на мембране бластных клеток производилось по таблицам сопряженности признаков. Достоверность различий оценивалась по критерию Хи–квадрат. Сравнение кривых общей и безрецидивной выживаемости (ОВ и БРВ соответственно), построенных по методу Каплан–Майера, проводилось с использованием Log–Rank теста. Различия считались достоверными при р Результаты и обсуждение
Распределение 120 больных с различными морфоцитохимическими вариантами в каждой из лечебных групп представлено в таблице 1. На основании литературных данных и опыта отделения химиотерапии гемобластозов РОНЦ морфоцитохимические варианты ОНЛЛ были разделены на прогностически благоприятные (М1, М2, М3, М4эоз) и прогностически неблагоприятные (М0, М2баз, М4, М5, М6, М7). Во всех группах, за исключением аклакур–цитарабиновой, преобладали прогностически благоприятные FAB–варианты. Статистический анализ во всех 4–х группах не выявил достоверных различий в возрасте, частоте тех или иных клинико–гематологических показателей и клинических симптомов. Результаты использования цитарабина с различными антрациклиновыми производными приведены в табл. 2.
В настоящее время адекватная цитостатическая и симптоматическая терапия позволяет преодолевать многие отрицательные клинико–гематологические факторы, которые до 1980–х годов оказывали решающее влияние на прогноз ОНЛЛ. С возрастанием интенсивности терапии роль некоторых из этих факторов (например, глубины тромбоцитопении и анемии, процентного содержания бластных клеток в крови и костном мозге) полностью нивелировалась, однако другие признаки (возраст, уровень лейкоцитов, морфоцитохимическая характеристика бластных клеток), самостоятельно или в совокупности, по–прежнему сохраняют свою прогностическую значимость [5, 16, 19]. В условиях различных химиотерапевтических режимов роль клинико–гематологических факторов прогноза нами была подтверждена. При этом особенности использованной программы терапии накладывали свой отпечаток на реализацию тех или иных прогностических факторов. Из табл. 3 видно, что при применении современных программ химиотерапии, в частности, при использовании идарубицина, прогностическая роль общепринятых клинико–гематологических и морфоцитохимических факторов практически полностью нивелируется. Таким образом, в условиях интенсивных химиотерапевтических режимов достаточно сложно, опираясь только на вышеуказанные факторы прогноза, определять степень агрессивности опухолевого процесса до начала лечения. С этой целью была проанализирована роль иммунологических особенностей лейкозных клеток больных ОНЛЛ.
Уникальной особенностью бластных клеток при ОНЛЛ является сохранение ими дифференцировочного статуса клеток–предшественников гемопоэза. Однако в отличие от нормальной клеточной дифференцировки, при которой невелик процент клеток, коэкспрессирующих маркеры различных линий и стадий гемопоэза, при ОНЛЛ одновременная экспрессия в норме не встречающихся антигенов определяется в 85% случаях [21]. Таким образом, лейкозный клон клеток, имеющий однородные морфоцитохимические характеристики, является гетерогенным по антигенной структуре бластных элементов, и перспективы иммунофенотипического изучения злокачественных элементов при ОНЛЛ поистине многообразны.
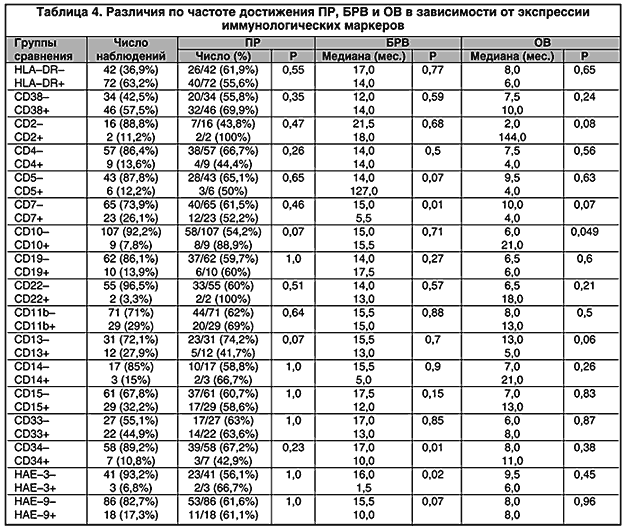
На основании проведенного клинико–иммунологического анализа нам удалось доказать неоднородность терапевтического ответа у больных ОНЛЛ с различным иммунофенотипом бластных клеток. Кроме того, были выявлены иммунологические маркеры, влияющие на отдаленные результаты лечения. Частота экспрессии различных антигенов на поверхности лейкемических клеток и достоверность их влияния на частоту достижения ПР, БРВ и ОВ представлены в табл. 4.
Значение антигена CD10 при ОНЛЛ оценить достаточно сложно ввиду редкости экспрессии данного маркера на мембранах лейкемических клеток. В нашем наблюдении частота CD10–позитивных ОНЛЛ составила 7,8% (9 из 116). Особенностью этих случаев явилась высокая частота ПР – 88,9% (8 из 9). В группе больных, бластные клетки которых не экспрессировали данный маркер, ПР были достигнуты в 54,2% случаев (58 из 107). Уровень значимости различий близок к достоверному (р =0,07). По–видимому, именно большей частотой ПР обусловлены лучшие показатели выживаемости CD10–позитивных пациентов (медиана 21 мес против 6 мес; р = 0,049). Кривые выживаемости в группах, различающихся по экспрессии антигена CD10, представлены на рис. 1. Различия по возрасту, исходному количеству лейкоцитов и количеству больных с благоприятными и неблагоприятными FAB–вариантами в CD10–позитивной и CD10–негативной группе отсутствовали (р>0,5). Первоначально экспрессия антигена CD10 рассматривалась, как признак «лимфоидности». В настоящее время выявлено, что СD10 является дифференцировочным маркером миелоидных клеток и присутствует на поздних стадиях нормальной дифференцировки гранулоцитов [12].
Рис. 1. Общая выживаемость больных ОНЛЛ в зависимости от экспрессии антигена CD10 на поверхности бластных клеток без учета программы терапии.
Напротив, присутствие на бластных клетках миелоидного антигена CD13 ассоциировалось с низкой вероятностью достижения ремиссии (41,7% против 74,2% ПР в CD13–негативной группе; р = 0,07) и, как следствие, со значительно более низкой выживаемостью (медиана 5 ме. против 13 мес соответственно; р = 0,06). Подобные данные есть в литературе [16]. Кроме того, наличие маркера CD13 в иммунофенотипе коррелировало с высоким показателем лейкоцитов в дебюте заболевания. Все случаи ОНЛЛ, сопровождавшиеся экспрессией CD13, характеризовались уровнем лейкоцитов свыше 50 тыс в 1 мкл крови, в то время как при отсутствии этого маркера исходный средний уровень лейкоцитов был в среднем в 2,5 раза ниже (58,8±3,07 тыс/мкл против 23,5± 6,29 тыс/мкл соответственно; р = 0,048). По–видимому, опухолевый клон клеток, характеризующийся экспрессий CD13, обладает высоким пролиферативным потенциалом и крайней агрессивностью течения. Однако значение экспрессии антигена CD13 нельзя считать окончательно установленным. Для более весомого заключения о роли данного маркера нужны дополнительные исследования.
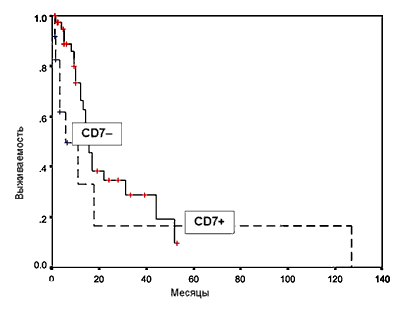
Большое внимание при ОНЛЛ привлекает антиген CD7, как наиболее часто встречающийся «лимфоидный» маркер (20–30% случаев ОНЛЛ). Обычно CD7 присутствует на Т–лимфоцитах и ЕК–клетках, и прежде его считали специфическим лимфоидным антигеном [22]. Впоследствии было установлено, что CD7 может экспрессироваться примитивными гемопоэтическими клетками, в том числе способными к миелоидной дифференцировке [14, 17]. Отсутствие антигена CD7 на бластных клетках было достоверно связано с лучшей безрецидивной выживаемостью (рис. 2). Продолжительность ПР в случаях с экспрессией CD7 составила 5,5 мес; 20 мес без рецидива прожили только 15% больных. В группе пациентов, лейкемические клетки которых не содержали данного антигена, медиана безрецидивной выживаемости составила 15 мес; 20 мес без рецидива прожили 38% больных (p = 0,01). Статистически значимые различия по возрасту, уровню лейкоцитов, количеству больных с благоприятными и неблагоприятными FAB–вариантами между CD7–позитивной и CD7–негативной группами отсутствовали (р > 0,35). Полученные нами данные полностью совпадают с результатами зарубежных исследований [10, 15, 24]. Имеются убедительные данные об ассоциации экспрессии антигена CD7 с наиболее важными факторами неблагоприятного прогноза – фенотипом множественной лекарственной устойчивости, наличием Ph–хромосомы, а также сложными нарушениями кариотипа [11, 23]. По–видимому, выделение CD7–позитивных больных ОНЛЛ в группу, требующую исходной интенсификации терапии, оправдано с клинических позиций.
Рис. 2. Безрецидивная выживаемость больных ОНЛЛ в зависимости от экспрессии антигена CD7 на поверхности бластных клеток без учета программы терапии.
Установление экспрессии антигена CD34 позволяет диагностировать особую подгруппу ОНЛЛ, в которой злокачественная трансформация произошла на уровне полипотентной стволовой клетки. Как видно из рис. 3, экспрессия данного маркера на лейкемических бластах была статистически достоверно связана с более короткой продолжительностью ПР. Так, у больных с наличием маркера CD34 в иммунофенотипе медиана продолжительности ПР составила 10 мес. Ни у кого из больных длительность ремиссии не превысила 12 мес. В то же время в группе больных, на бластных клетках которых отсутствовала экспрессия стволовоклеточного антигена, медиана продолжительности ПР составила 17 мес; 2 года и более без рецидива прожили более 40% больных (р = 0,01). Кроме того, обнаружение CD34 антигена на мембране бластных клеток связано с более низкой частотой ремиссии (42,9%) по сравнению с CD34–негативными случаями (67,2%). Видимо, малочисленность CD34+ группы является причиной того, что выраженные различия в частоте получения ремиссий не являются статистически значимыми. Необходимо отметить, что в группе больных, лейкемические клетки которых экспрессировали стволовоклеточный антиген, отмечался более молодой возраст (30,3±7,2 лет против 40,1±2,3 лет соответственно; р = 0,3) и отсутствие экстрамедуллярных проявлений заболевания, в то время как у 8 (25,8%) из 31 CD34–негативных пациентов такие проявления были; различий по другим клиническим и гематологическим показателям отмечено не было (р > 0,95).
Рис. 3. Безрецидивная выживаемость больных ОНЛЛ в зависимости от экспрессии антигена CD34 на поверхности бластных клеток без учета программы терапии.
Ассоциация экспрессии антигена СD34 с рефрактерностью к терапии и высоким риском развития рецидива прослежена и в других наблюдениях [3, 9, 13]. Клинические данные подтверждаются данными экспериментальных исследований. Boekhonrst R.A.W. c cоавт. [6] продемонстрировали значительное снижение накопления даунорубицина в CD34+ клетках по сравнению с CD34– клетками. В экспериментах с двойной меткой CD34+ клетки значительно меньше накапливали даунорубицин, чем CD34– клетки (17% против 64%, соответственно). В исследовании Lanza F. с соавт. [18] показано, что больные ОНЛЛ, имеющие CD34+ фенотип бластных клеток, характеризуются более низким процентом Кi67–позитивных (т.е делящихся) клеток и увеличением количества «покоящихся» клеток. По–видимому, больные с СD34+ иммунофенотипом могут быть менее восприимчивы к химиотерапевтическим режимам вследствие низкого митотического уровня бластных клеток.
Вопрос о прогностической роли эритроидных антигенов крайне затруднительный. Это объясняется тем, что в зарубежных клиниках гликофорин А (отечественные мкАТ – НАЕ–3) исследуется только по показаниям (для дифференциальной диагностики М6 ОНЛЛ), а экспрессия антигена эритробластов (мкАТ – НАЕ–9) не изучается (эти мкАТ получены в лаборатории акад. Г.И.Абелева РОНЦ им. Н.Н. Блохина РАМН и используются только в нашей стране). Поэтому вопрос о прогностической значимости эритроидных антигенов во многом остается открытым. В нашем наблюдении экспрессия бластными клетками гликофорина А была ассоциирована с более короткой продолжительностью ПР (медиана 1,5 мес против 16 мес; р = 0,02). Данный антиген был изучен у 44 больных и в 3–х случаях он был позитивным, что составляет 7% и соответствует частоте встречаемости острого эритробластного лейкоза, для которого он является патогномоничным. В наших более ранних исследованиях негативное влияние на БРВ обоих эритроидных маркеров оказалось взаимодополняющим [1]. Несомненно, для окончательного заключения требуется дополнительный набор материала. Однако полученная даже на небольшой выборке достоверная корреляция свидетельствует о недостаточности стандартной цитозар–антрациклиновой терапии для лечения больных с М6 вариантом ОНЛЛ.
Как видно из изложенных выше данных, нами установлен ряд факторов, ассоциированных с продолжительностью болезни и ремиссии у больных ОНЛЛ, проанализированных без учета используемого антрациклинового производного. Располагая достаточно большим клиническим материалом, накопленным за 15 лет наблюдения, в течение которых в отделении химиотерапии гемобластозов РОНЦ РАМН использовались 4 программы химиотерапии, и, принимая во внимание то, что отдельные иммунофенотипы ОНЛЛ могут иметь особенности в чувствительности к различным антрациклинам, мы попытались провести сравнительное изучение влияния иммунологического фенотипа на результаты лечения в пределах отдельных программ.
Как нами было показано (табл. 3), ни один из клинико–гематологических и морфоцитохимических факторов не оказывал влияния на прогноз ОНЛЛ в условиях применения программы лечения с включением идарубицина. По этой причине мы остановились именно на данной программе с целью демонстрации возрастающей роли иммунологических факторов прогноза у этих конкретных больных.
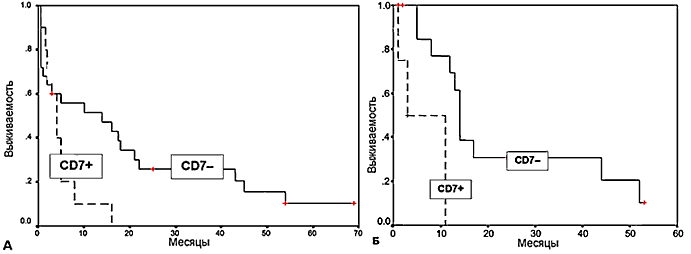
При использовании идарубицин–цитарабиновой комбинации, как и при других химиотерапевтических программах, сохранялось негативное прогностическое влияние на ОВ и БРВ экспрессии антигена CD7 (р = 0,03). Кривые выживаемости представлены на рис. 4. Кроме того, обнаружение на опухолевых клетках антигена CD34 ухудшало БРВ, при этом разница приближалась к достоверной (p = 0,06). Но вместе с тем выявились маркеры, присутствие которых при применении идарубицина, в отличие от других антрациклиновых производных, значительно улучшало прогноз.
Рис. 4. Общая (А) и безрецидивная (Б) выживаемость больных ОНЛЛ в зависимости от экспрессии антигена CD7 на поверхности бластных клеток при идарубицин-цитарабиновой программе терапии.
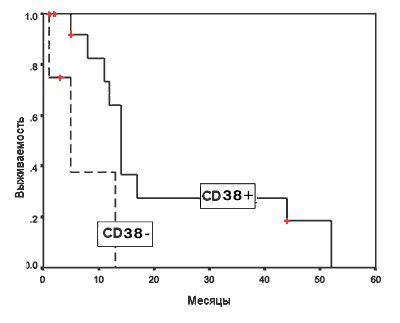
При использовании идарубицина отмечался интересный факт: наиболее чувствительными к индукционной терапии были больные с CD38–позитивными бластными клетками. При экспрессии на бластных клетках маркера CD38 частота ПР была более чем вдвое выше, чем при CD38– ОНЛЛ: 68,2% и 33,3% соответственно (р = 0,07). Больные с наличием в иммунофенотипе бластов молекулы CD38 также имели более длительную ПР (рис. 5). Так, 44 и более месяцев без рецидива прожил каждый четвертый больной, на опухолевых клетках которых отмечалась экспрессия CD38 антигена. В то же время длительность безрецидивного периода ни у одного из CD38–негативных больных не превысила 13 меc (р = 0,013).
Рис. 5. Безрецидивная выживаемость больных ОНЛЛ в зависимости от экспрессии антигена CD38 на поверхности бластных клеток при идарубицин-цитарабиновой программе терапии.
Также была отмечена благоприятное прогностическое влияние на ОВ коэкспрессии миелоидных антигенов CD15 и CD33 (медиана 10 мес против 4 мес; р = 0,05) и В–клеточных маркеров CD19 и CD22 (медиана 43 мес против 5 мес; p = 0,032).
Приведенные данные убедительно показывают, что снижение прогностической роли общепринятых клинико–гематологических и морфоцитохимических факторов в условиях современной химиотерапии ОНЛЛ отнюдь не отражает улучшение прогноза у всех больных. Выделить резистентную или, напротив, более благоприятную в прогностическом плане группу позволяют молекулярно–биологические особенности бластных клеток, установленные методом иммунофенотипирования.
Таким образом, приведенные в нашей статье данные свидетельствуют о том, что иммунологическое исследование является необходимым компонентом первичного обследования больных ОНЛЛ. Помимо изучения чисто клинических аспектов, иммунофенотипирование позволяет глубже понять природу этого заболевания и особенности его течения. Выделение на основании исходных прогностических факторов (включая иммунофенотип) групп больных, имеющих низкую вероятность достижения ремиссии или высокий риск развития рецидива, позволяет индивидуализировать лечение и улучшать его результаты [2]. Это перспективное направление в современной терапии злокачественных новообразований в целом и ОНЛЛ, в частности.
1. Калетин Г.И., Тупицын Н.Н., Волкова М.А. и др. // Новое в онкологии / Под ред. И.В. Поддубной и Н.А.Огнерубова. – Воронеж, 1997. – С. 11–14.
2. Маркина И.Г., Волкова М.А., Тупицын Н.Н. и др. // Новое в онкологии / Под ред. И.В. Поддубной и Н.А.Огнерубова. – Воронеж, 1999. – С. 5–11.
3. Adamczyk–Cioch M.B., Dmoszyncka A., Hus M. et al. // Pol. Arch. Med. Wewn. – 1995. – Vol. 94(1). – P. 40–46.
4. Baer M.R., Stewart C.C., Lawrence D. et al. // Blood. – 1997. – Vol. 90 (4). – P. 1643–1648.
5. Bennett J.M., Catovsky D., Daniel M.T. // Ann. Int. Med. – 1985. – Vol. 103 – P. 626–629.
6. Boekhonrst R.A.W., Leeun R., Schoester M. et al. // Blood. – 1993. – Vol. 82(10). – P. 3157–3162.
7. Bradstock K., Matthews J., Benson E. et al. // Blood. – 1994. – Vol. 84 (4). – P. 1220–1225.
8. Casasnovas R.O., Solary E., Campos L. et al. // Leuk. Lymphoma. –1994. – Vol. 13(1). – P. 109.
9. Cuneo A., Fagioli F., Passi I. et al. // Leuk. Res. – 1992. –Vol. 16 (8). – P. 789–796.
10. Del Poeta G., Stasi R., Venditti A. et al. // Leuk. Lymphoma. – 1995. – Vol. 17(2). – P. 111–119.
11. Del Poeta G., Stasi R., Venditti A. et al. // Leukemia. – 1994. – Vol. 8(3). – P. 388–394.
12. Greaves M.F. // Cancer Surveys. – 1982. – Vol.1(2). – P.189–204.
13. Guinot M., Sans G.F., Sempere A. et al. // Br. J. Haematol. – 1991. – Vol. 78. – P. 533–534.
14. Haynes B.F., Martin M.E., Kay H.H. et al. // J. Exp. Med. – 1988. – Vol. 168. – P. 1061–1080.
15. Kita K., Miwa H., Nakase K. et al. // Blood. – 1993. – Vol. 81(9). – P. 2399–2405.
16. Kristensen J.S., Hokland R. // Leuk. Res. – 1991. – Vol. 15 (8). – P. 693–700.
18. Lanza F., Rigolin G.M., Moretti S. et al. // Leuk. Lymphoma. – 1994. – Vol. 13. – P. 81–85.
19. Lowenberg B., Downing J.R., Burnett A. // New England J. Med. – 1999. – Vol. 341(14). – P. 1051–1062.
20. Paietta E., Andersen J., Yunis J. et al. // Br. J. Haematol.. – 1998. – Vol. 100(2). – P. 265–272.
21. Reading C.L., Estey E.H., Huh Y.O. et al. // Blood. – 1993. – Vol. 81. – P. 3083–3090.
22. Robertson M.J., Ritz J. // Blood. – 1990. – Vol. 76. – P. 2421–2438.
23. Venditti A., Del Poeta G., Buccisano F. et al. // Leukemia. – 1998. – Vol. 12. – P. 1056–1063.