что называется теплотой образования
Урок 21. Теплота образования
В уроке 21 «Теплота образования» из курса «Химия для чайников» рассмотрим что такое теплоты образования и откуда их брать; выясним, какие условия считаются стандартными, а также различия простых и сложных веществ; для закрепления полученных знаний решим пару задач, где используются теплоты образования и закон аддитивности теплот реакций. Будет неплохо, если перед прочтением данного урока, вы изучите материал про изменение энтальпии, а также про теплоты сгорания.
Стандартное состояние вещества
Для кристаллических и жидких веществ стандартное состояние определяется как наиболее распространенная форма элемента при 25°С (298 К*) и внешнем давлении 1 атмосфера (атм); стандартное состояние газов определяется аналогичным образом, но при парциальном ** давлении 1 атм. Вот например, стандартным состоянием углерода считается графит, а не алмаз.
** Парциальное давление — это давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре.
Простые и сложные вещества
Все вещества можно разделить на две обширные группы — простые и сложные вещества.
Простые вещества — это вещества, образованные из атомов одного элемента. Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Сложные вещества (химические соединения) — это вещества, образованные атомами разных элементов. Так, оксид меди CuO образован атомами элементов меди Cu и кислорода O, вода H2O — атомами элементов водорода H и кислорода O.
Теперь вы понимаете различия простых веществ от сложных. Так вот, теплота образования простых веществ всегда равна нулю. Это, пожалуйста, запомните.
Стандартные теплоты образования
Вспомним прошлый урок, где мы пытались синтезировать алмаз. Теплоты образования всех веществ, участвующих в этом синтезе таковы:
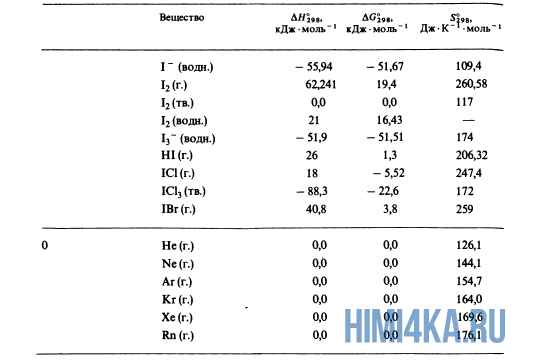
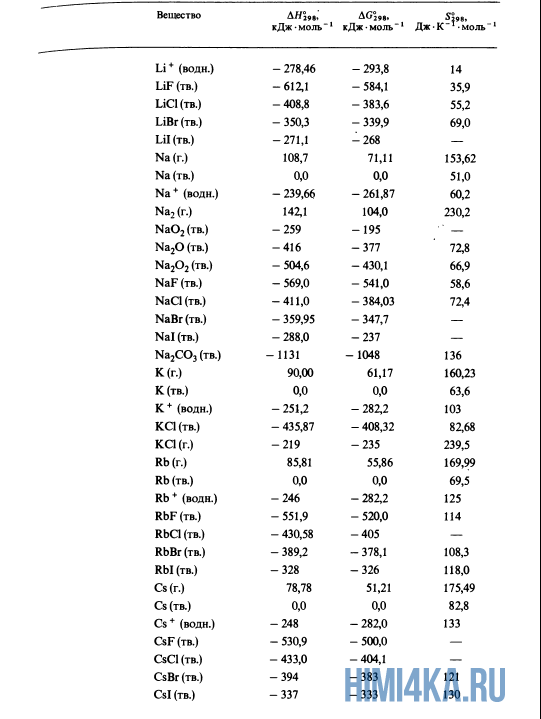
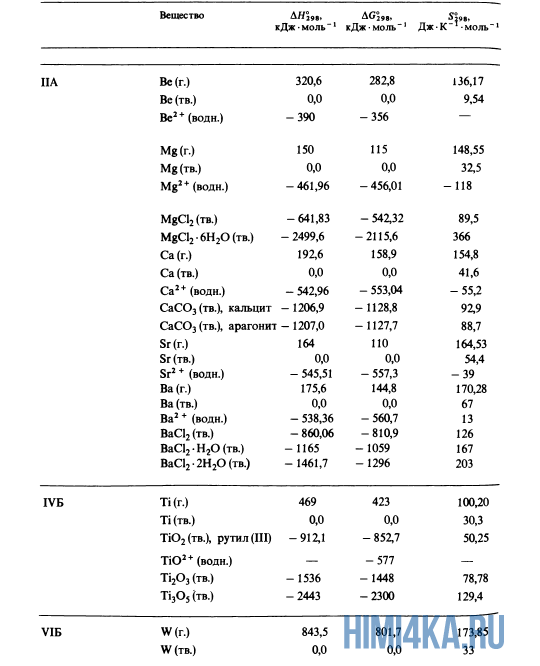
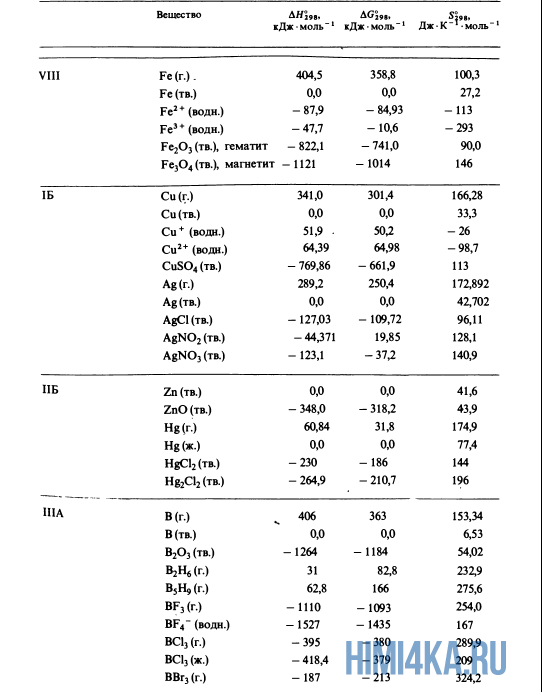
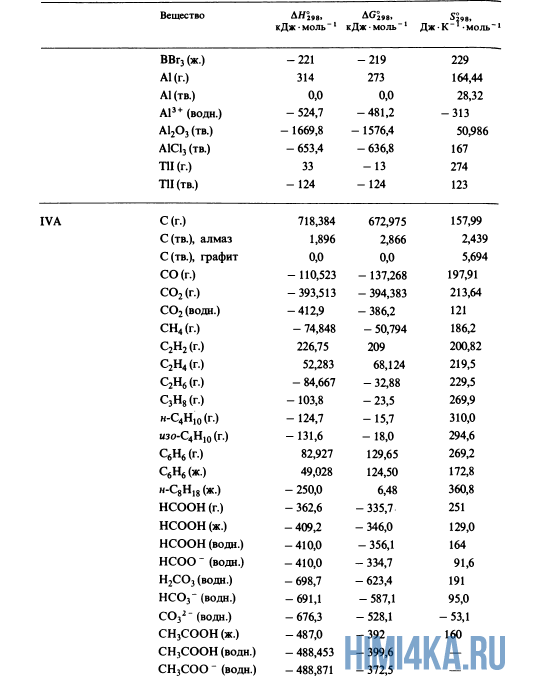
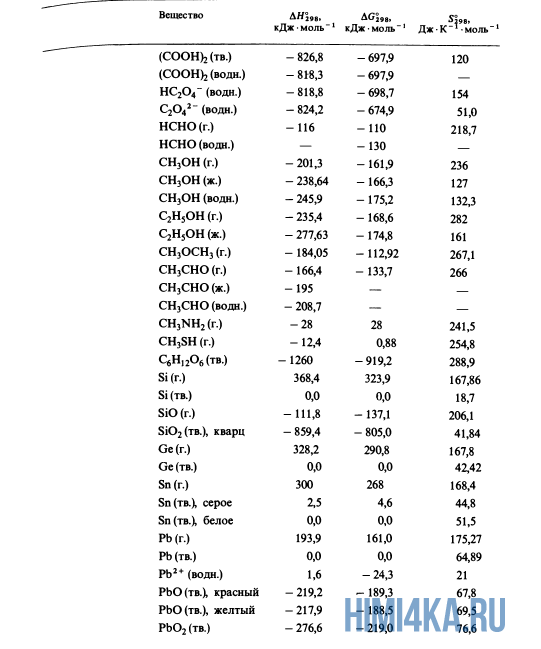
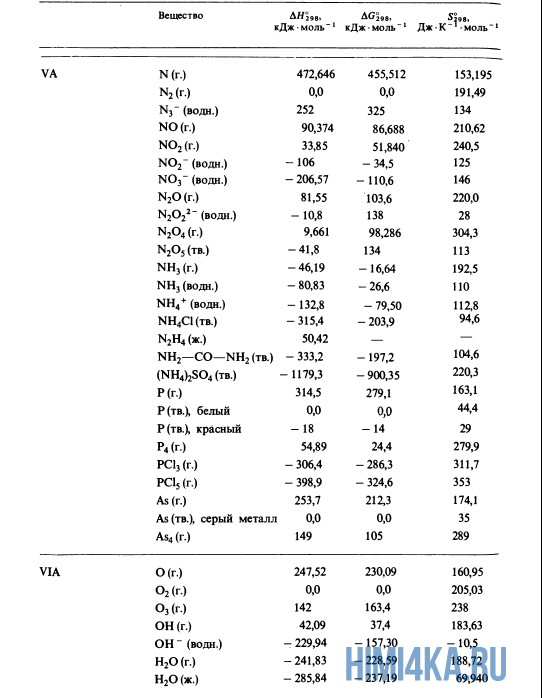
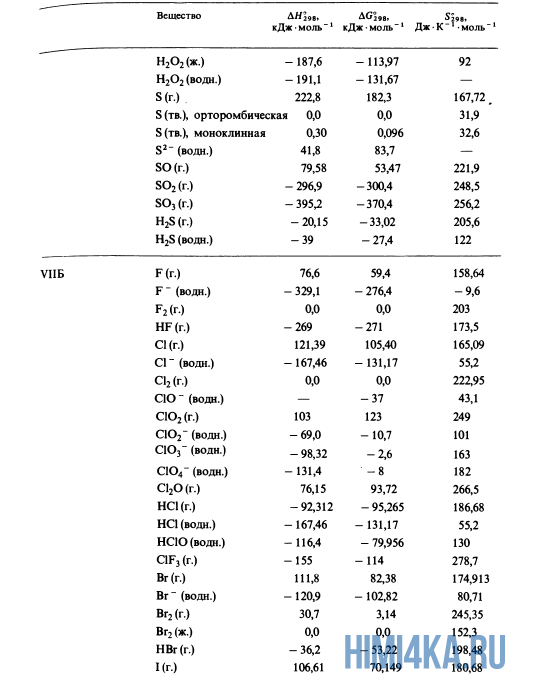
Как уже было отмечено выше, O2 относится к простым веществам, поэтому его теплота образования равна нулю. Таблицы стандартных теплот образования ΔH°298 соединений из чистых элементов приведена ниже под спойлером. В этой таблице нижний индекс 298 обозначает комнатную температуру (298 К = 25°С), а верхний индекс (знак градуса) означает, что реагенты и продукты находятся в своих стандартных состояниях. Однако не обязательно пользоваться записью ΔH°298, достаточно лишь написать ΔH.
Сейчас, на примере старой и доброй реакции (4) получения алмаза путем окисления метана, я покажу вам, как по теплотам образования веществ можно определить теплоту общей реакции. Это уравнение можно получить суммированием уравнения (2) с удвоенным уравнением (3) и обращенным уравнением (1):
У кого возник вопрос, почему же мы не вычитаем теплоту образования кислорода, ответ ищите в таблице теплот образования.
Очевидно, что при таких вычислениях следует быть очень внимательным к знакам и коэффициентам. Чтобы не допустить ошибки, настоятельно рекомендую вам выписывать отдельно каждое уравнение с соответствующей теплотой реакции в таком виде, чтобы сумма всех индивидуальных уравнений давала требуемую реакцию. Если все коэффициенты какого-либо уравнения умножены на произвольное число n, на это же число n должна быть умножена соответствующая теплота образования, а если используется обращенное уравнение реакции образования, то следует изменить свой знак перед табличной величиной ΔH. Когда индивидуальные уравнения суммируются для получения требуемой реакции, сумма индивидуальных теплот образования дает искомую теплоту реакции. А теперь закрепим полученные знания примерами.
Пример 1. Чему равна стандартная теплота реакции восстановления оксида трехвалентного железа Fe2O3 углеродом С до железа Fe и моноксида углерода O, протекающей в доменной печи?
Запишем уравнение реакции, указав под каждым веществом его стандартную теплоту образования:
Стандартная теплота образования простых элементов (С и Fe) по определению равна нулю. Стандартная теплота рассматриваемой реакции равна:
Как видите, изменение энтальпии положительно, а значит реакция эндотермическая (поглощается тепло). Полученный результат согласуется с известным фактом, что при восстановлении железной руды до свободного железа необходимо подводить к реакционной системе большое количество теплоты. Отметим, однако, что 490,6 кДж — это теплота, которая поглощалось бы, если бы реакция проводилась при 298 К, а не при 1800 К, как это происходит в доменной печи. Получается, что наше решение неверно? Нет, оно абсолютно верно, просто тепловой эффект (+490,6 кДж) следует рассматривать как телоту, поглощаемую при нагревании оксида железа (III) и углерода от 298 до 1800 К, последующей реакции между ними и охлаждением снова до комнатной температуры 298 К. Изменение энтальпии, или теплота реакции, зависит только от исходного и конечного состояний участников реакции, а нет от того, остается ли температура постоянной или поднимается до уровня, достигаемого в доменной печи, и затем опускается снова. Важно лишь то, что в конце процесса, как и в его начале, температура имеет значение 298 К. Еще раз повторяю, ибо это очень важный момент: Когда мы ссылаемся на теплоты реакции и утверждаем, что полученные значения относятся к процессу, проводимой «при давлении 1 атм и 298 К», требуется только, чтобы реакция начиналась при этих условиях и продукты были приведены к этим условиям (1 атм и 298 К).
Пример 2. Определите теплоту сгорания жидкого бензола.
Запишем полное уравнение реакции с указанием теплот образования всех участвующих в нем веществ:
Теплота этой реакции, как она записана (с 2 молями бензола), равна:
Надеюсь урок 21 «Теплота образования» был не скучным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 21. Теплота образования
В уроке 21 «Теплота образования» из курса «Химия для чайников» рассмотрим что такое теплоты образования и откуда их брать; выясним, какие условия считаются стандартными, а также различия простых и сложных веществ; для закрепления полученных знаний решим пару задач, где используются теплоты образования и закон аддитивности теплот реакций. Будет неплохо, если перед прочтением данного урока, вы изучите материал про изменение энтальпии, а также про теплоты сгорания.
Стандартное состояние вещества
Для кристаллических и жидких веществ стандартное состояние определяется как наиболее распространенная форма элемента при 25°С (298 К*) и внешнем давлении 1 атмосфера (атм); стандартное состояние газов определяется аналогичным образом, но при парциальном ** давлении 1 атм. Вот например, стандартным состоянием углерода считается графит, а не алмаз.
** Парциальное давление — это давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре.
Простые и сложные вещества
Все вещества можно разделить на две обширные группы — простые и сложные вещества.
Простые вещества — это вещества, образованные из атомов одного элемента. Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Сложные вещества (химические соединения) — это вещества, образованные атомами разных элементов. Так, оксид меди CuO образован атомами элементов меди Cu и кислорода O, вода H2O — атомами элементов водорода H и кислорода O.
Теперь вы понимаете различия простых веществ от сложных. Так вот, теплота образования простых веществ всегда равна нулю. Это, пожалуйста, запомните.
Стандартные теплоты образования
Вспомним прошлый урок, где мы пытались синтезировать алмаз. Теплоты образования всех веществ, участвующих в этом синтезе таковы:
Как уже было отмечено выше, O2 относится к простым веществам, поэтому его теплота образования равна нулю. Таблицы стандартных теплот образования ΔH°298 соединений из чистых элементов приведена ниже под спойлером. В этой таблице нижний индекс 298 обозначает комнатную температуру (298 К = 25°С), а верхний индекс (знак градуса) означает, что реагенты и продукты находятся в своих стандартных состояниях. Однако не обязательно пользоваться записью ΔH°298, достаточно лишь написать ΔH.







Сейчас, на примере старой и доброй реакции (4) получения алмаза путем окисления метана, я покажу вам, как по теплотам образования веществ можно определить теплоту общей реакции. Это уравнение можно получить суммированием уравнения (2) с удвоенным уравнением (3) и обращенным уравнением (1):
У кого возник вопрос, почему же мы не вычитаем теплоту образования кислорода, ответ ищите в таблице теплот образования.
Очевидно, что при таких вычислениях следует быть очень внимательным к знакам и коэффициентам. Чтобы не допустить ошибки, настоятельно рекомендую вам выписывать отдельно каждое уравнение с соответствующей теплотой реакции в таком виде, чтобы сумма всех индивидуальных уравнений давала требуемую реакцию. Если все коэффициенты какого-либо уравнения умножены на произвольное число n, на это же число n должна быть умножена соответствующая теплота образования, а если используется обращенное уравнение реакции образования, то следует изменить свой знак перед табличной величиной ΔH. Когда индивидуальные уравнения суммируются для получения требуемой реакции, сумма индивидуальных теплот образования дает искомую теплоту реакции. А теперь закрепим полученные знания примерами.
Пример 1. Чему равна стандартная теплота реакции восстановления оксида трехвалентного железа Fe2O3 углеродом С до железа Fe и моноксида углерода O, протекающей в доменной печи?
Запишем уравнение реакции, указав под каждым веществом его стандартную теплоту образования:
Стандартная теплота образования простых элементов (С и Fe) по определению равна нулю. Стандартная теплота рассматриваемой реакции равна:
Как видите, изменение энтальпии положительно, а значит реакция эндотермическая (поглощается тепло). Полученный результат согласуется с известным фактом, что при восстановлении железной руды до свободного железа необходимо подводить к реакционной системе большое количество теплоты. Отметим, однако, что 490,6 кДж — это теплота, которая поглощалось бы, если бы реакция проводилась при 298 К, а не при 1800 К, как это происходит в доменной печи. Получается, что наше решение неверно? Нет, оно абсолютно верно, просто тепловой эффект (+490,6 кДж) следует рассматривать как телоту, поглощаемую при нагревании оксида железа (III) и углерода от 298 до 1800 К, последующей реакции между ними и охлаждением снова до комнатной температуры 298 К. Изменение энтальпии, или теплота реакции, зависит только от исходного и конечного состояний участников реакции, а нет от того, остается ли температура постоянной или поднимается до уровня, достигаемого в доменной печи, и затем опускается снова. Важно лишь то, что в конце процесса, как и в его начале, температура имеет значение 298 К. Еще раз повторяю, ибо это очень важный момент: Когда мы ссылаемся на теплоты реакции и утверждаем, что полученные значения относятся к процессу, проводимой «при давлении 1 атм и 298 К», требуется только, чтобы реакция начиналась при этих условиях и продукты были приведены к этим условиям (1 атм и 298 К).
Пример 2. Определите теплоту сгорания жидкого бензола.
Запишем полное уравнение реакции с указанием теплот образования всех участвующих в нем веществ:
Теплота этой реакции, как она записана (с 2 молями бензола), равна:
Надеюсь урок 21 «Теплота образования» был не скучным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 21. Теплота образования
Стандартное состояние вещества
Для кристаллических и жидких веществ стандартное состояние определяется как наиболее распространенная форма элемента при 25°С (298 К*) и внешнем давлении 1 атмосфера (атм); стандартное состояние газов определяется аналогичным образом, но при парциальном ** давлении 1 атм. Вот например, стандартным состоянием углерода считается графит, а не алмаз.
** Парциальное давление — это давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре.
Простые и сложные вещества
Все вещества можно разделить на две обширные группы — простые и сложные вещества.
Простые вещества — это вещества, образованные из атомов одного элемента. Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Сложные вещества (химические соединения) — это вещества, образованные атомами разных элементов. Так, оксид меди CuO образован атомами элементов меди Cu и кислорода O, вода H2O — атомами элементов водорода H и кислорода O.
Теперь вы понимаете различия простых веществ от сложных. Так вот, теплота образования простых веществ всегда равна нулю. Это, пожалуйста, запомните.
Стандартные теплоты образования
Вспомним прошлый урок, где мы пытались синтезировать алмаз. Теплоты образования всех веществ, участвующих в этом синтезе таковы:
Как уже было отмечено выше, O2 относится к простым веществам, поэтому его теплота образования равна нулю. Таблицы стандартных теплот образования ΔH°298 соединений из чистых элементов приведена ниже под спойлером. В этой таблице нижний индекс 298 обозначает комнатную температуру (298 К = 25°С), а верхний индекс (знак градуса) означает, что реагенты и продукты находятся в своих стандартных состояниях. Однако не обязательно пользоваться записью ΔH°298, достаточно лишь написать ΔH.







Сейчас, на примере старой и доброй реакции (4) получения алмаза путем окисления метана, я покажу вам, как по теплотам образования веществ можно определить теплоту общей реакции. Это уравнение можно получить суммированием уравнения (2) с удвоенным уравнением (3) и обращенным уравнением (1):
У кого возник вопрос, почему же мы не вычитаем теплоту образования кислорода, ответ ищите в таблице теплот образования.
Очевидно, что при таких вычислениях следует быть очень внимательным к знакам и коэффициентам. Чтобы не допустить ошибки, настоятельно рекомендую вам выписывать отдельно каждое уравнение с соответствующей теплотой реакции в таком виде, чтобы сумма всех индивидуальных уравнений давала требуемую реакцию. Если все коэффициенты какого-либо уравнения умножены на произвольное число n, на это же число n должна быть умножена соответствующая теплота образования, а если используется обращенное уравнение реакции образования, то следует изменить свой знак перед табличной величиной ΔH. Когда индивидуальные уравнения суммируются для получения требуемой реакции, сумма индивидуальных теплот образования дает искомую теплоту реакции. А теперь закрепим полученные знания примерами.
Пример 1. Чему равна стандартная теплота реакции восстановления оксида трехвалентного железа Fe2O3 углеродом С до железа Fe и моноксида углерода O, протекающей в доменной печи?
Запишем уравнение реакции, указав под каждым веществом его стандартную теплоту образования:
Стандартная теплота образования простых элементов (С и Fe) по определению равна нулю. Стандартная теплота рассматриваемой реакции равна:
Как видите, изменение энтальпии положительно, а значит реакция эндотермическая (поглощается тепло). Полученный результат согласуется с известным фактом, что при восстановлении железной руды до свободного железа необходимо подводить к реакционной системе большое количество теплоты. Отметим, однако, что 490,6 кДж — это теплота, которая поглощалось бы, если бы реакция проводилась при 298 К, а не при 1800 К, как это происходит в доменной печи. Получается, что наше решение неверно? Нет, оно абсолютно верно, просто тепловой эффект (+490,6 кДж) следует рассматривать как телоту, поглощаемую при нагревании оксида железа (III) и углерода от 298 до 1800 К, последующей реакции между ними и охлаждением снова до комнатной температуры 298 К. Изменение энтальпии, или теплота реакции, зависит только от исходного и конечного состояний участников реакции, а нет от того, остается ли температура постоянной или поднимается до уровня, достигаемого в доменной печи, и затем опускается снова. Важно лишь то, что в конце процесса, как и в его начале, температура имеет значение 298 К. Еще раз повторяю, ибо это очень важный момент: Когда мы ссылаемся на теплоты реакции и утверждаем, что полученные значения относятся к процессу, проводимой «при давлении 1 атм и 298 К», требуется только, чтобы реакция начиналась при этих условиях и продукты были приведены к этим условиям (1 атм и 298 К).
Пример 2. Определите теплоту сгорания жидкого бензола.
Запишем полное уравнение реакции с указанием теплот образования всех участвующих в нем веществ:
Теплота этой реакции, как она записана (с 2 молями бензола), равна:
Надеюсь урок 21 «Теплота образования» был не скучным. Если у вас возникли вопросы, пишите их в комментарии.
ТЕПЛОТА ОБРАЗОВАНИЯ
то же, что энтальпия образа вания.
Смотреть что такое «ТЕПЛОТА ОБРАЗОВАНИЯ» в других словарях:
теплота образования — тепловой эффект реакции образования химических соединений из простых веществ в стандартном состоянии. Теплоты образования, приводимые в термодинамических справочниках, используют для расчётов тепловых эффектов любых реакций. * * * ТЕПЛОТА… … Энциклопедический словарь
теплота образования — энтальпия образования Изобарный тепловой эффект химической реакции образования данного химического соединения из простых веществ, отнесенный к одному молю или к одному килограмму этого соединения. Примечание Теплота образования одного моля… … Справочник технического переводчика
ТЕПЛОТА ОБРАЗОВАНИЯ — тепловой эффект реакции образования химических соединений из простых веществ в стандартном состоянии. Теплоты образования, приводимые в термодинамических справочниках, используют для расчетов тепловых эффектов любых реакций с помощью законов… … Большой Энциклопедический словарь
теплота образования — теплота образования; энтальпия образования Изобарный тепловой эффект химической реакции образования данного химического соединения из простых веществ, отнесенный к одному молю или к одному килограмму этого соединения … Политехнический терминологический толковый словарь
теплота образования — [formation heat] тепловой эффект реакции образования вещества из каких либо исходных веществ. Различают теплоту образования: из свободных атомов, теплоту образования из простых веществ, отвечающих наиболее устойчивым состоянием элементов при… … Энциклопедический словарь по металлургии
теплота образования — 3.1.5 теплота образования (heat of formation): Увеличение теплосодержания в результате образования 1 моля химического соединения из его элементов (простых веществ) при постоянном давлении. Источник … Словарь-справочник терминов нормативно-технической документации
теплота образования — susidarymo šiluma statusas T sritis Standartizacija ir metrologija apibrėžtis Šilumos kiekis, išsiskiriantis arba sugeriamas cheminiam junginiui susidarant iš vieninių medžiagų. atitikmenys: angl. heat of formation vok. Bildungswärme, f rus.… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
теплота образования — susidarymo šiluma statusas T sritis chemija apibrėžtis Šiluma, išsiskirianti arba sugeriama cheminiam junginiui susidarant iš vieninių medžiagų. atitikmenys: angl. heat of formation rus. теплота образования … Chemijos terminų aiškinamasis žodynas
теплота образования — susidarymo šiluma statusas T sritis fizika atitikmenys: angl. formation heat; heat of formation vok. Bildungswärme, f rus. теплота образования, f pranc. chaleur de formation, f … Fizikos terminų žodynas
Теплота образования — Тепловой эффект реакции образования вещества из каких либо исходных веществ. Различают: Т. о. из свободных атомов; Т. о. из простых веществ, отвечающих наиболее устойчивому состоянию элементов при данных давлении и температуре; теплоту… … Большая советская энциклопедия
ТЕПЛОТА ОБРАЗОВАНИЯ — тепловой эффект реакции образования хим. соединений из простых в в в стандартном состоянии. Т. о., приводимые в термодинамич. справочниках, используют для расчётов тепловых эффектов любых реакций … Естествознание. Энциклопедический словарь
Теоретическая часть



Тепловым эффектом химической реакции или какого-либо процесса называется количество теплоты, выделенной или поглощенной системой при отсутствии полезной работы и при одинаковой температуре исходных и конечных веществ. Тепловой эффект реакции зависит от агрегатного состояния и кристаллической модификации реагирующих веществ.
Химические реакции обычно протекают при постоянном давлении (открытая колба) или при постоянном давлении (в автоклаве), то есть являются соответственно изобарными (V=const) или изохорными (Р=const) процессами.
Процессы, сопровождающиеся выделением теплоты, называются экзотермическими а процессы, при которых теплота поглощается, называются эндотермическими.
В термохимических расчетах используют термохимические уравнения. В них указывают тепловой эффект реакции, фазовое состояние и полиморфную модификацию реагирующих и образующихся веществ. (г-газовое; ж-жидкое; к-кристаллическое, т-твердое; р-растворенное и др.). Например:
Термохимические расчеты проводят, используя энтальпии (теплоты) образования веществ. Под энтальпией образования понимают тепловой эффект реакции образования 1 моль вещества их простых. Обычно используют стандартные энтальпии образования (ΔΗ°обр. 298 или ΔΗ°f, 298). Стандартные энтальпии образования простых веществ, устойчивых в стандартных условиях, приняты равными нулю.
В основе термохимических расчетов лежит закон Гесса: тепловой эффект химической реакции зависит только от начального и конечного состояния системы и не зависит от ее промежуточных состояний.
Следствия закона Гесса:
· Тепловой эффект разложения какого-либо соединения равен, но противоположен по знаку тепловому эффекту его образования.
· Если две реакции из различных начальных состояний приходят к одному конечному, то разность их тепловых эффектов равна тепловому эффекту перехода из одного начального состояния в другое.
· Если две реакции имеют одинаковые начальные состояния и разные конечные, то разность их тепловых эффектов равна тепловому эффекту перехода из одного конечного состояния в другое.
Закон Гесса позволяет рассчитывать теплоты образования нестабильных соединений и тепловые эффекты реакций, которые нельзя осуществить экспериментально.
Согласно закону Гесса тепловой эффект реакции представляет собой разность между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ. Для реакции
тепловой эффект Н определяется равенством
На практике при проведении термохимических измерений наиболее часто определяют следующие тепловые эффекты: теплоту образования, теплоту разложения, теплоту сгорания, теплоту растворения и теплоту нейтрализации.
Теплотой образования вещества называется тепловой эффект реакции образования 1 моля сложного вещества из простых, наиболее устойчивых при температуре 25˚С (298 0 К) и р = 101,3 кПа. Например:
Теплотой разложения вещества называется количество теплоты, выделяемое или поглощаемое при разложении 1 моля сложного вещества на более простые соединения, например:
СаСО3 = СаО + СО2 + 179,08 кДж
Теплотой сгорания называется тепловой эффект реакции окисления 1 моля данного соединения кислородом с образованием высших оксидов соответствующих элементов, например:
Теплотой растворения называется количество теплоты, которое выделяется или поглощается при растворении 1 моля вещества в таком объеме растворителя, чтобы при дальнейшем разбавлении раствора не наблюдалось изменения теплового эффекта.
При растворении соли в воде протекают одновременно два процесса:
3) разрушение кристаллической решетки вещества. При этом тепло поглощается (Q1);
4) гидратация ионов. При этом тепло выделяется (Q2).
Тепловой эффект растворения соли будет равен сумме тепловых эффектов этих процессов:
Поэтому вещества, обладающие прочной кристаллической решеткой и слабо гидратирующиеся в растворе, растворяются с поглощением тепла. Вещества с невысокой прочностью кристаллической решеткой, образующие в растворе сильно гидратированные ионы растворяются с выделением тепла.
Теплота растворения вещества увеличивается с разбавлением, но лишь до 100- 300 моль растворителя на 1 моль растворяемого вещества. Дальнейшее разбавление раствора практически не изменяет величину теплоты растворения.
Теплотой нейтрализации называется количество теплоты, выделяющееся при взаимодействии эквивалента кислоты с эквивалентом щелочи. При нейтрализации водных растворов сильных кислот сильными основаниями выделяется всегда одинаковое количество тепла, равное 57,11 кДж на 1 моль-эквивалент кислоты или основания (закон постоянства теплоты нейтрализации). Это объясняется процессом взаимодействия ионов:
Сказанное справедливо для растворов сильных кислот и оснований. В случае растворов слабой кислоты или основания процесс взаимодействия сопровождается диссоциацией слабого электролита. Диссоциация имеет характерный для каждого вещества тепловой эффект (тепловой эффект диссоциации)..
Второй закон термодинамики устанавливает возможность, направление и предел протекания самопроизвольных процессов. Чаще всего встречаются несколько формулировок второго закона:
Теплота не может сама собой переходить от менее нагретого тела к более нагретому.
Невозможен вечный двигатель второго рода, т. е. невозможна такая периодически действующая машина, которая позволяла бы получать работу только за счет охлаждения источника теплоты.
Эти формулировки связаны друг с другом и вытекают одна из другой. Обе они указывают на невозможность самопроизвольного протекания определенных процессов. Для оценки возможности протекания процесса в том или ином направлении введена величина – энтропия. Энтропия – это мера беспорядка.
При переходе системы из более упорядоченного в менее упорядоченное состояние энтропия возрастает (ΔS>0). В случае перехода из менее упорядоченного состояния в более упорядоченное энтропия системы уменьшается (ΔS