стрептококк вестибулярис что это
Бета-гемолитический стрептококк – одна из самых опасных существующих бактерий
Заболевания, вызываемые гемолитическими стрептококками, известны и описаны очень давно, но сами гемолитические стрептококки открыты и описаны относительно недавно. Впервые это сделал в 1874 году немецкий хирург Теодор Бильрот, выделив гемолитический стрептококк из раневых поверхностей, а также исследовав больных с рожистым воспалением.
Из числа стрептококков, патогенных для человека, с середины 80-х г.г. ХХ столетия во многих странах мира наблюдается рост заболеваемости, обусловленной бета-гемолитическими стрептококками группы А (БГСА, S.pyogenes).
Главными путями передачи являются воздушно-капельный, контактный и пищевой.
Основные формы заболевания представлены:
С тех пор о стрептококках стало известно практически всё, однако пристальное внимание учёных и врачей к стрептококку не ослабевает, этому находится несколько причин:
— бета-гемолитический стрептококк группы А – один из наиболее распространенных возбудителей бактериальных инфекций человека;
— в последнее десятилетия во всём мире отмечено изменение распространения стрептококковых инфекций с преобладанием тяжёлых проявлений (развитием сепсиса, синдрома инфекционно–токсического шока), это очень тяжёлые состояния, угрожающие жизни пациента;
— по данным Министерства Здравоохранения Республики Беларусь основной экономический ущерб, вызванный инфекцией бета-гемолитического стрептококка группы А, в 10 раз выше, чем ущерб от вирусных гепатитов, вместе взятых, и обеспечивается, в основном, стрептококковой ангиной (57,6%) и другими стрептококковыми ОРЗ (30,3%).
Что необходимо знать о бета-гемолитическом стрептококке?
Некоторые виды гемолитических стрептококков имеют практическое значение:
— streptococcus lactis сбраживает лактозу с образованием молочной кислоты, которая применяется для получения кисломолочных продуктов (кефира, простокваши, ряженки);
— известны виды, образующие полисахарид декстран, из которого готовят кровезаменитель.
Стрептококки очень опасны, прежде всего, за счёт выделяемых токсинов, которые ответственны за внутреннее поражение органов заболевшего. Однако это ещё половина неприятностей. Токсины стрептококка могут спровоцировать неадекватный иммунный ответ пациента и запустить аутоиммунные реакции, вызывающие такие тяжёлые заболевания, как ревматизм и гломерулонефрит, которые без правильного лечения часто заканчиваются плачевно.
Пути передачи заболевания
Стрептококки передаются воздушно-капельным, контактным, алиментарным (через еду) путём через слюну, при кашле, чихании, поцелуях, а также через бытовые предметы.
Инфекция распространяется очень быстро в закрытых коллективах (детских садах, яслях, школах, в армейских коллективах и т.д.).
Самым опасным для человека считается бета-гемолитический стрептококк группы А. Вы можете встретить его разные названия: пиогенный стрептококк или сокращённо БГСА, или на латинском языке Streptococcus pyogenes, или просто S.рyogenes.
Основные заболевания, вызываемые бета-гемолитическим стрептококком
Количество заболеваний, которые вызывает БГСА, очень большое: ангина, фарингит, скарлатина, рожистое воспаление, паратонзиллярный абсцесс, флегмона шеи, сепсис, отиты, менингит, фасциты и миозиты, стрептодермия, ревматизм, гломерулонефрит.
Каждое из этих заболеваний очень серьёзное и несёт в себе угрозу. При выявлении БГСА необходимо как можно раньше назначить адекватную антибиотикотерапию.
Streptococcus pyogenes сохраняет 100%-ную чувствительность к бета-лактамным антибиотикам (пенициллинам, цефалоспоринам, карбапенемам). Они остаются единственным классом антибиотиков, к которым у S.pyogenes не развилась резистентность.
Актуальной проблемой является устойчивость к макролидам, которая в некоторых регионах мира превышает 30%.
Диагностика стрептококковых инфекций
До сих пор диагностика инфекций, вызванных БГСА, представляет значительную сложность. В Республике Беларусь в качестве быстрого определения БГСА в ротовой полости зарегистрирован и применяется экспресс-анализ методом иммунохроматографии.
Врач бактериологического отдела
ЦДЛ городской больницы
Мясникова Н.М.
Приемная главного врача
(+375 214) 50-62-70
(+375 214) 50-62-11 (факс)
Канцелярия
(+375 214) 50-15-39 (факс)
Зеленящие стрептококки
Темой сегодняшнего разговора будет группа зеленящих стрептококков – наименование не очень легитимное, но прочно вошедшее в практику. Под наименованием «Зеленящие стрептококки или S.viridans» прячется целая группа микроорганизмов, относящихся к альфа-зеленящим стрептококкам семейства Streptococcaceae.
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой сегодняшнего разговора будет группа зеленящих стрептококков – наименование не очень легитимное, но прочно вошедшее в практику, как и обзывательство антибактериальной терапии – антибиотикотерапией, а кто мы такие, чтобы отменять традиции.
Под наименованием «Зеленящие стрептококки или S.viridans» прячется целая группа микроорганизмов, относящихся к альфа-зеленящим стрептококкам семейства Streptococcaceae. Эта группа является очень важным компонентом в составе нормально микрофлоры полости рта, слизистых оболочек дыхательных путей, пищеварительного тракта и половых органов. Поэтому обнаружив следующих ее представителей (S.gordonii, S.oralis, S. mutants, S.sanguis и S.salivarius) в посеве из полости рта, не надо немедленно начинать это лечить – этим вы только навредите организму, выбив из его состава важный компонент его нормальной микрофлоры.
Рассмотрим основных представителей семейства, на которых больше всего шансов наткнуться в антибиотикограммах.
Диагностические аспекты
Освоив вышеприведенный материал, мы видим, что только обнаружение данных микроорганизмов в стерильных средах может указывать на них как на потенциальных возбудителей. Почему все-таки потенциальных? Да потому, что в 80% случаев это может оказаться банальной контаминацией в связи с несоблюдением техники забора материала (все мы дышим, и если материал забирается с нарушением правил асептики и антисептики и без использования закрытых систем, то налететь в пробирку может много чего и не только из наших рта и носов). Таким образом, посевы нужно повторять.
Обнаружение этого же зоопарка в местах естественного его обитания не говорит нам практически ничего, если только пациент совсем не следит за полостью рта, и тогда ему можно настоятельно рекомендовать посещение стоматолога.
Аспекты антибактериальной терапии
Группа зеленящих стрептококков природно резистентна к тетрациклинам, макролидам и клиндомицину (до 50% штаммов), к биссептолу резистентно более 75%. Таким образом об этих группах мы даже не вспоминаем.
Само лечение должно быть комплексным и часто в сочетании с хирургическим. Выбор конкретных препаратов будет зависеть от локализации процесса, тяжести состояния пациента и выделенного возбудителя
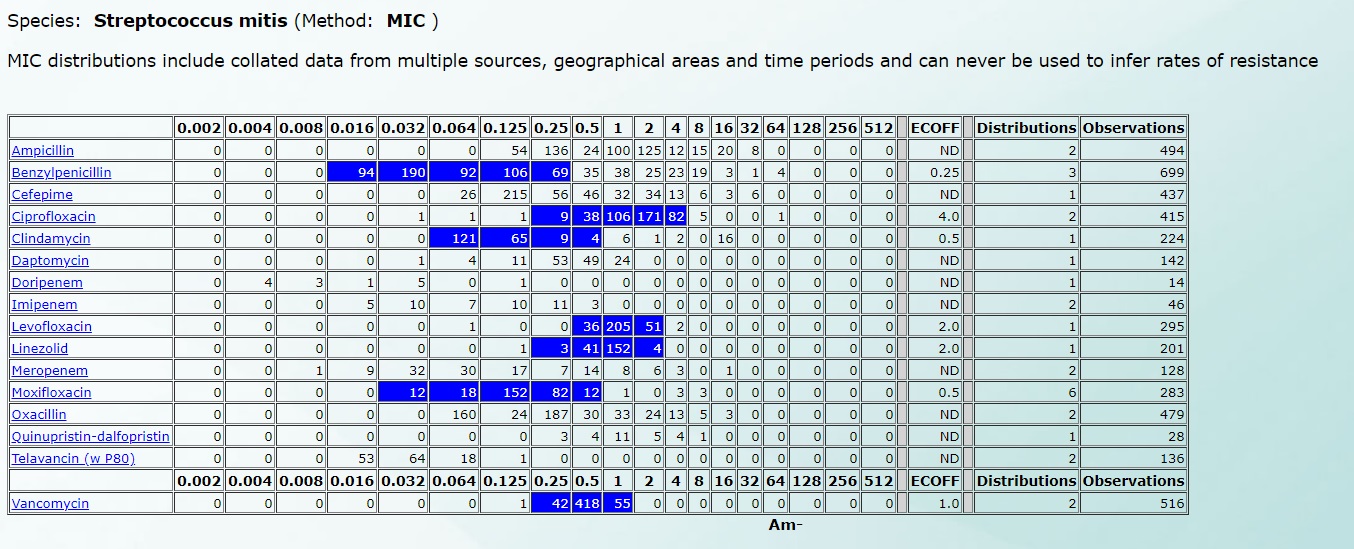
Например, чувствительность Streptococcus mitis будет выглядеть так (нажмите на картинку для увеличения):
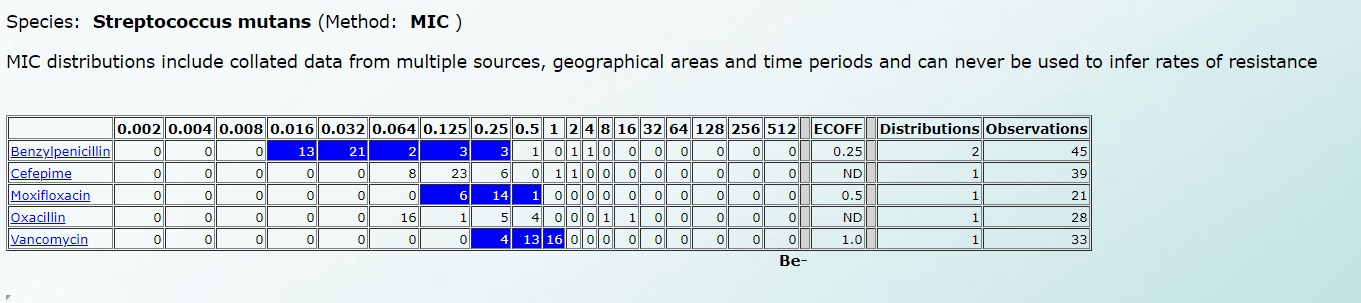
А чувствительность к Streptococcus mutans – вот так (нажмите на картинку для увеличения):
Подробнее все рассмотреть можно по этой ссылке, ведь именно на этой базе данных работают автоматические и полуавтоматические анализаторы в микробиологических лабораториях.
Препаратами выбора будут являться:
Как и в случае с любым стрептококком, крайне важно соблюдать длительность лечения, и она должна быть не менее 10-14 дней. Исключение составляет бактериальный эндокардит, там сроки лечения как минимум удваиваются.
В заключение хотелось бы сказать, что как ни прискорбно это сознавать, но недоступность, в первую очередь финансовая, адекватной стоматологической помощи вновь привела к всплеску заболеваний связанных с неблагополучием в полости рта, таким образом, мы вновь вынуждены вспоминать, что инфекционный эндокардит – это не только болезнь наркоманов и лиц со сниженным иммунным статусом, но и тех, у кого недостаточно средств на хорошего стоматолога, а потому и нам не лишне иногда осматривать полость рта у пациентов с инфекциями кровотока или абсцессами в головном мозге или печени.
Streptococcus spp. (качественный метод)
Описание исследования
Род Streptococcus spp. (стрептококки) – это шаровидные или яйцевидные грамположительные факультативно-анаэробные (не нуждающиеся в кислороде, но и не гибнущие в его присутствии) не образующие спор бактерии семейства Streptococcaceae, паразитирующие в организмах людей и животных. Местами их локации являются дыхательные пути, пищеварительная система (особенно рот, нос, толстый кишечник).
Стрептококки классифицируются по типу гемолиза (разрушения эритроцитов), наблюдаемого при росте бактерий на питательных средах, содержащих кровь животных, на:
К патологически значимым стрептококкам относятся:
Болезни, возбуждаемые стрептококками, отличаются по степени тяжести и месту локализации. К их числу относятся:
Особую опасность стрептококковые инфекции представляют для детей и пожилых людей. Заражение обычно происходит при личном контакте с инфицированным лицом либо же воздушно-капельным путем. Максимальное количество заболевших регистрируется в осенне-зимний период, когда сопротивляемость организма снижается и нередки случаи переохлаждения (это является одной из частых причин поражения инфекцией). Также инфицированию способствуют иммунодефицитные состояния, пристрастие к алкоголю или наркотикам.
Менингит, возникающий в результате заражения Streptococcus, не имеет возрастной избирательности и может поразить человека любых лет. У лиц с очень ослабленным иммунитетом велика вероятность развития таких болезней как:
В данном случае перечисленные выше заболевания имеют гематогенную природу, т.е. они возникают при попадании стрептококка в кровь и занесении ею бактерии в поражаемый орган.
Выявление специфических фрагментов ДНК Streptococcus spp. применяется для определения возбудителя инфекции:
Тестирование проводится методом полимеразной цепной реакции в режиме реального времени.
Аналитические показатели теста:
Подготовка к исследованию
Соскоб урогенитальный (цервикальный канал, влагалище, уретра)
Соскобы у женщин отбираются не ранее пятого дня от начала менструального цикла и не позже пятого дня до предполагаемой даты следующей менструации. Если наблюдаются явные признаки заболевания, отбор пробы проводится непосредственно в день обращения.
Требования по подготовке к тестированию:
Проба не отбирается:
Мочеиспускательный канал (уретра)
У лиц обоего пола проба отбирается не ранее чем через 14 дней после применения антибиотиков местного действия и 30 дней после перорального приема противобактериальных средств.
За неделю до манипуляции рекомендуется прекратить прием всех медицинских препаратов. Если отказ от лечения невозможен, то пациенту необходимо поставить об этом в известность специалиста, направляющего его на обследование.
При отборе эпителиальных клеток из мочеиспускательного канала, манипуляция проводится перед мочеиспусканием или через 2-3 часа после него (при обильных выделениях из уретры у мужчин – через 1 час).
Сперма
Отбор материала с целью диагностики проводится до начала противобактериального, антивирусного и противопаразитарного лечения, химиотерапии, а также до лечебных или диагностических мероприятий в месте предполагаемой локализации агента инфекции. После курса лечения проба отбирается не ранее, чем через 10-14 дней при проведении локальной терапии и через 30 дней после перорального приема антибиотиков.
На анализ собирается порция первой утренней мочи, выделенной не ранее, чем через 2-3 часа после предыдущего (ночного) мочеиспускания. Ее объем должен составлять порядка 20-30 мл. Емкость, используемая для сбора биоматериала – стерильный медицинский контейнер.
Моча собирается либо до проведения химиотерапии или лечения антибиотиками, либо через месяц после окончания курса лечения.
Перед началом манипуляции необходимо тщательно обмыть гениталии. Женщинам желательно воспользоваться гигиеническим тампоном во избежание попадания в пробу слизи из влагалища. Во время менструации материал не собирается.
После наполнения контейнера на треть-половину объема, емкость с мочой плотно закрывается крышкой, дабы избежать ее вытекания.
Доставка биоматериала должна быть организована в течение максимум 6 часов. До отправки в лабораторию моча может храниться как в холодильнике (при t⁰ от +2⁰С – замораживать ее нельзя), так и в комнате, но при этом температура не должна быть выше +25⁰С.
Соскоб эпителиальных клеток с задней стенки глотки
Перед отбором биологического материала необходимо учесть следующее:
Подготовка к взятию соскоба включает в себя:
Перед проведением соскоба необходимо прополоскать рот, используя для этого воду комнатной температуры.
Для получения корректного результата тестирования все эти условия необходимо соблюсти в точности. Лечащий врач может рекомендовать иные условия проведения обследования.
Для проведения тестирования необходимо собрать порцию слюны. Сбор и транспортировка биоматериала осуществляется:
Перед отбором пробы не рекомендуется:
Проведение химиотерапевтического или противобактериального лечения назначается после обследования или до него, но с окончанием курса терапии не менее чем:
Прежде, чем отбирать слюну, необходимо трижды прополоскать рот, применяя для этого физиологический раствор или кипяченую воду.
Для отбора пробы у детей можно использовать шприц без иглы маленького объема. Для анализа достаточно половины микропробирки (1 мл). Слюна отбирается в защечном пространстве.
После сбора материала контейнер необходимо плотно закрыть крышкой. Микропробирка закрывается до щелчка.
Отобранный материал доставляется в лабораторию в день сбора. Если нет возможности отправить его сразу, необходимо поместить контейнер с образцом в холодильник и хранить его там при температуре от 2 до 8⁰С, но не дольше 10-12 часов.
Показания к исследованию
Интерпретация исследования
Данный тест – качественный, результат выдается в формулировках «обнаружено» или «не обнаружено».
Нормой является отсутствие в исследуемой пробе специфических фрагментов ДНК Streptococcus spp.
Результат анализа выдается на бланке лаборатории медицинской компании «Наука». Пример результата по данному анализу представлен ниже:
Ф.И.О.: Иванов Иван Иванович Пол: м Год рождения: 01.01.0000
Дата исследования: 12.12.0000
Стрептококковая инфекция группы В у новорожденных и грудных детей
Рассмотрены клинические проявления и исходы стрептококковой инфекции группы В (СГБ) у новорожденных, методы диагностики СГБ-инфекции, подходы к лечению и провилактике.
Clinical manifestations and clinical outcome of streptococcosis of B group, methods of streptococcosis of B group diagnostic, approaches to treatment and prophylaxis are covered.
Стрептококк группы В (S. agalactiae) является наиболее частой причиной заболеваемости и смертности новорожденных детей от менингита, сепсиса и пневмонии в развитых странах [1]. В США ежегодно заболевают тяжелой стрептококковой инфекцией группы В 8000 новорожденных, около 800 этих детей умирает. В Великобритании частота ранних неонатальных инфекций, вызванных стрептококком группы В (СГБ), составляет 3,6 случая на 1000 новорожденных [2]. Регистрация и профилактика СГБ-инфекции у беременных и новорожденных проводится во многих странах (США, Канада, Австралия, Бельгия, Франция и др.), что позволило радикально снизить частоту заболеваемости и летальность от данной инфекции у новорожденных. С введением в развитых странах антибиотикопрофилактики СГБ-инфекции в родах, частота развития менингита у детей в период с 1993 по 2008 год сократилась на 80 процентов [1]. В России мероприятия по регистрации и профилактике инфекций, вызванных СГБ, не проводятся.
Клинический случай. Ребенок (девочка) от первой беременности, протекавшей на фоне гестоза с 4-кратной угрозой прерывания. У матери во время беременности было обострение хронического пиелонефрита. Роды преждевременные на сроке 35–36 недель путем кесарева сечения. Масса тела при рождении 2650 г. Заболела в возрасте 24 дня: вялость, субфебрилитет, отказ от еды, срыгивания, жидкий стул 3–5 раз в день. На 4-й день болезни состояние резко ухудшилось, и девочка госпитализирована в инфекционный стационар. При поступлении состояние крайне тяжелое: среднемозговая кома, выбухание и пульсация большого родничка, частые приступы тонических судорог, дыхание аритимичное, ослабление дыхания в нижних отделах легких, мраморность кожи, акроцианоз, тахикардия до 190 уд./мин, «кофейная гуща» из желудка, олигурия. В общем анализе крови: Ley 21400, Tr 36000, п — 4%, с — 56%, э — 0%, б — 6%, л — 24%, м — 13%, t сверт. 9 мин, СОЭ 23 мм/ч. Результаты исследования ликвора: ликвор желтый, мутный, pH = 7,0, реакция Панди ++++, реакция Нонне-Апельта ++++, цитоз 34 тыс. клеток в 1 мкл (нейтрофилы 89%, лимфоциты 11%), белок 2,98 г/л, глюкоза 3,8 ммоль/л. В биохимическом анализе крови выявлена умеренная гипербилирубинемия и гиперферментемия, снижение протромбинового индекса (ПТИ) до 40%, декомпенсированный метаболический ацидоз (рН 6,8; ВЕ — 27,3 ммоль/л). Результаты бактериологического исследования крови и ликвора отрицательные. Положительный латекс-тест на антиген S. agalactiaе в ликворе. Исследования фекалий на ротавирус, патогенные и условно-патогенные микроорганизмы отрицательные. Заключительный диагноз: поздний неонатальный сепсис, вызванный S. agalactiae (менингоэнцефалит, кардит, энтероколит, пневмония, гепатит). Осложнения: полиорганная недостаточность. Септический шок II–III стадии. Отек-набухание головного мозга. Диссеминированное внутрисосудистое свертывание (ДВС-синдром) III стадии. Ребенок получил 4 курса антибактериальной терапии (ампициллин, цефтриаксон, меронем, амикацин, ванкомицин), посиндромную терапию. Выписана в удовлетворительном состоянии на 27-й день болезни.
Источник СГБ-инфекции и риск заболевания у ребенка
СГБ являются представителями нормальной микрофлоры урогенитального, кишечного тракта и верхних дыхательных путей человека. СГБ обнаруживаются в составе микрофлоры влагалища у 15–45% женщин [3]. Преобладает бессимптомная колонизация (носительство), но СГБ может стать причиной развития у женщины инфекции мочевых путей, сепсиса, хориоамнионита, эндометрита, тромбофлебита и эндокардита. Наиболее высок уровень колонизации у женщин моложе 20 лет, ведущих активную половую жизнь, использующих ВМС-контрацепцию [4]. Беременность не влияет на частоту носительства СГБ.
По нашим данным частота носительства S. agalactiaе в урогенитальном тракте у женщин репродуктивного возраста г. Казани составляет 12,7%. Результаты получены при бактериологическом исследовании мазков из цервикального канала, слизистой влагалища, мочи 172 женщин с использованием полихромогенной среды с последующей идентификацией микроорганизмов на анализаторе VITEK. Не исключается, что частота носительства СГБ выше, поскольку не проводилось бактериологическое исследование ректальных мазков.
Основным источником инфицирования новорожденных детей СГБ является мать [4]. Инфицирование ребенка может произойти внутриутробно, а также в родах. Родоразрешение путем кесарева сечения не снижает риск инфицирования ребенка СГБ. Вертикальный путь передачи СГБ в основном приводит к развитию ранней стрептококковой инфекции (срок развития до 7-го дня жизни). Основными факторами риска развития СГБ-инфекции у новорожденных являются: бактериурия S. agalactiae у матери во время беременности, неонатальные СГБ-инфекции у ранее рожденных детей, недоношенность (
И. В. Николаева, кандидат медицинских наук, доцент
Казанский государственный медицинский университет, Казань
Топическая терапия при острых тонзиллофарингитах

Рассмотрены роль различных возбудителей в развитии воспалительных заболевания глотки и небных миндалин, а также подходы к лечению воспалительных заболеваний ротоглотки с использованием антисептиков местного действия.
Meaning of different agents in development of inflammatory diseases of pharynx and palatine tonsils was considered, as well as approaches to treatment of fauces inflammatory diseases using antiseptics with local effect.
Микробиота слизистых оболочек, которая представлена сообществами микроорганизмов в виде биопленок, гомеостатична и играет положительную роль в обменных процессах на слизистой оболочке и защите от внешних патогенов. В организме человека специфическое преимущество такой организации микроорганизмов заключается в обеспечении гомеостаза органов, функциональность которых зависит от населяющих их микробов. Здоровый вид кожи, нормальное пищеварение и, конечно, устойчивость к внешней инфекции (состояние иммунитета) человека во многом определяется стабильностью, можно сказать, «здоровьем», его микрофлоры [2].
Макроорганизм и его микрофлора в нормальных условиях находятся в состоянии эубиоза, сложившегося в процессе эволюции. При изменении баланса участия микроорганизмов в физиологических процессах на слизистых оболочках или коже организма-хозяина нарушается гомеостаз метаболических процессов, стабильность иммунной системы. Если возмущение превосходит компенсаторные ресурсы организма, происходит неконтролируемый каскад различных физиологических, биохимических и иммунных процессов с клиническими проявлениями в виде симптомокомплексов. Кишечные, кожные, кардиоваскулярные, мочеполовые и другие заболевания причинно-следственно связаны с изменением микрофлоры местной локализации и кишечной, как депо микроорганизмов в теле человека [22].
_250.gif)
Эти современные знания о биопленках важны и для понимания роли микрофлоры верхних дыхательных путей в здоровье организма, и принципах лечения острых респираторных вирусных заболеваний. Микрофлора глотки многочисленна и вариабельна и в норме сходна с микрофлорой пищеварительного и респираторного трактов. В ее составе у здоровых людей постоянно обнаруживают β-гемолитические и негемолитические стрептококки, микрококки, эпидермальный стафилококк, нейссерии, дифтероиды, псевдодифтерийные бактерии, вейлонеллы, бактероиды, актиномицеты, сапрофитические трепонемы, микоплазмы. Факультативными для глотки являются: золотистый стафилококк, β-гемолитический стрептококк, клебсиелла, пневмонии и др. энтеробактерии, кандиды, нокардии, а также гемофильная палочка [13].
Постоянные микроорганизмы относятся к комменсалам, и их спектр сформировался благодаря эволюционно сложившимся отношениям симбиоза и антагонизма между самими микроорганизмами и их взаимоотношениями с макроорганизмом. В разнообразии видов здесь доминируют бактерии. Простейшие и вирусы представлены значительно меньшим числом видов. В норме от микроорганизмов свободны кровь, ликвор, синовиальная жидкость, костный мозг, брюшная полость, плевральная полость, матка [22].
В полости рта находится больше различных видов бактерий, чем в остальных отделах желудочно-кишечного тракта, и это количество, по данным разных авторов, составляет от 160 до 300 видов. Бактерии попадают в полость рта с воздухом, водой, пищей — так называемые транзитные микроорганизмы, время пребывания которых ограничено. А постоянная (резидентная) микрофлора, образующая сложную и стабильную экосистему полости рта и глотки, — это 30 видов микроорганизмов, которые выполняют ряд функций: с одной стороны, они участвуют в переваривании пищи, оказывают большое позитивное влияние на иммунную систему, являясь мощными антагонистами патогенной флоры; с другой стороны, они служат возбудителями и главными виновниками основных стоматологических и оториноларингологических заболеваний [5].
В развитии воспалительных заболевания глотки и небных миндалин ведущую роль занимают микроорганизмы, вегетирующие на слизистых ротовой полости и глотки. Следует отметить их разнообразие, среди которого аэробные, а также факультативные и облигатные анаэробные микроорганизмы, представленные грамотрицательными и грамположительными микроорганизмами. Значение микроорганизмов в возникновении воспалительных заболеваний тонзилло-фарингеальной зоны очень велико. Ключевыми факторами в развитии гнойного воспаления являются нарушение симбиоза между макро- и микроорганизмами, приобретение патогенных свойств микроорганизмами. Увеличение критического числа микробных тел, возрастание их инвазивности, выработка экзо- и эндоферментов, продуктов метаболизма способствуют формированию патологического очага и его распространению [1, 6].
Важно то, что это разнообразие микроорганизмов представляет собой оптимальные возможности для передачи детерминант резистентности, а в качестве резервуара будет в этом случае выступать нормальная микрофлора человека. Использование как системных, так и топических антибиотиков в случаях, когда они не показаны, вносит значительный вклад в этот процесс и способствует распространению в популяции микроорганизмов, устойчивых к антибиотикам [6, 9].
Инфекционные заболевания глотки — тонзиллиты и тонзиллофарингиты — большая группа заболеваний, различных по этиологиям, клиническим проявлениям, а также морфологическим и патоморфологическим признакам. Объединяющим фактором здесь служат микроорганизмы [2, 10].
Имеется прямая взаимосвязь между состоянием иммунной системы и активацией непатогенной флоры и/или оппортунистической микрофлоры полости рта (орроrtonus — удобный). Оппортунистические микроорганизмы активируются в условиях, удобных для них, — это иммунодефицитные состояния. Когда местные или системные механизмы нарушены, развивается оральный кандидоз, обусловленный дрожжеподобными грибами, присутствующими во рту у здоровых людей.
Самую большую группу постоянно обитающих в полости рта бактерий представляют кокки — 85–90% от всех видов. Они обладают значительной биохимической активностью, разлагают углеводы, расщепляют белки с образованием сероводорода.
Стрептококки являются основными обитателями полости рта: S. mutans, S. mitis, S. sanguis. Большинство из них — факультативные анаэробы, но встречаются и облигатные анаэробы (пептококки). Кислоты, продуцируемые стрептококками, подавляют рост некоторых гнилостных микроорганизмов, попадающих в полость рта из внешней среды. В зубном налете и на деснах здоровых людей присутствуют также стафилококки — St. epidermidis, иногда St. aureus [2].
Верхние отделы дыхательных путей несут особенно высокую микробную нагрузку, так как они анатомически приспособлены для осаждения бактерий из вдыхаемого воздуха. Помимо обычных негемолитических и зеленящих стрептококков, непатогенных нейссерий, стафилококков и энтеробактерий, в носоглотке можно обнаружить менингококки, пиогенные стрептококки, пневмококки и бордетеллы. Следует отметить, что указанные отделы у новорожденных обычно стерильны и колонизируются в течение 2–3 сут. По мере совершенствования защитных механизмов вероятность носительства патогенных бактерий снижается, и их сравнительно редко выделяют уже у подростков.
На состав микробных сообществ различных полостей организма влияют самые разнообразные факторы: чистота вдыхаемого воздуха, наличие пыли, химических и бактериальных загрязнений. Однако наибольшее воздействие оказывают заболевания, патогенез которых включает изменения физико-химических свойств эпителиальных поверхностей и прием антимикробных препаратов.
Стрептококки группы A (Str. pyogenes) — обычно вызывают фарингит, инфекцию кожи и мягких тканей, реже пневмонию и послеродовой сепсис, постинфекционные осложнения ревматизма и острый гломерулонефрит (ОГН). Они имеют много вирулентных факторов, включая антифагоцитарный М-протеин и тонкую капсулу из гиалуроновой кислоты, а также группу внеклеточных токсинов и ферментов, в том числе пирогенный токсин, стрептолизин, стрептокиназу и ДНКазы.
Тонзиллофарингит — рутинная инфекция среди взрослых и детей старше 3 лет, она дает 20–40% всех случаев острых фарингитов, передается от человека к человеку респираторным путем, а в ряде случаев и с пищей. Инкубационный период составляет в среднем 14 сут, после чего появляются боль в горле, лихорадка, озноб, плохое самочувствие, иногда тошнота, рвота и боль в животе. Симптомы весьма разнообразны, варьируя от минимальных до ярко выраженных с увеличением миндалин, гнойный налет отмечается на миндалинах и задней стенке глотки, шейные лимфатические узлы увеличены и болезненны. Обычно неосложненный стафилококковый фарингит длится 3–5 дней. Гнойные осложнения, нечастые из-за широкого применения антибиотиков, включают острый средний отит, синусит, перитонзиллярный или заглоточный абсцесс, менингит, воспаление легких, бактериемию, эндокардит [1, 2, 10].
В этиологии острого тонзиллофарингита участвуют как вирусы (риновирусы, ротавирусы, вирусы парагриппа, вирусы Коксаки), так и бактерии (стрептококки групп А, C, G, стафилококки, нейссерии, коринебактерии, спирохеты, листерии). Среди возбудителей бактериальной природы наибольшее значение принадлежит β-гемолитическому стрептококку группы А (БГСА, Streptococcus pyogenes), встречающемуся в 5–30% случаев острого тонзиллофарингита и обострения хронического тонзиллофарингита [12, 13].
Наиболее значимым бактериальным возбудителем острого тонзиллита является БГСА. Реже острый тонзиллит вызывают вирусы, стрептококки групп C и G, Arcanobacterium haemolyticum, Neisseria gonorrhoeae, Corynebacterium diphtheria (дифтерия), анаэробы и спирохеты (ангина Симановского–Плаута–Венсана), крайне редко — микоплазмы и хламидии [32]. В соответствии с Международной классификацией болезней 10-го пересмотра выделяют стрептококковый фарингит (J02.0), стрептококковый тонзиллит (J03.0). В зарубежной литературе широко используются взаимозаменяемые термины «тонзиллофарингит» и «фарингит». В России используется термин «стрептококковый тонзиллит», под которым понимается тонзиллит (ангина) или фарингит, вызванный БГСА.
БГСА передается воздушно-капельным путем. Источниками инфекции являются больные и, реже, бессимптомные носители. Инкубационный период при остром БГСА-тонзиллите составляет от нескольких часов до 2–4 дней. Хотя острый тонзиллит считается инфекционным заболеванием, стрептококковую ангину можно рассматривать как обострение хронического тонзиллита.
Золотым стандартом определения БГСА в полости рта, а значит, для назначения антибактериальной терапии, является Стрептатест. Чувствительность данного теста составляет по данным многоцентровых клинических исследования [19] 97,3%, а специфичность 95,3%. Современные тестовые системы позволяют получать результат через 15–20 минут с высокой специфичностью (95–100%), но меньшей, чем при культуральном исследовании, чувствительностью (60–95%). Экспресс-методы дополняют, но не заменяют культуральный метод. Кроме того, только при выделении возбудителя можно определить его чувствительность к антибиотикам [2, 19].
В России проблема нерационального использования антибиотиков при инфекциях верхних дыхательных путей осложняется и возможностью их безрецептурного приобретения пациентами и использования для самолечения. Польза от применения антибиотиков при фарингите весьма незначительна. Согласно результатам метаанализа, у 90% больных симптомы исчезают в течение недели независимо от приема антибиотиков. Антибиотики могут сокращать продолжительность симптомов менее чем на сутки. Более того, вероятность повторного обращения в медицинское учреждение по поводу фарингита у лиц, получавших антибиотики, выше, чем у пациентов, не принимавших их. При этом следует помнить, что антибактериальные препараты являются потенциально токсичной фармакологической группой и обусловливают до 25–30% всех побочных эффектов лекарственных средств [4, 7, 9, 11].
Согласно данным исследователей, системная антибактериальная терапия показана только при подтвержденной бактериальной этиологии фарингита. Согласно международным рекомендациям (Mac Isaac, 1994) [20], клинические критерии бактериальной этиологии фарингита следующие: воспаление миндалин, увеличение шейных лимфатических узлов, лихорадка и отсутствие кашля. Если у пациента присутствуют все 4 критерия, то антибактериальная терапия может назначаться эмпирически. Наличие двух или трех из перечисленных критериев + положительный тест на стрептококк группы А являются показанием к назначению антибиотиков. Пациентам, у которых отмечен один из указанных критериев или не было ни одного, не требуются постановка теста на стрептококковый антиген и проведение антибактериальной терапии.
Известно, что примерно 70% фарингитов вызываются вирусами, среди которых отмечают риновирусы, коронавирусы, среди бактериальных возбудителей острого фарингита ведущая роль принадлежит БГСА: 15–30% случаев заболевания у детей и 5–17% случаев у взрослых, относительно редко (
ФГБУ НКЦО ФМБА России, Москва