старение белка сопровождается чем
7 основных причин старения
Старение есть сумма всех механизмов, которые изменяют функции живого существа, препятствуют поддержанию физиологического баланса и в конечном итоге приводят к смерти. Процесс старения это процесс сложный, постепенный, зависящий от многих биологических факторов. Ученые всегда проявляли особый интерес к старению и поиску подходов к изучению этого феномена.
Исследования показали, что старение контролируется генетическими факторами и биологическими процессами, присущими человечеству.
Чтобы замедлить этот естественный процесс и увеличить продолжительности жизни, первым шагом является понимание причин старения: как оно действует на живые организмы, и какие факторы влияют на продолжительность жизни.
Существует 7 основных причин: повреждение генома, эпигенетические факторы, укорочение теломер, развернутая реакция белка, дисфункция митохондрий, клеточное старение и истощение стволовых клеток.
Ошибки репарации ДНК
Геном — это сумма генетической информации человека или вида. Геном является картой для построения всего организма. Генетическая информация, в основном, хранится в ядре клетки в виде молекул ДНК. Участок ДНК, задающий последовательность определённого полипептида, либо функциональной РНК, представляет ген. Геном человека содержит от 25 000 до 30 000 генов.
Но молекулы ДНК не лежат в свободном виде в ядре клетки, они упакованы вместе с белками-гистонами в хромосомы. Хромосомы содержат всю генетическую информацию и реплицируются с каждым клеточным делением.
На протяжении всей жизни клетки делятся множество раз, в результате генетический материал постоянно воспроизводится в живых системах и передается вновь созданным дочерним клеткам. Во время клеточного деления довольно часто наблюдаются генетические ошибки, которые образуются во время репликации ДНК. Они называются ошибками репликации ДНК. Ошибки репликации приводят к нарушению функционирования клетки и могут повлиять на оставшуюся ткань, если клетка не будет устранена в результате запуска апоптоза (гибели клеток) или старения (ухудшения функций клетки).
В организме также существует система, которая восстанавливает молекулу ДНК, модифицированную во время репликации. Система использует белки и ферменты. PARP1 — участвует в репарации ДНК и сиртуинов, а также в регуляции экпрессии генов, ремоделировании хроматина и функционировании митохондрий. NAD+ является косубстратом PARP. С возрастом происходит увеличение экспрессии белков PARP, что говорит о частых ошибках репликации и необходимости их устранения. В ответ на повреждения ДНК из-за работы PARP в клетке также очень быстро истощаются запасы NAD+, что приводит к клеточной гибели.
Активация фермента PARP может индуцировать сверхэкспрессию белка P53. Белок Р53 представляет другую систему контроля жизненного цикла клетки. Р53 отвечает за элиминацию канцерогенных клеток и позволяет продлить жизнь органов, предотвращая развитие раковых клеток. Однако, чем больше белка активируется, тем больше он ускоряет процесс старения, приводя к усиленному разрушению клеток и потери гомогенности тканей.
Механизм укорочения теломерных повторов
Способность диплоидных клеток к пролиферации ограничена. Этот процесс регулируется теломерами. Теломеры оказывают защитное действие на ДНК. Теломеры являются той частью хромосомы, которая не содержит генетической информации, и разрушаются на протяжении всей жизни при каждой репликации до тех пор пока полностью не исчезнут. Поскольку ДНК больше не защищена, при репликации важная информация «разжевывается», что приводит к апоптозу клетки или созданию раковой клетки. Фермент теломераза обеспечивает полную репликацию теломер. Он обнаружен только в стволовых, эмбриональных и раковых клетках. Присутствие этого фермента в раковых клетках объясняет, почему они бессмертны: они могут делиться бесконечно, не останавливаясь на своих «биологических часах». Работа этого фермента представляет большой научный интерес, однако, его активация может быть связана с виндукцией злокачественной трансформации.
Сокращение теломер можно сравнить с биологическими часами, которые активируют старение клеток, как только время истекает. Этот механизм ограничивает продолжительность жизни всех клеток, поэтому является центральным.
Эпигенетические механизмы и старение
Эпигенетика занимается изучением механизмов, управляющих экспрессией генома. Экспрессия генов может варьировать в зависимости от факторов окружающей среды. Органы демонстрируют эту изменчивость: каждая клетка имеет сходную генетическую информацию, но разные функции, что показывает разницу в экспрессии генов в зависимости от окружающей среды.
Белки представлены полипептидной цепью, состоящей из последовательности аминокислот. Работают белки благодаря своей конформационной структуре: вторичной, третичной, четвертичной. Складывание белка представляет физический процесс-фолдинг, посредством которого белок становится функционально активным.
Исследования показали, что нарушение процесса фолдинга белка составляет патофизиологическую основу многих возрастных заболеваний различной этиологии, в том числе болезни Альцгеймера, болезнь Паркинсона и прочих.
Последствия нарушения конформационных структур связаны с накоплением агрегатов белков неправильной конформации.
Митохондриальная дисфункция и возраст
Митохондрии — это клеточные органеллы, ответственные за поддержание клеточного дыхания и синтез АТФ — основного источника энергии. Митохондрии обладают собственной ДНК, называемой мтДНК.
Дисфункция митохондрии является основной причиной старения из-за жизненно важной роли митохондрий в клетках. Возрастная дисфункция наблюдается с возрастом, может привести к гибели клетки. Ее причиной служит окислительный стресс, нарушение клеточно-митохондриальной связи.
Клеточное старение происходит, когда возраст клетки увеличивается и ее функция уменьшается. Клетка прекращает делиться и меняет свою активность. Стареющие клетки можно увидеть на всех этапах жизни. С возрастом их число увеличивается в некоторых тканях, вызывая их гетерогенность.
Механизм клеточного старения полезен в молодости. Он защищает организм от пролиферации раковых клеток, но требует эффективной работы иммунной системы для устранения стареющих клеток. При старении эффективность иммунной системы снижается, обновления стволовых клеток происходит реже.
Стволовые клетки — это недифференцированные клетки, которые не принадлежат к какому-либо конкретному органу и поэтому могут генерировать специализированные клетки посредством «клеточной дифференцировки».
Стволовые клетки позволяют обновлять клетки в органе, они хранятся в организме и используются при необходимости.
Некоторые клетки стареют и умирают регулярно и требуют замены. Срок жизни эритроцита в среднем 120 дней. Другие органы могут расти и требовать больше ткани (например, матка во время беременности). Некоторые органы не имеют стволовых клеток и поэтому не могут быть обновлены при повреждении, например, сердце, поджелудочная железа.
При старении ткани также не восстанавливаются из-за замедления деления клеток и отсутствия замены стволовых клеток. Это объясняется избыточной экспрессией белков, блокирующих клеточный цикл, или накоплением повреждений ДНК на стволовых клетках.
Истощение стволовых клеток является одной из основных причин старения, поскольку препятствует обновлению клеток и является причиной старения органов. Понимание работы стволовых клеток будет жизненно важным для регенеративной медицины в будущем.
Вышеуказанные причины потенциально ответственны за изменение функций организма. Некоторые из них лежат в основе полезных механизмов, которые становятся вредными с возрастом, как в случае с клеточным старением и системой репарации ДНК. Механизмы предотвращают развитие рака, но по мере того, как их активность становится слишком высокой, происходит сбой, дегенерация тела ускоряется.
Другими причинами являются простые механизмы, которые медленно развиваются во времени (митохондриальная дисфункция, укорочение теломер). Необходимо понимать их, если мы когда-нибудь захотим поработать над этим, чтобы потенциально замедлить старение, и увеличить продолжительность жизни человека.
Как старение влияет на синтез белка
Как старение влияет на синтез белка
Старая (слева) и молодая (справа) мыши существенно различаются по уровню экспрессии генов, связанных с работой иммунной системы, метаболизмом и способностью организма к восстановлению
Автор
Редактор
В последние годы старение как биологический процесс привлекает все большее внимание молекулярных биологов, которые исследуют, что происходит в стареющем организме на молекулярном уровне. Группа исследователей из НИИ ФХБ имени А.Н. Белозерского, Института молекулярной биологии РАН имени В. А. Энгельгардта и Гарвардской медицинской школы изучила, как в ходе старения изменяются транскрипция и трансляция ряда генов, связанных с работой иммунной системы, метаболизмом и защитой от повреждений, а также описала некоторые любопытные возрастные изменения, затрагивающие динамику трансляции.
Старение как биологический феномен привлекает внимание не только биохакеров, стремящихся максимально увеличить продолжительность жизни, но и молекулярных биологов, занимающихся фундаментальной наукой. И их старания не проходят даром.
Например, сейчас известно, что в ходе жизни организма в его тканях накапливаются неправильно уложенные, окисленные или иным образом модифицированные белки, которые не только не выполняют свою функцию должным образом, но и могут образовывать нерастворимые скопления, нарушающие функционирование целых тканей [1].
Несколько исследований продемонстрировали, что с возрастом в организме в целом снижается интенсивность синтеза белка, уменьшается концентрация факторов инициации и элонгации трансляции, замедляется аминоацилирование тРНК. Сообщается, что в ходе старения происходит интенсивное метилирование промоторов генов рРНК, а концентрация самих рРНК уменьшается [1].
Вместе с тем биологические виды, отличающиеся необычно высокой для своей таксономической группы продолжительностью жизни, как правило, характеризуются очень стабильным протеомом и высокой устойчивостью к окислению белков. Примечательно, что виды, у которых в целом интенсивность синтеза белка понижена, характеризуются повышенной продолжительностью жизни, кроме того, видам-долгожителям вроде голого землекопа [2] часто присущи высокоточный аппарат трансляции и низкий кругооборот белков [1].
Подробнее о существующих теориях старения, влиянии питания на старение и различных аспектах этого любопытнейшего биологического явления читайте в нашем спецпроекте «Старение и долголетие» [5], а также в статьях [6], [7].
О рутинной работе рибосом и их неожиданных функциях читайте в статьях «Рибосома за работой» [8] и «Чего вы не знаете о рибосоме. » [9]. — Ред.
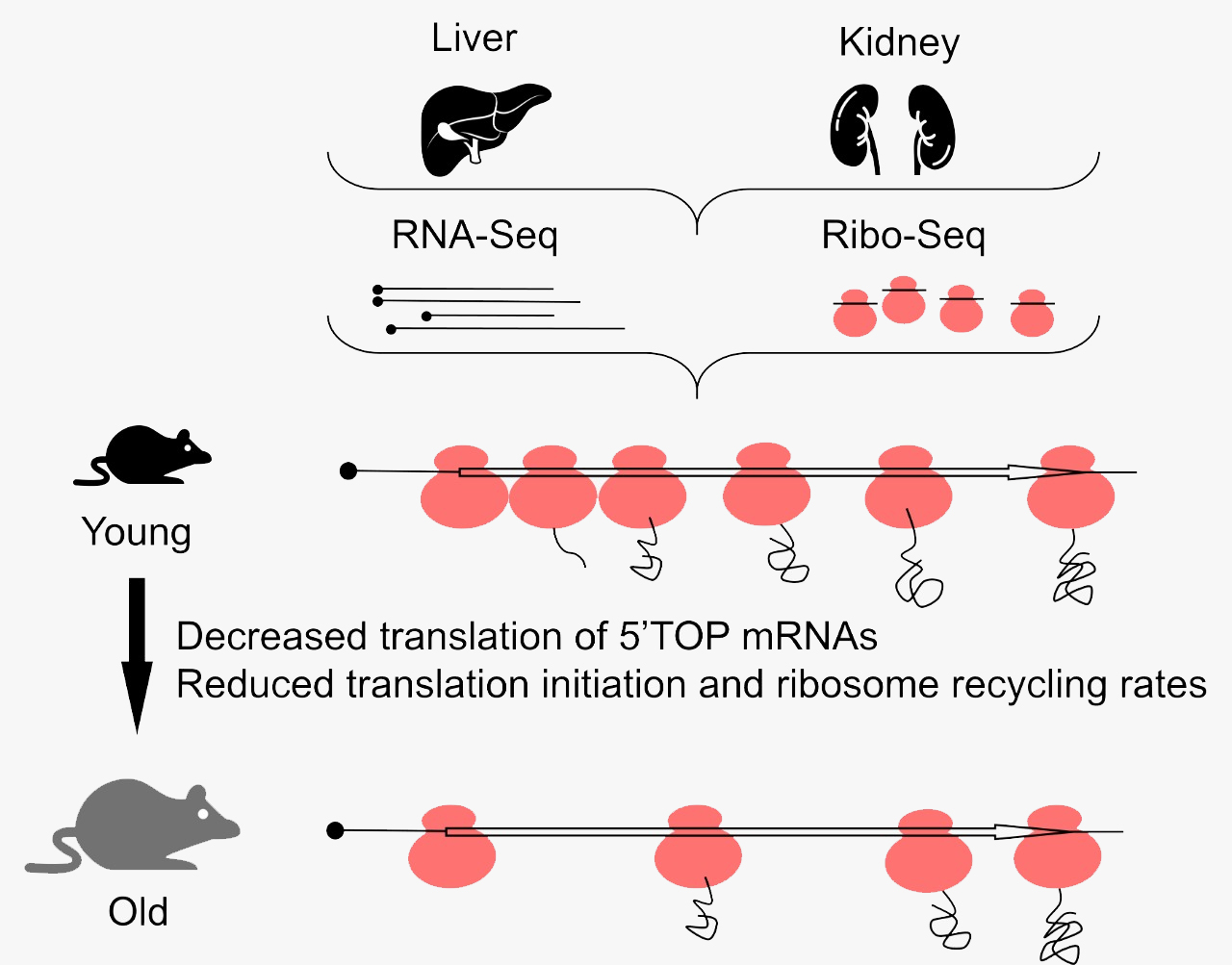
Рисунок 1. Схема исследования, проведенного авторами статьи. Ткани почек и печени, взятые от мышей различных возрастов, были проанализированы с помощью секвенирования РНК и рибосомного профайлинга. Полученные данные позволили оценить, какой вклад вносит трансляция в возрастные изменения экспрессии генов и установить некоторые другие любопытные эффекты, связанные с возрастными изменениями трансляции.
схема выполнена авторами обсуждаемой публикации
Так, по данным экспериментов, в печени и почках мышей с возрастом заметно повышается экспрессия генов, связанных с воспалением и другими иммунными процессами, что соответствует представлениям о развитии хронического воспаления. Сравнив свои данные с результатами более ранних работ на эту тему, авторы смогли выявить четкую и устойчивую возрастную зависимость уровня экспрессии пяти генов, связанных с воспалением и лизосомной деградацией белков (Ctss, C1qa, C1qb, C1qc и Laptm5), так что их можно рассматривать в качестве потенциальных биомаркеров старения.
В отличие от воспалительных процессов, функции митохондрий с возрастом не усиливаются, а угасают. Постепенное возрастное снижение экспрессии некоторых ядерных генов, кодирующих митохондриальные белки, было обнаружено в клетках почек (в клетках печени тоже наблюдалось, но оказалось менее выраженным). Кроме того, синтез компонентов, ответственных за поддержание окислительно-восстановительного баланса, менялся и в печени, и в почках, что хорошо согласуется с широко распространенной теорией о роли окислительного стресса в процессе старения. В то же время в обеих тканях удалось выявить возрастное увеличение экспрессии генов, связанных с регуляцией давления в кровеносных сосудах, а также генов, кодирующих предшественники амилоидов. Также с возрастом в почках снижается синтез белков, связанных с ответом на глюкокортикоидные гормоны, биосинтезом кофакторов и метаболизмом липидов. Примечательно возрастное снижение экспрессии в почках двадцати одного гена компонентов пероксисом, что также согласуется с текущим взглядом на роль возрастных изменений в метаболизме липидов и развитии некоторых заболеваний почек.
О том, как работают митохондрии и какую роль они играют в жизни клетки и целого организма, повествует спецпроект «Биоэнергетика». — Ред.
В общем и целом, большинство возрастных изменений уровня трансляции коррелирует с изменениями уровня транскрипции как в печени, так и в почках, поэтому, вероятнее всего, ключевые изменения экспрессии генов, связанные со старением, происходят именно на уровне транскрипции. Авторы исследования сумели выявить несколько транскрипционных факторов, которые, предположительно, отвечают за возрастные изменения транскрипции. Бóльшая часть генов-мишеней этих факторов задействована в функционировании иммунной системы и воспалении. Многие из транскрипционных факторов, отвечающих за возрастные изменения профилей транскрипции, оказались общими для печени и почек, но среди них есть и тканеспецифичные факторы. В частности, в почках многие транскрипционные факторы, изменяющие профили транскрипции с возрастом, так или иначе связаны с метаболизмом липидов и функционированием пероксисом.
Авторы работы впервые продемонстрировали, что многие гены, экспрессия которых понижается по мере старения организма, связаны с биосинтезом белка, метаболизмом некодирующих РНК и образованием рибосом. В их числе есть гены рибосомных белков, транскрипционных факторов, а также компонентов, задействованных в биогенезе рРНК и рибосом, процессинге некодирующих РНК и других процессах, имеющих ключевое значение для экспрессии генов и ее регуляции. Стоит отметить, что предыдущие исследования, рассматривавшие преимущественно только транскрипционные возрастные изменения, не могли выявить снижение синтеза этих белков, поскольку оно связано с подавлением трансляции, а не транскрипции.
Некодирующие РНК, впрочем, могут кодировать, вопреки своему названию, функциональные пептиды [10]. Примечательно, что длинные некодирующие РНК есть и у бактерий [11], хотя об их функциях известно гораздо меньше, чем о функциях длинных некодирующих РНК эукариот.
Для того чтобы данные по трансляции с определенных мРНК можно было сравнивать не только с аналогичными данными для организма другого возраста, но и с данными по трансляции с других транскриптов, авторы работы использовали специальную нормированную метрику — «занятость» рибосом (RO от англ. ribosome occupancy). Для каждого гена RO вычисляется как количество рибосом, «пойманных» на синтезе его белкового продукта, деленное на общее количество транскриптов гена. Иными словами, RO позволяет понять, насколько интенсивно, по сравнению с другими генами, рибосомы взаимодействуют с мРНК данного гена и синтезируют белок по ее матрице (как правило, чем больше рибосом «сидят» на мРНК гена, тем больше белка с него синтезируется).
Анализ данных рибосомного профайлинга, переведенных в термины RO, показал, что с возрастом и в печени, и в почках увеличивается трансляция с мРНК, связанных с воспалением и дифференцировкой клеток различных типов. В то же время в почках с возрастом заметно снижается экспрессия генов, связанных с образованием и функционированием митохондрий, таких как гены компонентов электрон-транспортной цепи [12]. Примечательно, что трансляция многих ядерных генов, кодирующих белки митохондриального назначения, регулируется сигнальным путем mTOR, причем главную роль в этом процессе играет белок 4E-BP1. Этот же белок отвечает за возрастное снижение экспрессии гена интерферонового регуляторного транскрипционного фактора 7 (Irf7). С возрастом показатель RO для этого гена снижается почти в шесть раз. Стоит отметить, что по мере старения в печени увеличивается синтез субъединиц важнейшего регулятора метаболизма железа — ферритина [13], — трансляция которых зависит от особого железозависимого элемента в 5′-нетранслируемых областях их транскриптов. Вероятно, этот эффект связан с хорошо известными возрастными нарушениями метаболизма и запасания железа, которые зачастую являются последствиями возрастного хронического воспаления. Дело в том, что у грызунов по мере старения в тканях организма накапливается железо, а повышение его концентрации приводит к активации экспрессии гена ферритина и других генов, имеющих железозависимый элемент.
Активная работа mTOR не только поддерживает клеточный цикл и трансляцию белка, но и ухудшает процесс аутофагии [14] — избавления клетки от накопившегося за всю её жизнь «мусора» (дефектных и ненужных молекул). В том числе и поэтому ингибирование mTOR (и, как следствие, интенсификация аутофагии) приводит к увеличению продолжительности жизни модельных животных. — Ред.
Но самый неожиданный и любопытный эффект старения, который выявили авторы работы, состоит в перераспределении рибосом на транскриптах. Оказалось, что с возрастом частота встречаемости рибосом на 5′-концах транскриптов падает и увеличивается на 3′-концах как в печени, так и в почках. Для мышиной печени «точкой невозврата» является возраст 11 месяцев, после которого локализация рибосом становится сильно «перекошенной» в сторону 3′-конца. Особенно выражен эффект смещения рибосом при сравнении образцов тканей от мышей возрастом 11 месяцев и 32 месяца. Наиболее яркий эффект смещения рибосом — вблизи старт- и стоп-кодонов, но его можно пронаблюдать и по всей длине транскрипта.
Один из авторов работы, Сергей Дмитриев, комментирует ее результаты следующим образом: «Наверное, наиболее важным результатом нашей работы с точки зрения понимания механизмов старения является то, что мы показали существенное падение уровня синтеза компонентов трансляционного аппарата в органах стареющих мышей. Интенсивность наработки некоторых рибосомных белков в печени 32-месячных грызунов, например, оказалась в три раза ниже, чем у молодых животных. Причем это снижение происходит именно благодаря регуляции трансляции, поэтому до нас оно не было замечено. То, что белковый синтез у “пожилых” животных идет менее интенсивно, было известно и раньше — но теперь стало понятно, почему это происходит: в клетке просто производится меньше “машин” для биосинтеза белка. Интересный аспект всего этого — что в этой регуляции, по-видимому, замешана протеинкиназа mTOR, которую уже давно “подозревают в связях” со старением. Существуют фармакологические ингибиторы этой киназы (например, рапамицин), которые значимо продлевают жизнь многим модельным организмам. Правда, здесь мы сталкиваемся с парадоксом: с одной стороны, снижение активности белкового синтеза такими лекарствами продлевает жизнь, а с другой — пониженная активность, по нашим данным, характерна как раз для старых животных. Объяснением могло бы быть то, что падение скорости синтеза белка — это не причина старения, а следствие, попытка организма справиться с меняющимися условиями (накоплением в клетке всякого “мусора” и “поломок” — в частности, неправильных белков). Понятно, что когда в квартире не делают уборку, то можно прожить в ней чуточку дольше, если меньше мусорить. Именно это, по-видимому, делает стареющая клетка, и точно так же работают продлевающие жизнь ингибиторы mTOR. К сожалению, эта стратегия лишь отодвигает печальный финал: рано или поздно мусор погребет под собой постояльца. А как провести в клетке “генеральную уборку”, мы пока не придумали».
Белок старения
Найден ключевой механизм старения
Ученые из Центра исследования рака в Германии выявили белок, который играет ключевую роль в процессе старения, определяя продолжительность жизни организма. Статья исследователей опубликована в FEBS Journal (Oberacker et al., Enhanced expression of thioredoxin interacting protein regulates oxidative DNA damage and aging), кратко о научной работе рассказывается в пресс-релизе Key molecule of aging discovered.
Известно, что старение клеток и тканей обусловлено окислительным стрессом, когда при работе митохондрий в цитоплазме увеличивается количество активных форм кислорода (АФК), повреждающих ДНК, белки и липиды. Клетка в таких условиях быстро теряет способность выполнять свои функции и в конце концов умирает. Согласно свободнорадикальной теории старения, предложенной в 1950 году, именно этот процесс является главной причиной старения организма.
Однако АФК также играют сигнальную роль, активируя иммунные клетки Т-лимфоциты, и способствуют уничтожению поврежденных клеток, поэтому их недостаток может привести к таким заболеваниям, как рак. Ученые показали, что окислительно-восстановительный баланс, выражающийся в оптимальном уровне АФК и антиоксидантов, обеспечивается соединением, называемым тиоредоксин-взаимодействующим белком (TXNIP).
Тиоредоксин-1 (TRX-1) обезвреживает избыток АФК, тем самым защищая ДНК от повреждения и замедляя процесс старения. TXNIP ингибирует тиоредоксин, провоцируя накопление свободных радикалов.
Ученые сравнили T-лимфоциты в крови у 55-летних и 20-25-летних добровольцев и выяснили, что клетки более пожилых людей продуцируют больше TXNIP. Это было также характерно для клеток плодовых мух Drosophila. Тогда исследователи вывели насекомых, в организме которых тиоредоксин-взаимодействующие белки синтезируются в больших или меньших, чем в норме, количествах. Те мухи, у которых было много TXNIP, жили в среднем намного меньше, а насекомые с малым количеством белка – дольше.
По словам ученых, достаточно найти способ отключить TXNIP, чтобы значительно увеличить продолжительность жизни людей.
Читать статьи по темам:
Читать также:
Продление жизни: отключите белки трансляционного контроля митохондрий
Подавление синтеза белков трансляционного контроля митохондрий, необходимых для нормального биосинтеза в этих органеллах, приводило к продлению жизни клеток.
Не хотите стареть? Настройте биологические часы!
Возможно, кроме участия в «настройке» биологических часов, ген per управляет механизмом, обеспечивающим восстановление окислительных повреждений. Нарушение его функционирования приводит к ускоренному старению, что может проявляться развитием целого спектра патологических состояний, в том числе нейродегенеративных заболеваний, сердечно-сосудистых болезней и рака.
Ген старения мозга
Ген Bmi1 напрямую управляет процессом деградации нейронов сетчатки глаз и коры головного мозга, воздействуя на механизмы защиты от свободных радикалов.
Возрастное старение иммунной системы (3)
Еще одним влияющим на состояние иммунной системы фактором является воздействие свободных радикалов.
Митохондрии в старении, часть 2
Увеличение продукции новых митохондрий или повышение эффективности их работы могут увеличить продолжительность жизни.
Свободные радикалы и разбитые коленки
Повышенное содержание в эпидермисе свободных радикалов ускоряет заживление травм у молодых животных, однако с возрастом этот эффект меняется на противоположный: клетки кожи перестают делиться, запас стволовых клеток сокращается, а кожа начинает быстро стареть.
Электронное СМИ зарегистрировано 12.03.2009
Свидетельство о регистрации Эл № ФС 77-35618
Гликирование белков — преграда для долголетия
Глюкоза содержится в любой ткани. С процессом гликирования белка мы сталкиваемся часто в повседневной жизни, когда поджариваем что-либо до хрустящей корочки. При воздействии высокой температуры глюкоза вступает в реакцию с белком ткани.
Схожие процессы запекания белков происходят и в организме человека, с той лишь разницей, что протекают они медленнее. Наиболее опасны конечные продукты гликирования для сетчатки глаза и хрусталика, коронарных артерий и почек.
Гликирование вызывает инсулиннезависимый диабет второго типа. Это приводит к высокому содержанию глюкозы в крови, а это в свою очередь к еще большему накоплению конечных продуктов гликирования. Эта взаимосвязь и является основной причиной осложнений, которые дает диабет.
Таким образом, для предотвращения гликирования белка в нашем организме, а следовательно и для замедления старения, нам необходимо устранить причины, ведущие к нарушению функций белков и являющиеся преградой для здоровья и долголетия. Таких причин две.
1. Излишнее потребление быстрых углеводов, продуктов имеющих высокий гликемический индекс.
2. Потребление гликированного белка в пищу. Вся жареная пища, приготовленная нами, содержит гликированный белок.
Особенно опасны в этом плане готовые блюда общепита, в особенности еда в ресторанах, или так называемая «высокая кухня» где основное значение придается внешнему виду подаваемых блюд. Они содержат многократно больше продуктов гликирования, чем пища домашнего приготовления.
Чтобы не разрушать себя изнутри, нужно отказаться от жарки, как способа приготовления пищи. Еда приготовленная при температуре ниже 120 градусов, не ведет к образованию продуктов гликирования.
Получается замкнутый круг. Углеводы нам жизненно необходимы, как источник энергии. А употребление углеводов ведет к старению. Где же выход?
Наука пока не дала окончательного ответа на этот вопрос, но исследования в этом направлении ведутся. Возможно, скоро будет найдено средство, полностью предотвращающее гликирование белков в организме.
Для успешной борьбы со старением следует привести в порядок свой образ питания. Для этого необходимо придерживаться принципов калорийно ограниченного питания, при помощи которого снижается уровень сахара крови, а соответственно снижается и вероятность реакции глюкозы крови с белками тела.
Очень хорошо способствует аутофагии проведение разгрузочных овощных дней 2-4 раза в месяц, когда вы в течение суток пьете воду и едите неограниченно только овощи и никакой другой пищи.
При обычном, традиционном питании основным фактором риска является высокий гликемический индекс продуктов. Избежать высоких концентраций глюкозы в крови можно, употребляя продукты с невысокими значениями гликемического индекса, которые более медленно отдают глюкозу в кровь.

В образе здорового питания должно быть сведено к минимуму или вовсе исключено из рациона питания употребление быстрых углеводов, которые в избытке содержатся в выпечке, конфетах, сладких напитках (сладкий чай, фруктовые соки, сладкая газировка и т.д.
Калорийно ограниченное питание следует строить в основном на употреблении большого количества овощей, бобовых, каш из различных круп, включая в меню не жареные рыбу и морепродукты, мясо птицы и немного нежирного мяса. То есть питание должно строиться в основном на медленных углеводах, полисахаридах, которые медленно без скачков, повышают уровень сахара крови, не усиливая процесс гликирования, а значит и старения, и надолго сохраняя чувство сытости.
Я сам поступаю так и рекомендую всем добавлять в углеводные блюда (например в каши) и в напитки (например в кофе) молотую корицу.
Корица понижает уровень сахара крови и действует по типу препаратов бигуанидов. Научно установлено, что куркума также эффективно снижает образование конечных продуктов гликирования. Две этих специи должны всегда присутствовать в рационе для профилактики старения.