стадия резорбции что это
Резорбция корня
Резорбция корней зубов – это утрата или растворение внутреннего дентина либо внешнего покрытия разветвлений (стоматологического цемента). Впервые такое явление было описано почти двести лет назад и называлось явлением загадочным, особенным. Исчезновение массивов, поглощение корневых тканей окружающими стало научным фактом. Сегодня стоматологи отмечают: данное явление поражает зубной ряд пациентов всех возрастных категорий, не зависит от состояния тканей пародонта, а при игнорировании проблемы происходит потеря зубов.
Причины развития недуга
Резорбция корня зуба развивается как следствие :
В результате действия факторов повреждаются: связка, которая удерживает зуб, и цемент, обеспечивающий целостность корня среди других тканей.
Виды резорбции
В зависимости от причины, которая спровоцировала процесс, врачи называют два вида подобного состояния:
1. Физиологическая резорбция.
Это вариант когда молочные детские зубы меняются на постоянные коренные. Процесс рассасывания корня развивается в здоровых тканях, протекает без особых проблем даже, если зубы были пролечены от кариеса. Костная ткань остается сохранной.
2. Патологическая резорбция корней зубов.
Это осложнение после механических воздействий, реимплантации, патологий зубного нерва, усиленного давления зубов друг на друга, влияния кисты, новообразований, инфекций. В этом случае недуг протекает одновременно с воспалительными процессами. Рентгеновский снимок показывает атрофию костной ткани.
Примеры работ:
Заметили у себя симптомы резорбции корня зуба?
Не затягивайте, запишитесь к нам на консультацию! Пройдите качественную диагностику и лечение!
Типы резорбции
Также выделяют два типа резорбции, каждый из которых без лечения может спровоцировать полную потерю зубов или частичную потерю зубов.
Внутренняя резорбция
Дентин (или цементная оболочка) всасываются в корневой канал, растворяются, исчезают. Начинается воспаление внутри зуба, потом охватывает внешние поверхности. Обычно причиной патологии является травма, ожог (термический, химический), инфицирование. Воспаленные клетки увеличиваются. Структура мягких и твердых тканей изменяется. Симптомы резорбции:
При отсутствии диагностики зуб становится пустой оболочкой. Он повержен кариесу, хрупок – раскалывается при малейших нагрузках. На ранних стадиях выявляется при профилактических осмотрах или как сопутствующий вариант при лечении других зубов.
Внешняя резорбция
Причина – последствие травм, инфекция или быстрая смена положения корней (возможна при установке брекетов). Эмаль также меняет цвет на умеренно-красный или розовый. Развивается в месте соединения с тканями челюсти. Причины:
Явные симптомы отсутствуют. Кровеносные капилляры десны, опоясывающих тканей проникают в зубной корень, меняя оттенок коронки. Обнаружить изменения можно, сделав рентгеновский снимок. Редко диагностируется в начальной стадии, возможна потеря жевательных зубов либо потеря центральных зубов. Врачи отмечают агрессивное течение, быстрое развитие с обширными деструкционными процессами, начинается резорбция костной ткани зуба.
Лечение резорбции корня зуба
Врач выбирает методику в каждом конкретном случае, учитывая сложность, особенности организма пациента. Стоматолог может прибегнуть к очистке каналов, их герметизации. При запущенном процессе, когда наблюдается необратимое рассасывание корней зубов, показано удаление единицы с последующим протезированием или имплантацией.
На ранних стадиях при малых поражениях, хирург удаляет инфицированные участки, выполнив надрез десны.
Если причина новообразование или неправильно растущий соседний зуб, то опухоль убирают хирургическим путем, мешающую или охваченную патологией единицу (выбор делает доктор в зависимости от показаний) в большинстве случаев удаляют.
Как избежать проблем и вовремя их диагностировать
Профилактика подобного состояния условна. Это своевременное лечение кариеса, заболеваний десен. Занятия спортом с применением капы, ежедневная гигиена, прием БАДов, в частности цитрата кальция с витамином D.
Своевременная диагностика возможна только при регулярном проведении профилактических осмотров. Поэтому так важно дважды в год посещать клинику. Теперь это удобно: можно записаться к врачу и попасть к нему без очереди в назначенное время.
Современные подходы к диагностике и лечению остеопороза
Рисунок 1. Микроархитектоника здоровой (слева) и остеопоретической (справа) трабекулярной кости. Методы диагностики остеопороза Денситометрия. Ультразвуковая сонография. Рентгенография. Исследование биохимических маркеров костного метаболи
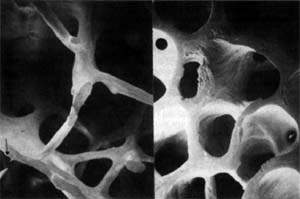 |
| Рисунок 1. Микроархитектоника здоровой (слева) и остеопоретической (справа) трабекулярной кости. |
Методы диагностики остеопороза Денситометрия. Ультразвуковая сонография. Рентгенография. Исследование биохимических маркеров костного метаболизма.
Остеопороз — это системное заболевание скелета, характеризующееся снижением костной массы и нарушением микроархитектоники костной ткани, ведущими к повышенной хрупкости костей с последующим увеличением риска их переломов (рис. 1). Помимо наиболее распространенного постменопаузального остеопороза, в настоящее время в цивилизованных странах в связи с растущей продолжительностью жизни все чаще встречается сенильный остеопороз, а также вторичный остеопороз, обусловленный различными заболеваниями (эндокринная патология, ревматические болезни, заболевания желудочно-кишечного тракта и пр.) или связанный с длительным приемом некоторых лекарственных препаратов, например кортикостероидов.
В настоящее время для диагностики остеопороза используются преимущественно неинвазивные методы, которые легковыполнимы, безопасны и могут повторяться неоднократно у одного и того же больного. К таким методам относятся рентгенографическое исследование, костная денситометрия и исследование биохимических маркеров костного метаболизма. Каждый из этих методов занимает свою нишу в диагностике заболе-вания.
С целью ранней диагностики остеопороза применяются различные технологии, объединенные под общим названием «костная денситометрия», с ее помощью можно определить минимальную плотность костной ткани (МПК), являющуюся главным критерием прочности кости. В настоящее время выделяют четыре типа и два подтипа технологий для измерения МПК:
В данном перечне отсутствует фотонная денситометрия — предшественница рентгеновской денситометрии, в последнее время используемая весьма редко.
 |
| Рисунок 2 |
Системы DXA являются наиболее изученными и широко применяются в клинической практике (рис. 2). DXA позволяет измерять МПК в центральных отделах скелета: в поясничном отделе позвоночника и в проксимальном отделе бедренной кости. В этих участках происходят наиболее тяжелые переломы. Кроме того, многие из этих приборов снабжены программой «все тело», позволяющей определить содержание минералов во всем скелете, а также исследовать мягкие ткани — мышечную и жировую. В новых модификациях приборов DXA имеется возможность латерального сканирования и морфометрического измерения позвонков,что значительно повышает информативность этого метода. Метод DXA также адаптирован для оценки состояния МПК в области периферических участков скелета, в частности в области предплечья и пяточной кости (рис. 3).
Радиографическая абсорбциометрия используется редко, поскольку требует специально оборудованного центра, где при помощи микроденситометра производится сканирование рентгеновских снимков фаланг и определяется их оптическая плотность.
 |
| Рисунок 3 |
Для определения МПК позвоночника можно использовать и QCT, которая является единственным методом, представляющим результаты исследования в трехмерном измерении. Возможность проведения измерений в поперечном сечении, заложенная в QCT, позволяет выделить этот метод среди других, так как он дает возможность дифференцированно оценивать МПК в трабекулярной и кортикальной костной ткани, фиксируя истинные значения МПК в г/см3 [1]. В отличие от DXA при QCT нет искажений МПК, связанных с тучностью пациента, а также вызванных сопутствующей патологией, например спондилоартритом и остеофитами, обызвествлением стенки аорты или участками остеосклероза, развивающимися в результате дегенеративных заболеваний или переломов позвонков. Но большие дозы облучения при QCT, а также высокая стоимость обследования ограничивают широкое применение этой технологии в диагностике остеопороза, использование ее оправданно лишь в ситуациях, требующих дифференциальной диагностики (рис. 4).
 |
| Рисунок 4 |
В последние годы активно развивается ультразвуковая сонография, которая, в отличие от рентгеновской денситометрии, позволяет обследовать другие характеристики костной ткани: SOS — скорость распространения ультразвука в кости и BUA — широковолновое рассеивание (затухание) ультразвуковой волны в исследуемом участке скелета. Эти параметры, по данным многих исследователей, отражают степень эластичности и прочности костной ткани и достаточно высоко коррелируют с МПК позвоночника и шейки бедра [2]. В настоящее время многие специалисты высказывают мнение о том, что с помощью ультразвуковой денситометрии можно предсказывать риск переломов, тем самым обосновывая ее значение как метода для скрининга. Вопрос о возможности применения этих приборов в диагностике остеопороза и оценке эффективности терапии продолжает дискутироваться.
Рентгенография довольно активно используется для диагностики остеопороза и его осложнений. Однако ее нельзя отнести к методам ранней диагностики, поскольку рентгенологические признаки остеопороза появляются тогда, когда 20 — 30% костной массы уже потеряно [3]. Наиболее сложно оценить выраженность остеопороза в позвоночнике, поскольку ни один из его рентгенологических признаков не является специфичным. Часто рентгенография позволяет выявить остеопороз лишь на поздней стадии, когда уже имеются остеопоретические переломы. Для объективной оценки степени снижения минерализации костей разработаны так называемые полуколичественные методы. В основе их лежит вычисление вертебральных, феморальных и метакарпальных индексов. Но они также не могут претендовать на достаточную точность и чувствительность при выявлении ранней стадии заболевания (остеопении), хотя успешно применяются при эпидемиологических исследованиях распространенности остеопороза в популяции [4, 5]. Таким образом, основной функцией ренгенографического метода в диагностике остеопороза является обнаружение переломов, динамическое наблюдение за появлением новых переломов и дифференциальная диагностика остеопоретических переломов от других типов деформаций позвоночника.
С помощью методов «костной денситометрии» можно судить об основных параметрах прочности костной ткани, однако эти методы не дают никакой информации об уровне костного метаболизма. Уровень формирования и резорбции костной ткани может быть оценен несколькими способами: путем измерения ферментной активности костных клеток (остеобластов и остеокластов) или определения продуктов деградации костного матрикса, которые высвобождаются в циркуляцию в процессе костного обмена (табл. 1).
Таблица 1. Биохимические маркеры костного метаболизма
маркеры
мочи
Представленные в таблице костные маркеры являются предикторами потери костной массы, переломов костей скелета и используются для мониторинга антиостеопоретической терапии. По этим биохимическим показателям можно судить об эффективности терапии, об адекватности дозы препарата и о его переносимости. Особенно полезны костные маркеры для оценки эффективности терапии в сравнительно короткие промежутки времени, когда денситометрическое исследование еще не информативно (полагают, что повторные денситометрические исследования надо выполнять не чаще одного раза в год). Уровень маркеров костного метаболизма изучался в основном у женщин постменопаузального периода. Оказалось, что уровень почти всех маркеров, за исключением IPCP, повышен и коррелирует со снижением МПК [6]. Полагают, что сочетание денситометрии и исследования биохимических маркеров костного метаболизма позволит получить более полную информацию о риске развития постменопаузального остеопороза. По мнению P. Delmas (1996) увеличение скорости костной резорбции (по оценке уровней биохимических маркеров) существенно повышает риск развития переломов независимо от исходной костной массы пациентов [7]. Это связано с тем, что хрупкость кости при остеопорозе зависит не только от МПК, но и от нарушения микроархитектоники костной ткани, выраженность которой можно оценить с помощью биохимических маркеров костной резорбции. Это предположение подтверждается данными P. Garnero et al. (1996), полученными в рамках исследования EPIDOS [6]. Доказано, что увеличение уровня СТх или свободного диоксипиридинолина на 1SD от нормы ассоциировалось с 1,3- и 1,4-кратным увеличением риска переломов шейки бедра (рис. 5).
 |
| Рисунок 5. Комбинированная оценка МПК и скрытой костной резорбции для определения риска перелома шейки бедра у пожилых. МПК определялась по критериям ВОЗ с учетом показателей ниже 2,5 SD от нормальных показателей МПК у молодых здоровых женщин (Ts core |
При этом снижение МПК шейки бедра и увеличение маркеров костной резорбции, независимо друг от друга, связаны с высоким риском переломов шейки бедра. Для оценки эффективности проводимой терапии рекомендуется исследовать биохимические маркеры через каждые три месяца после начала лечения. При исследовании биохимических маркеров необходимо принимать во внимание факторы, влияющие на воспроизводимость результатов: диета, условия хранения материала, биологические факторы (циркадные и сезонные колебания, менструальный цикл, возраст, пол, наличие сопутствующих заболеваний и т. д.).
Многолетний опыт изучения остеопороза за рубежом показывает, что ни один из существующих в настоящее время лекарственных препаратов не может надежно восстановить количество и качество кости, поэтому основной мерой в борьбе с этим заболеванием является профилактика. Профилактику остеопороза надо начинать рано и уделять особое внимание средовым факторам, влияющим на достижение пика костной массы, который наступает примерно к тридцати годам. В числе этих факторов — питание и физическая активность, адекватное поступление в организм витамина D и инсоляция. К наиболее важным периодам относятся период роста кости (юношество), беременность, лактация и перименопауза. Пик костной массы может быть значительно улучшен за счет включения в рацион продуктов с повышенным содержанием кальция (прежде всего молочные и рыбные продукты). Суточное потребление кальция должно составлять в среднем 1000 — 1500 мг, предпочтительно с пищей. Регулярные физические упражнения с весовой нагрузкой в период роста кости приводят к увеличению пика костной массы. У взрослых после достижения пика костной массы адекватное потребление кальция, постоянная физическая нагрузка и наличие регулярного менструального цикла также способствует сохранению костной массы. Профилактику остеопороза среди взрослого населения нужно проводить в «группах риска».
Проблема лечения остеопороза за рубежом изучается давно, причем особенно активно в последнее десятилетие, что связано с введением денситометрии. Однако до настоящего времени не разработаны общепринятые терапевтические программы и режимы лечения этого заболевания, что, по-видимому объясняется его многофакторной природой и сложным патогенезом. Основная цель лечебных мероприятий — сбалансирование процессов костного метаболизма и сохранение или улучшение качества жизни пациента. Для этого необходимо добиться замедления или прекращения потери костной массы; уменьшить болевой синдром в позвоночнике и периферических костях; улучшить функциональное состояние больного и предотвратить возможные падения; восстановить трудоспособность и психоэмоциональное состояние. Наряду с этиопатогенетической терапией препаратами, направленными на нормализацию процессов ремоделирования костной ткани и на сохранение минерального гомеостаза, применяется и симптоматическая терапия, включающая в себя диету с повышенным содержанием солей кальция и фосфора, нестероидные противовоспалительные средства, анальгетики, миорелаксанты, которые позволяют уменьшить болевой синдром, мышечное напряжение и тем самым расширить двигательную активность пациента и ускорить начало реабилитационных мероприятий.
Реабилитация подразумевает лечебную физкультуру, ношение корсетов, плавание, курсы легкого массажа.
Все препараты для лечения остеопороза можно разделить на три группы:
В этиопатогенетической терапии остеопороза предпочтение отдается группе препаратов, подавляющих резорбцию костной ткани, вследствие их более высокой эффективности и сравнительно небольшого побочного действия.
В целом терапия остеопороза должна быть комплексной и проводить ее следует длительно в виде непрерывного или курсового лечения. Поскольку в настоящее время нет идеального препарата для лечения остеопороза, перспективна комбинированная терапия, в которой сочетаются препараты с различным механизмом действия, что позволяет потенцировать их антиостеопоретическое действие, снизить частоту и выраженность побочных эффектов.
| Профилактика остеопороза заключается в сбалансированном питании, физической активности, и адекватном поступлении в организм витамина D |
При комбинированной терапии лекарственные средства назначают одновременно или последовательно. Их выбор осуществляется индивидуально для каждого больного в зависимости от формы остеопороза, скорости костного обмена, тяжести клинического течения, сопутствующих заболеваний. Основным критерием эффективности любого антиостеопоретического средства является снижение частоты переломов, однако в каждом конкретном случае надо ориентироваться в первую очередь на показатели МПК по данным костной денситометрии и на биохимические маркеры костного обмена. Увеличение МПК более чем на 1% и нормализация биохимических показателей, если они были изменены, свидетельствуют об эффективности проводимой терапии. Учитываться должна и положительная динамика клинической картины: уменьшение болевого синдрома, повышение функциональной активности.
Таким образом, в настоящее время имеется довольно большой выбор диагностических методов, позволяющих установить диагноз остеопороза на разных стадиях, а также эффективных лекарственных препаратов, влияющих на различные звенья патогенеза остеопороза, способных уменьшить или купировать клинически выраженные симптомы заболевания, а также предупредить развитие переломов.
Механическая резорбция грыжи
Грыжи межпозвоночных дисков являются одним из самых распространенных заболеваний, с которым рискует столкнуться практически каждый человек. При этом их нельзя назвать безобидными, поскольку они способны привести к развитию тяжелых осложнений вплоть до паралича и инвалидности. Кроме того, межпозвонковые грыжи существенно снижают качество жизни, так как вызывают сильный болевой синдром и нарушения чувствительности различных частей тела, что способно полностью лишить человека работоспособности и радости жизни. Поэтому, когда диагноз поставлен и наличие грыжи не вызывает сомнений, требуется как можно раньше начать лечение, чтобы избежать неприятных последствий заболевания.
Варианты лечения
Межпозвоночные диски призваны защищать позвонки при ходьбе и других нагрузках. Они представляют собой своеобразную плоскую капсулу, внутри которой находится гелеобразное пульпозное ядро. Роль наружной оболочки выполняет фиброзное кольцо, а сверху и снизу межпозвоночный диск защищают замыкательные пластинки.
С течением лет они изнашиваются и обезвоживаются, а процессы регенерации в виду диффузного способа питания замедляются (межпозвоночные диски не имеют собственных кровеносных сосудов). В результате развивается остеохондроз. На фоне прогрессирующих дегенеративных изменений фиброзное кольцо становится неспособным выдерживать приходящиеся на него нагрузки и деформируется. Как следствие диск выпячивается, т. е. формируется протрузия, а затем и грыжа. Подобные выпячивания диска могут сдавливать проходящие в непосредственной близости от него нервные корешки. Результатом этого станет иррадиация болей из спины в ноги, руки или нарушение иннервации внутренних органов, что станет причиной развития органических изменений в них.
В зависимости от размера, особенностей самочувствия пациента, опасности грыжи с точки зрения возникновения тяжелых неврологических нарушений существует 2 основных метода лечения: консервативное и хирургическое. Хотя операция позволяет радикально решить проблему за максимально короткое время, многие больные не спешат лечь на стол нейрохирурга, опасаясь возможных рисков, и стараются улучшить свое состояние с помощью консервативных методик.
Безоперационное лечение межпозвоночной грыжи подразумевает:
Оно назначается не менее чем на 3 месяца, а часто и на значительно больший период времени. При этом не одни врач не способен дать 100% гарантии, что консервативное лечение принесет заметный эффект и поможет пациенту действительно избавиться от болей и неврологических нарушений, а не на время заглушить их лекарствами. Поэтому нередки случаи, когда при выполнении контрольных МРТ для оценки результативности консервативной терапии какие-либо существенные изменения в состоянии межпозвоночного диска отсутствуют или вовсе наблюдаются признаки ухудшения ситуации.
На фоне консервативной терапии грыжи могут увеличиваться в размерах, что в конечном итоге потребует проведения сложного хирургического вмешательства, тогда как на ранних сроках развития заболевания с ним можно было легко справиться малоинвазивными или чрескожными методами.
При этом общая стоимость, в которую выливается консервативное лечение межпозвоночной грыжи, может достигать колоссальной величины. Нельзя забывать и про существенную потерю времени на проведение всех процедур и трудозатраты больного, что на фоне отсутствия гарантий получения желаемого результата лечения дает не слишком хорошие перспективы.
Подобное положение дел не устраивает ни врачей, ни пациентов, что потребовало разработки нового подхода к лечению межпозвоночных грыж, такого, чтобы оно было максимально безопасным для больного и при этом позволяло быстро устранить патологическое выпячивание диска. Результатом стало создание метода механической резорбции грыжи.
Что такое механическая резорбция грыжи
Механической резорбцией межпозвоночной грыжи называют частичное или полное уменьшение ее размеров вплоть до полного исчезновения без проведения открытой операции. Метод предполагает растворение выпавшей части диска, благодаря чему и получил свое название. Он лишен основных недостатков консервативной терапии и открытых хирургических вмешательств, но при этом отличается высокой эффективностью, что подтверждается проведенными исследованиями и большим количеством выздоровевших пациентов.
В основе метода лежит воздействие изотонической жидкости на межпозвоночный диск, благодаря чему происходит уменьшение его выпячивания и устранение давления на нервные корешки. Механическая резорбция грыжи является последним изобретением в лечении межпозвоночных дисков, пораженных дегенеративными изменениями. Она успешно применяется на практике с 2007 года и за прошедшие годы сумела доказать свою высокую эффективность и огромные преимущества перед другими методами лечения грыж.
Суть механической резорбции грыжи заключается во введении в пораженный диск тончайшего канюлированного зонда, диаметр которого составляет около 3 мм, под контролем электронно-оптического преобразователя (ЭОП). Через него пульсацией подается под высоким давлением физиологический раствор с антибиотиком, благодаря чему удается разбить на мельчайшие фрагменты необходимую часть пульпозного ядра. Растворенная масса через аспирационный канал введенного зонда удаляется и выводится наружу, благодаря чему внутри диска снижается давление, что приводит к обратному втягиванию грыжи или существенному уменьшению ею размеров. Также это приводит к устранению компрессии нервных корешков и болей. Таким образом, одна простая, высоко безопасная процедура способна полностью решить проблему межпозвоночной грыжи и полностью избавить пациента от болей и других симптомов, которые ранее провоцировало наличие грыжи.
Как уже говорилось, для проведения механической резорбции грыжи применяется специальный канюлированный зонд. Он имеет 2 разных по диаметру канала. Узкий предназначен для подачи жидкости в межпозвоночный диск, а более широкий – для аспирации растворенного материала.
Поскольку общий диаметр инструмента составляет менее 4 мм, механическая резорбция грыжи выполняется через тонкий прокол, что не наносит существенного вреда мягким тканям. Поэтому процесс восстановления протекает легко, быстро и практически незаметно для самого больного. Процедура не предполагает выполнения разрезов, как, например, при классической операции по удалению межпозвоночной грыжи – микродискэктомии. Поэтому она считается максимально щадящей.
Но при этом механическая резорбция грыжи позволяет эффективно вывести из диска свободные или находящиеся на гране отделения хрящевые частицы и тем самым оказать декомпрессирующее действие. Процедура позволяет удалять части пульпозного ядра не только в центре диска, но и непосредственно у фиброзного кольца, где и происходит его деформирование.
Механическая резорбция дает возможность удалить не более 15% пульпозного ядра, чего в большинстве случаев достаточно для уменьшения или полного устранения межпозвоночной грыжи.
Она может применяться для лечения поясничных и пояснично-крестцовых дисков, т. е. именно тех, которые в подавляющем большинстве случаев страдают от остеохондроза и его осложнений в виде протрузий и грыж. Механическая резорбция может проводиться в амбулаторных условиях (без госпитализации) под местной анестезией и занимает в среднем 20 минут. Больными процедура переносится легко и без осложнений, а ее эффективность достигает 88—90%. Вставать и ходить можно через полчаса после завершения манипуляции. Если человека ничего не беспокоит и он чувствует в себе достаточно сил, ему разрешается в тот же день вернуться не только домой, но и к привычному для себя образу жизни.

Уже сразу же после окончания манипуляции пациенты ощущают улучшение состояния и уменьшение выраженности болевых ощущений. Поскольку обратное втягивание грыжи не является мгновенным процессом, эффект нарастает постепенно и достигает максимума к 4-й неделе.
Преимущества и недостатки
Процедура имеет множество преимуществ, как перед традиционными консервативными методами лечения межпозвонковых грыж, так и хирургическими. Кроме того, по мнению многих специалистов, после проведения механической резорбции грыжи рецидивы наблюдаются значительно реже, чем при использовании других методов. Врачи утверждают, что благодаря воздействию на диск изнутри, риск повторной его деформации существенно снижается.
Кроме того, метод отличается:
Несмотря на то, что процедура имеет огромное множество неоспоримых преимуществ, ставящих ее по степени безопасности практически в один ряд с консервативным лечением межпозвоночных грыж и, а по эффективности – с классической операцией на позвоночнике, она имеет один существенный недостаток: невозможность проведения механической резорбции грыжи, если ее размеры превысили 6 мм.
Показания и противопоказания
Уже стало очевидно, что этот метод лечения межпозвоночной грыжи подходит не всем. Он может быть использован только для устранения протрузий и межпозвонковых грыж с размерами менее 7 мм. Он показан для устранения хронической корешковой или дискогенной боли, возникающей на фоне образования небольшой протрузии на фоне неэффективности консервативного лечения на протяжении 4—6 недель.
Механическая резорбция грыжи имеет и ряд ограничений. Ее не рекомендуется выполнять при:
Пожилой возраст больного не является противопоказанием для применения метода, но требует более тщательного обследования.
Особенности проведения
Процедура не относится к числу экстренных, что позволяет качественно подготовиться к ней как больному, так и врачу. С этой целью пациент проходит комплексное обследование и при необходимости повторно делает МРТ пораженного отдела позвоночника. Это позволяет исключить все возможные противопоказания, а врач может точно определить вид имеющейся грыжи, т. е. ее локализацию, а также размеры, что позволит точно спланировать ход механической резорбции и исключить риск травмирования важных анатомических структур.
Если результаты всех обследований в норме, пациенту назначается день, в который он должен явиться в клинику. Его проводят в стерильное помещение и помогают расположиться на столе на животе. Во избежание совершения движений, способных нарушить ход процедуры пациента могут фиксировать специальными ремнями. После этого ткани в проекции пораженного диска обезболивают с использованием местной анестезии.
Непосредственно суть механической резорбции грыжи заключается в следующем:
Для проведения механической резорбции грыжи используются одноразовые проводники.
Таким образом, процедура не требует наложения швов, так как небольшой прокол заживает самостоятельно, не оставляя по себе ни малейшего следа. Обязательным условием после проведения механической резорбции грыжи является необходимость оставаться на операционном столе в неподвижном состоянии не менее 2 часов. Затем медперсонал освобождает пациента и помогает ему подняться.
Двигаться после этого можно сразу же. Обычно пациенты хорошо себя чувствуют и могут абсолютно самостоятельно пройти в кабинет врача для получения дальнейших рекомендаций, а затем и отравиться домой.
Реабилитация и востановление
После механической резорбции грыжи можно сразу же возвращаться к обычному образу жизни, но, если есть возможность, лучше обеспечить покой организму на 2—3 дня. Процедура не связана с существенными ограничениями, но чтобы она дала максимальный результат, стоит точно соблюдать полученные от врача рекомендации.
После механической резорбции грыжи можно сидеть и ездить в автомобиле, но наклонов и подъема предметов с весом более 5 кг лучше избегать в течение нескольких недель. Поэтому и занятия в тренажерном зале лучше отложить на это время.
Чтобы избежать развития воспаления или устранить незначительную боль в месте выполнения прокола, пациентам назначаются препараты группы НПВС.
Таким образом, механическую резорбцию можно считать наиболее прогрессивным методом лечения межпозвонковых грыж. Она отличается приемлемой стоимостью, быстротой проведения и получения эффекта, высоким уровнем безопасности, высокой эффективностью и другими преимуществами, что позволяет расценивать ее в качестве выгодной альтернативы не только открытой операции, но и консервативной терапии. Именно поэтому многие пациенты сделали выбор между многомесячными процедурами, болезненными инъекциями, приемом лекарственных средств, часто имеющих большое количество побочных эффектов, и процедурой, позволяющей без рисков вылечить грыжу за 1 день именно в пользу последней. Но если выбор сделан в пользу механической резорбции грыжи, долго медлить нельзя, так как метод не является панацеей и может применяться только при наличии грыж до 7 мм.








