спинраза лекарство что говорят мировые ученые и доктора
Применение Нусинерсен (Спинраза) у взрослых пациентов со СМА
Главная » Лекарства и исследования » Применение Нусинерсен (Спинраза) у взрослых пациентов со СМА
В марте 2020 года в научном журнале The Lancet Neurology была опубликована статья «Применение Нусинерсена для лечения взрослых с проксимальной (5q) спинальной мышечной атрофией: наблюдательное, многоцентровое исследование» (авторский коллектив Hagenacker T, et al). В статье представлены результаты независимого исследования реальной практики применения препарата Нусинерсен (торговое наименование – Спинраза) у подростков и взрослых со СМА в 10 клинических центрах Германии.
Описанные результаты наблюдения за эффективностью и безопасностью применения Спинраза показали значительные клинически значимые улучшения моторной функции у взрослых больных СМА, получавших лечение. Эта публикация вносит значительный вклад в понимание значимости терапии у взрослых пациентов, данные о применении терапии у которых ранее были крайне ограничены. На сегодняшний момент – эта публикация содержит результаты наблюдения за самой большой на сегодня когортой взрослых больных со СМА, получавших лечение и вносит значительный вклад в свидетельства, поддерживающие применение терапии Спинраза для взрослых пациентов.
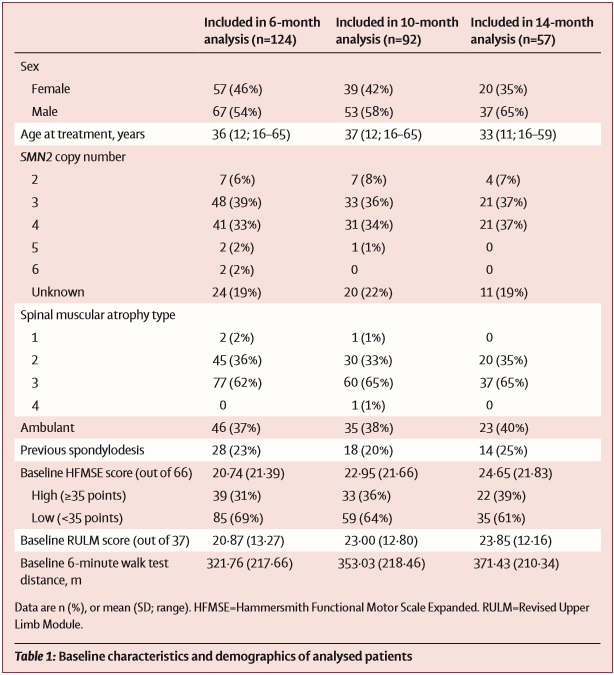
Исследование содержит данные от 124 взрослых больных СМА (в основном, 2 и 3 типов), получавших лечение в 10 нервно-мышечных центрах Германии и основано на оценке двигательных функций с помощью нескольких шкал: Хаммерсмит (HFMSE), RULM и 6-минутного теста ходьбы (6MWT).
Учитывая факт медленного функционального ухудшения состояния у взрослых пациентов со СМА при естественном течение заболевания (без лечения), полученные данные позволяют говорить о том, что лечение взрослых больных со СМА с помощью нусинерсен позволяет достичь значимых клинически улучшений двигательной функции или стабилизации состояния взрослых больных СМА. При этом, не выявлено зависимости и взаимосвязи возраста пациентов и эффективности терапии.
Описание исследования
Несмотря на одобрение применения нусинерсена (Спинраза) для всех групп пациентов, независимо от возраста и типа заболевания большинством регуляторов, однако, данные по эффективности и безопасности применения препарата у взрослых больных со СМА оставались фрагментарными. Единственное ранее опубликованное исследование описывает применение Спинраза у 19 взрослых пациентов со СМА 3 типа и описывает значительное улучшение моторной функции после 300 дней применения нусинерсен.
Исследовательский коллектив поставил целью выяснить безопасность и эффективность применения Спинраза у широкой и разнородной группы взрослых пациентов со СМА. Для этого в наблюдательное исследование были включены 10 нервно-мышечных центров Германии, в которых проходили лечение пациенты от 16 до 65 лет с генетически подтвержденным диагнозом СМА в период с 13 июля 2017 года до 1 мая 2019 года. Все взрослые пациенты, которые получали лечение в этих 10 центрах были включены в исследование. Для оценки результата лечения влючались только пациенты, получавшие лечение в течение, как минимум, 6 месяцев с продолжением наблюдения вплоть до 14 месяцев на терапии.
173 пациента были скринированы для участия в исследовании, из которых 139 (80%) подошли для анализа данных. Из них, 124 пациента (89%) были включены в срез данных 6 месячного интервала получения терапии, 92 пациента (66%) – 10-месячного, и 57 (41%) в 14-месячный анализ. Из анализа были исключены пациенты, для которых отсутствовали данные оценок по шкалам при начале терапии, а также в связи с отказом пациентов от участия (2 человека) и в связи с возникшими побочными реакциями на фоне приема препарата (отказ от продолжения лечения – 2 человека).
Основные результаты:
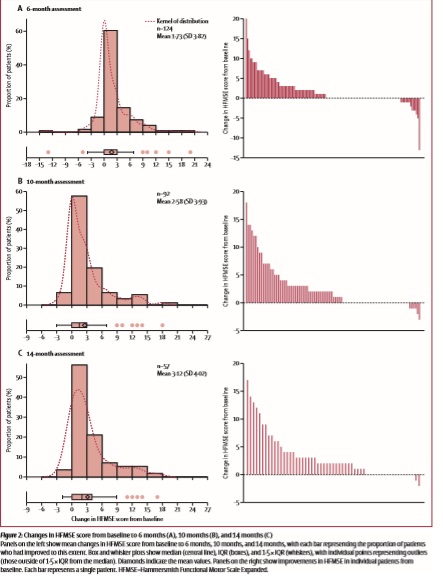
Основным инструментом оценки была шкала Хаммерсмит (HFMSE), которая состоит из 33 пунктов оценки моторной функции для оценки повседневной активности. По каждому пункту может быть выставлено от 0 до 2 баллов, таким образом, максимальный балл по данной шкале – 66. Уровень в 3 балла по данной шкале считается клинически значимым.
Средние оценки по шкале Хаммерсмит (HFMSE) значительно повысились по сравнению с оценками перед началом терапии, средняя разница в 6-месячный анализ данных составила 1.73 балла, в 10-месячный – 2.58 балла, в 14-месячный – 3.2 балла.
Клинически значимые улучшения моторной функции (по данной шкале служит отметка в более чем 3 балла) наблюдались у 35 (28%) из 124 пациентов через 6 мес после начала лечения, у 33 (35%) из 92 пациентов через 10 мес после начала лечения, и у 23 (40%) из 57 пациентов через 14 мес после начала лечения.
За исключением 2 пациентов, все пациенты, у который отмечались улучшения более чем в 3 балла по HFMSE к 10 мес с начала лечения – сохранили набранные баллы и к 14-месяцам и далее. У 5 пациентов было установлено улучшение в более чем 10 баллов (3 ходящих и 2 неходячих пациентов со СМА 3 типа с 3 или 4 копиями SMN2, возраст пациентов от 48 до 59 лет). 14 пациентов не смогли показать улучшений на терапии, продолжая ухудшаться. При этом, при анализе не было установлено никакой зависимости от улучшений оценки по HFMSE и возрастом пациентов.
Дополнительно оценивалась функция верхних конечностей по шкале RULM, которая включает 20 разделов, максимально возможное количество баллов по этой шкале – 37, при этом уровень в 2 балла по данной шкале считается клинически значимым.
Функция рук также значительно улучшалась по сравнению с состоянием до начала терапии. Так, у 28 (23%) из 120 пациентов через 6 мес после начала лечения отмечено улучшение функции по шкале RULM как минимум на 2 балла (т.е. клинически значимо), в то время как у 74 (61%) пациентов не отмечено улучшений, у 18 (15%) пациентов отмечалось ухудшение на 1 балл или более, а у 10 (8%) пациентов ухудшение составило 2 балла или более. 28 (23%) пациентов сохранили полную функциональность (37 из 37 возможных баллов на протяжении 6 мес после начала лечения. 21 (75%) пациент из 28 сохранили полную функциональность к 14-месячной отметке после начала терапии. При этом, при анализе не было установлено никакой зависимости от улучшений оценки по RULM и возрастом пациентов.
Также производилась оценка (у ходящих пациентов) по 6-минутному тесту ходьбы (измерение дистанции, которую пациент может преодолеть за 6 минут). Значительные улучшения были установлены у пациентов при анализе после 6-ти, 10-ти и 14-ти мес после начала терапии.
Помимо общего анализа был также проведен дополнительный анализ в разных субгруппах пациентов.
Так, при сравнении групп взрослых пациентов со СМА 2 и СМА 3 типов:
— клинически значимые улучшение по шкале HMFSE (более 3 баллов) были установлены:
у 23 (30%) пациентов из 77 после 6 мес. после начала лечения; 18 (32%) из 60 пациентов после 10 мес.; 15 (41%) из 37 пациентов после 14 мес. лечения в группе больных со СМА3 типа.
У 1 (2%) из 45 пациентов после 6 мес. после начала лечения; 2 (7%) из 30 пациентов после 10 мес.; 1 (5%) из 20 пациентов после 14 мес. лечения в группе больных со СМА2 типа.
— клинически значимые улучшения функции рук по шкале RULM были отмечены на всех трех анализируемых интервалах у пациентов со СМА2 типа, а у пациентов со СМА3 типа только после 14-мес периода наблюдения.
При сравнении групп взрослых пациентов из подгруппы неамбулаторных (неходячих) и амбулаторных (ходячих) улучшения были отмечены во всех временных интервалах у обоих групп, при этом более значительные изменения уровня моторной функции наблюдались в группе ходячих по сравнению с неходячими пациентами.
При сравнении между группами пациентов имеющих перед началом терапии высокий балл по HMFSE (более 35) и низкий балл (ниже 35) было отмечено, что улучшения у пациентов с более высокими изначально баллами были значительнее.
При сравнении групп пациентов с неоперированным позвоночником (96 пациентов) и пациентов с металлоконструкцией в позвоночнике(28 пациентов) – не было отмечено значительного различия в улучшениях баллов по HMFSE. Но при этом отмечается, что эффект от лечения нусинерсен у пациентов с металлоконструкцией был несколько ниже, что, вероятно, связано с предшествующей тяжестью состояния и выражается в более низких баллах HMFSE у таких пациентов до начала терапии.
Безопасность
За 14-месячный период наблюдения не было отмечено каких-либо новых, не выявленных ранее побочных эффектов. При этом, у 82 (47%) пациентов отмечались какие-либо побочные реакции. Наиболее частые побочные реакции на лечение: головные боли у 61 (35%) пациентов, боли в спине 38 (22%) пациентов и тошноту у 19 (11%) пациентов, другие встречались более редко.
Выводы исследования:
Данные, полученные в результате этого исследования показывают значительное улучшение двигательной функции у взрослых пациентов со СМА после начала терапии через 6,10 и 14 мес. После начала терапии. Наибольшее улучшение моторной функции коррелирует с меньшей тяжестью состояния пациента до начала терапии.
В целом, пропорция пациетов со значимым улучшением по шкале HMFSE в группе взрослых пациентов со СМА 3 типа, чем в группе СМА2, но не было установлено никакой корреляции между возрастом пациента и уровнем улучшения моторной функции (т.е. не зависит от времени, прошедшего с момента начала заболевания). А также данные указывают, что более высокий результат показывают пациенты с более чем 35 баллами по HMFSE до начала терапии.
Данные естественного течения заболевания свидетельствуют о том, что взрослые со СМА в среднем ежегодно теряют 0,5-1 балл HMFSE. Конечно, с учетом индивидуальных особенностей пациентов, фазы клинических ухудшений сменяются периодами стабилизации, поэтому эта оценка потери функции – усредненная. Тем не менее, учитывая эти факты, результаты полученные в данном исследовании, подтверждают значительный эффект от терапии нусинерсен у взрослых пациентов.
В части безопасности, не было выявлено никаких не описанных ранее осложнений. Примерно у пятой части пациентов возникали боль в спине и пост-пункционные головные боли, это количество совпадает с общим процентом осложнений при проведении люмбальной пункции (8-25%) в целом.
В исследовании не оценивалось влияние терапии на функцию глотания и дыхания, это потребует дополнительных исследований в будущем. Также дополнительных исследований потребует получение данных наблюдения за долгосрочной эффективностью применением нусинерсен, а также индивидуальых схем применения нусинерсен с учетом режима дозирования и перерывов в лечении.
Данный материал носит исключительно информационный характер и не может служить рекламой препарата. Рекомендации относительно индивидуального применения лекарственного препарата следует получать у вашего лечащего врача.
Источник: The Lancet
Чем нас лечат: Спинраза. Против СМА и смысла
Ron Medvescek/Arizona Daily/magicmine/Getty Images/Indicator.Ru
В России впервые зарегистрирован препарат от спинальной мышечной атрофии — Спинраза. Раньше лечить это редкое неврологическое заболевание у нас было нечем: можно было либо получить инъекции за границей, либо ввезти и применить «по жизненным показаниям», если удастся пройти сложную процедуру оформления. Но и сейчас стоимость лекарства достигает заоблачных высот, «превосходя даже самые смелые ожидания» западных экспертов: в США за одну инъекцию платят 125 тыс. долларов. При этом в первый год лечения их потребуется шесть, а затем их придется колоть на протяжении всей жизни. В России предельная отпускная цена не зарегистрирована, а на сайте госзакупок такой тендер еще не появился. Давайте выясним, насколько велика вероятность улучшений после такой дорогостоящей терапии.
SMN1 и его заместитель
Спинальная мышечная атрофия (СМА) развивается из-за разрушения альфа-мотонейронов, отвечающих за сокращение скелетных мышц и находящихся в передних рогах спинного мозга. Причина этого — поломки в гене SMN1, кодирующем белок, отвечающий за выживание моторных, или двигательных, нейронов (survival motor neuron). Мышцы не получают команду от этих нейронов, атрофируются от неиспользования, поэтому и появляются двигательные проблемы. Но у гена SMN1 есть заместитель, который образовался когда-то благодаря удвоению. В эволюционной перспективе такая подстраховка оказалась полезной: больше вероятность, что будет работать хотя бы один.
Вы можете научиться разбираться в лекарствах самостоятельно на авторском онлайн-курсе «Чем нас лечат» от редактора Indicator.Ru Екатерины Мищенко: https://clck.ru/Pnmtk
Но одно дело — «выйти за товарища на пару смен», и совсем другое — взвалить на свои плечи двойной груз обязанностей. С этим SMN2 не справляется, ведь в последовательностях двух генов есть маленькое различие: один нуклеотид («буква» ДНК) в седьмом экзоне («смысловой» вставке гена, с которой кодируется белок). Совпало так, что при «чтении» информации с гена для синтеза белка этот нуклеотид играет скорее роль знака препинания, мешая производить белки с этого гена так же эффективно и делая готовые белки более нестабильными. Но и ген SMN2 может быть размноженным в организме. От количества копий и успешного синтеза их белков зависит то, каким из четырех типов «классической» спинальной атрофии страдает пациент.
Спинраза стала первым в мире препаратом, бросившим вызов этой болезни. До него у пациентов была лишь надежда на заместительную терапию или симптоматические меры. Но лекарство не только стоит очень дорого, но и вводится в позвоночный канал, в котором находится спинной мозг. Процедура непростая, трудоемкая и болезненная. Состав препарата расскажет нам больше о том, почему форма приема именно такая и какого эффекта надеялись достичь разработчики.
Из чего же, из чего
В основе Спинразы лежит действующее вещество нусинерсен. Оно состоит из коротких цепочек нуклеотидов, которые будут связываться с определенными последовательностями нуклеотидов в промежуточной стадии производства белка — информационной, или матричной, РНК. Такие препараты обычно называют antisense — антисмысловыми, так как они могут мешать прочтению инструкции в РНК и ее «переводу» в белок. Но в этом случае последовательность не блокирует синтез белка, а лишь немного видоизменяет его, переводя белок в более устойчивую форму — такую же, как в норме производилась бы с гена SMN1.
Короткие цепочки нуклеотидов нусинерсена
Хотя изредка короткие нуклеотидные последовательности и проникают через пищеварительный тракт в кровь, это скорее исключение, чем правило. Да и в крови антисенс-отрывки много пользы не принесут, потому что активность генов SMN1 и SMN2 важна для нас в строго определенном месте: у альфа-моторных нейронов. Поэтому и был выбран, казалось бы, максимально неудобный и явно не подходящий для лечения на дому способ применения.
Но есть у него и плюсы: поскольку препарат не разрушается грозой большинства лекарственных молекул — цитохромами 450 — он остается активным не несколько часов, а несколько месяцев. В плазме крови период полувыведения достигает 89 дней, а в спинномозговой жидкости — 175 дней. Лекарственное вещество разрушают экзонуклеазы (ферменты, «режущие» ДНК) при помощи гидролиза, делая из него безобидные запчасти для новых молекул ДНК или РНК. Это значит, что повторять инъекции часто не придется.
Speranza для Spinraza
Но то, что технология работает в теории и даже в пробирке, еще не гарантирует эффективности на живых организмах — в том числе и на пациентах. В PubMed с меткой «клинические испытания» можно найти семь статей о препарате. Часть статей относится к ранним фазам клинических исследований. Авторы одной (первая фаза, 28 человек) оценивали фармакокинетику, переносимость и безопасность препарата и не нашли проблем, а в другой (вторая фаза, 20 человек) подбирали нужную дозу. Во втором исследовании у пациентов 77 раз случались побочные реакции, но авторы заключили, что вероятность, что они связаны с самим препаратом, мала. Скорее всего, осложнения возникали из-за самой процедуры. В первом исследовании, по которому написали еще одну статью, без проблем тоже не обошлось: в 50% случаев побочные эффекты — головную боль, боль в спине и постлюмбарный синдром — вызвала люмбарная пункция, которую проводили для анализа того, как лекарство работает и распадается в организме.
Но для регистрации нужны испытания третьей фазы, где эффективность лекарства в двойном слепом контролируемом исследовании сравнивается с плацебо или стандартной терапией.
Двойной слепой рандомизированный плацебо-контролируемый метод — способ клинического исследования лекарств, при котором испытуемые не посвящаются в важные детали проводимого исследования. «Двойной слепой» означает, что о том, кого чем лечат, не знают ни испытуемые, ни экспериментаторы, «рандомизированный» — что распределение по группам случайно, а плацебо используется для того, чтобы показать, что действие препарата не основано на самовнушении и что данное лекарство помогает лучше, чем таблетка без действующего вещества. Этот метод мешает субъективному искажению результатов. Иногда группе контроля дают другой препарат с уже доказанной эффективностью, а не плацебо, чтобы показать, что препарат не просто лечит лучше, чем ничего, но и превосходит аналоги.
Самое дорогостоящее лекарство в мире
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Не так давно, в мае 2019 года, произошло знаковое событие в сфере лечения генетических заболеваний: Управление по санитарному надзору за качеством продуктов и медикаментов США (FDA) одобрило препарат Zolgensma («Золгенсма», или онасемноген абепарвовек). Это лекарственное средство предназначено для генотерапевтического лечения спинально-мышечной атрофии (СМА). Сегодня «Золгенсма» является самым дорогим лекарственным препаратом в мире.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Что такое СМА?
Спинально-мышечной атрофией, или СМА, называют смертельно опасное нейродегенеративное заболевание, в процессе развития которого у пациента происходит постепенная атрофия скелетной мускулатуры. В результате человек теряет или так и не приобретает способности ходить, самостоятельно стоять, сидеть без поддержки. Со временем возникает сколиоз и другие ортопедические проблемы. Также СМА-пациенты, если они не получают должного ухода и лечения, постепенно утрачивают способность самостоятельно дышать, глотать, кашлять. Пациенты с первым, самым тяжелым, типом СМА еще несколько лет назад, как правило, не доживали и до двух лет [1].
СМА возникает из-за потери участка хромосомы или точечной мутации гена SMN1, расположенного в пятой хромосоме. В результате этого нарушается синтез SMN-белка, недостаток которого приводит к гибели моторных нейронов и атрофии скелетной мускулатуры [2].
Для того чтобы болезнь проявилась, носителем рецессивной мутации в гене SMN1 должны быть оба родителя. Примерно каждый 40-й житель Земли является таким носителем.
Подробнее о причинах возникновения, диагностике, течении спинально-мышечной атрофии читайте в статье «Надежда для СМАйликов» [3].
Терапия спинально-мышечной атрофии до появления «Золгенсмы»
До недавнего времени методы лечения СМА сводились к поддерживающей терапии. Больным рекомендовали специальное питание, витамины, умеренные физические нагрузки, при необходимости — хирургическое вмешательство, искусственная вентиляция легких. К сожалению, до сих пор значительная часть СМА-пациентов получает лишь такое лечение.
Рисунок 1. «Спинраза» — первый препарат, одобренный для лечения СМА
С 2016 года сначала в США, а затем и в Европе для лечения спинально-мышечной атрофии стали применять препарат «Спинраза» (нусинерсен) [4]. Он позволяет существенно увеличить продукцию полноценного SMN-белка, что ведет к сглаживанию симптомов заболевания. Терапия тем эффективнее, чем меньше возраст пациента.
Стоимость препарата составляет несколько сот тысяч долларов в год, поэтому его закупка осуществляется не за счет пациента. Одна за другой страны разных континентов одобрили препарат и стали применять для спасения жизней своих сограждан. В некоторых государствах этот процесс сильно затянулся из-за бюрократических проволочек и нехватки финансирования.
В РФ «Спинразу» Минздрав одобрил в начале 2019. В свою очередь компания «Биоген», производитель «Спинразы», в апреле 2019 г. объявила об открытии в России «Программы расширенного доступа» для лечения СМА нусинерсеном. Благодаря этой программе доступ к препарату получили 40 детей из России, страдающих СМА I типа [5].
В августе «Спинраза» была включена в Государственный реестр лекарственных средств РФ. Однако охват больных все еще слишком мал. В Российской Федерации зарегистрировано около 800 СМА-пациентов, и далеко не все они получают инъекции «Спинразы».
Отличия «Золгенсмы» от «Спинразы»
После появления на фармацевтическом рынке «Спинразы» все ждали выхода принципиально нового препарата для лечения СМА, основанного на генотерапевтическом подходе. Лидером в данной разработке оказалась компания «Новартис» (Novartis), которая в 2018 году купила компанию «Авексис» (AveXis) за 8,7 млрд долларов, а в 2019 вышла на рынок c препаратом «Золгенсма» (Zolgensma, он же AVXS-101, или онасемноген абепарвовек) [6].
Рисунок 2. Логотип препарата «Золгенсма»
Чем же «Золгенсма» принципиально отличается от препарата «Спинраза»? Самое важное различие заключается в механизме действия: «Спинраза» исправляет дефект сплайсинга матричной РНК гена SMN2, но она никак не затрагивает ген SMN1, мутации в котором и являются основной причиной развития спинально-мышечной атрофии.
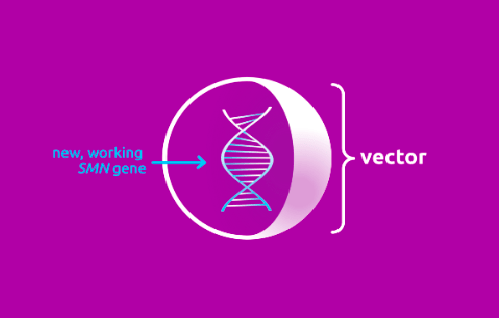
Действие же препарата «Золгенсма» направлено именно на ген SMN1. Благодаря использованию этого лекарственного средства, мутировавший или отсутствующий ген SMN1 замещается функционально полноценным геном [1].
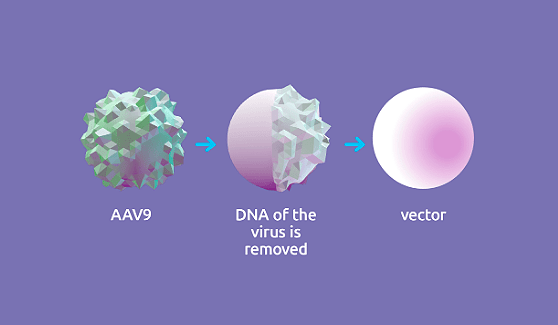
Происходит это следующим образом: препарат содержит функционально полноценный ген SMN1, который находится внутри вектора. Задача вектора — быстро доставить его в мотонейроны тела (рис. 3).
Рисунок 3. Условное изображение вектора, входящего в состав «Золгенсмы»
Для создания вектора использовали аденоассоциированный вирус (adeno-associative virus 9, или AAV9). Это представитель семейства парвовирусов, который способен инфицировать клетки человека и других приматов, но при этом не является патогенным. Все это делает AAV9 отличным генетическим вектором. Собственный генетический материал вируса удалили и вместо него поместили функционально полноценный ген SMN1 (рис. 4).
Рисунок 4. Условная схема механизма создания вектора
После того, как ген прибывает в нужную локацию, вектор разрушается и выводится из организма.
СМА-пациенту необходима всего одна инфузия препарата «Золгенсма» в течение жизни, в то время как лечение «Спинразой» требует нескольких доз в год. Отсюда и стоимость «Золгенсмы»: 2 125 000 долл. США. Такая ценовая политика компании-производителя делает данный препарат самым дорогим лекарственным средством на сегодняшний день. Для сравнения, стоимость все той же «Спинразы» составляет 125 тыс. долларов за одну дозу. При этом в первый год лечения нужно шесть инфузий, в последующие периоды — три инфузии ежегодно.
Насколько оправдана такая цена препарата и какова же его себестоимость? «Новартис» не афиширует информацию относительно себестоимости «Золгенсмы», поэтому эксперты оценивают стоимость препарата по двум показателям: качество жизни пациента с учетом прожитых лет (QALY) и добавленные годы жизни (LYG). По данным Института клинико-экономической экспертизы (Institute for Clinical and Economic Review, ICER), исходя из показателя QALY стоимость «Золгенсмы» должна быть в пределах 1,1–1,9 миллионов долл. США; исходя из показателя LYG — 1,2–2,1 миллиона долл. США. Таким образом, можно сказать, что стоимость «Золгенсмы» завышена по отношению к оценкам экспертов [7].
При формировании своей ценовой политики компания «Новартис» отталкивалась от стоимости препарата «Спинраза». По задумке производителя в течение десяти лет на лечение СМА-пациента «Спинразой» необходимо будет потратить более 4 млн долларов, в то время как одна инфузия «Золгенсмы» стоит 2 млн 125 тысяч. Таким образом, в долгосрочной перспективе второй вариант более выгоден [8], [9].
Компания «Новартис» ожидала, что «Золгенсма» станет «блокбастером», то есть принесет более 1 млрд долларов за первый год продаж. Однако скандал, который возник вокруг «Золгенсмы», может не дать осуществиться этим планам. Летом 2019 г. компания «Новартис» сама сообщила FDA о манипуляции с данными при проведении тестирования препарата на животных. Если бы эти данные были известны FDA в мае, то разрешение на использование препарата «Золгенсма» «Новартис» получила бы позже, но сейчас принято решение не отзывать препарат [10].
Сумму в два с лишним миллиона долларов не в состоянии заплатить большинство СМА-семей, поэтому предполагается, что пациенты будут обеспечиваться жизненно важным лечением благодаря государственной поддержке или за счет страховых компаний. Кроме того, производитель «Золгенсмы» предоставляет пятилетнюю рассрочку на оплату генной терапии и дает возможность пациенту не выплачивать оставшуюся сумму, если препарат перестанет действовать [8]. Сегодня препарат «Золгенсма» доступен только для жителей США, так как FDA — это единственная организация, которая его одобрила. Также есть ограничения по возрасту и тяжести заболевания: пока препарат применяется только для пациентов до двух лет с первым типом СМА. В дальнейшем производитель планирует использовать препарат и для других групп людей, страдающих спинально-мышечной атрофией.
Важно также отметить, что «Золгенсма» вводится внутривенно. «Спинраза» же должна попасть в спинномозговую жидкость пациента, что создает ряд дополнительных проблем и рисков.
Побочные эффекты «Золгенсмы»
Кроме высокой стоимости, у «Золгенсмы» есть и другие серьезные недостатки. Возможными побочными эффектами препарата являются:
Не рекомендуется использование «Золгенсмы» у недоношенных детей до достижения ими полного гестационного возраста.
По данным компании-производителя на момент регистрации «Золгенсма» в рамках клинических исследований была применена для терапии 44 детей в возрасте от 0,3 до 7,9 месяцев с массой тела от 3 до 8,4 кг. Такая небольшая выборка объясняется тем, что СМА является редким заболеванием, поэтому набрать большое количество пациентов за короткий период времени — не такая уж и простая задача.
С другой стороны, небольшая выборка означает, что количество побочных эффектов препарата может быть значительно выше, чем известно на данный момент. Так, производитель уведомляет, что один из СМА-пациентов, который участвовал в клинических исследованиях за пределами США, через 12 дней после инфузии препарата начал страдать от дыхательной недостаточности. Также у него были зафиксированы лейкоэнцефалопатия, приступы гипотензии и судорог примерно через месяц после начала лечения. Через 52 дня наступил летальный исход. Но пока сложно сказать, является ли подобное развитие событий реакцией на введение препарата или же эти симптомы появились бы у СМА-пациента и без использования «Золгенсмы».
Важно также отметить, что долгосрочное влияние препарата на организм человека пока неизвестно. Прежде всего, не ясно, будет ли экспрессия гена SMN1 в организме пациента поддерживаться постоянно или постепенно сойдет на нет. Чтобы ответить на этот вопрос, «Новартис» обязана постоянно собирать данные долговременного наблюдения. В разрезе стоимости это является ключевым риском для плательщиков. Компания-производитель пытается снизить эти риски, предлагая рассрочку на пять лет пациентам, с правом приостановить выплаты, если препарат не будет проявлять своего терапевтического действия. Однако если экспрессия гена прекратится после истечения пятилетнего срока, то никакой финансовой компенсации за это не предусмотрено.
Следующий шаг
Компания-производитель «Золгенсмы» планирует в будущем применять препарат для пациентов разных возрастов со СМА II и III типов. Также «Новартис» работает над регистрацией препарата за пределами США.
Рисунок 5. Рисдиплам — препарат для лечения спинально-мышечной атрофии, который находится на стадии клинических испытаний на людях
Появление «Золгенсмы» на фармакологическом рынке повлияло на продажи «Спинразы», поэтому компания «Биоген» уже проводит клинические исследования, направленные на усиление терапевтической активности «Спинразы» путем увеличения ее дозы [11].
Но «Спинраза» и «Золгенсма», возможно, недолго будут единственными препаратами для лечения спинально-мышечной атрофии. Компания «Рош» (Roche) уже достаточно давно ведет клинические испытания своего лекарственного средства (рисдиплама) и, по всей видимости, в ближайшие пару лет данный препарат также выйдет на фармацевтический рынок (рис. 5).
Рисдиплам, как и нусинерсен («Спинраза»), не влияет на ген SMN1, а модифицирует сплайсинг мРНК гена SMN2. Однако у рисдиплама есть существенное отличие: препарат принимается перорально и не требует введения в спинно-мозговую жидкость. Кроме того, рисдиплам подходит для всех типов СМА и в клинических испытаниях показывает более высокую эффективность, чем нусинерсен [12].
По прогнозам экспертов, цена препарата будет значительно ниже, чем «Спинразы» и «Золгенсмы», поэтому новое средство сможет составить серьезную конкуренцию уже существующим лекарствам [8].
Уже в конце 2019 года компания Roche планирует подать документы на одобрение препарата в FDA и EMA (Европейское медицинское агентство) [13].
Сегодня «Золгенсма» является одним из немногих одобренных генотерапевтических препаратов, и единственный — для лечения СМА. Данная технология является чрезвычайно перспективной и теоретически может подарить шанс СМА-пациентам на продолжительную жизнь высокого качества. Однако возможные побочные эффекты и высокая стоимость препарата пока не позволяют делать поспешных радужных выводов.