смешанные соли это что
Большая Энциклопедия Нефти и Газа
Смешанная соль
Смешанная соль выделяется в осадок при насыщении аммиачной селитрой жидкого удобрения ( 11 % N, 16 % Р), полученного аммонизацией полифосфо рной кислоты. При относительной влажности ниже 50 % эта соль устойчива и негигроскопична при комнатной температуре. При нагревании до 75 С смешанная соль переходит в кубическую модификацию. При хранении в закрытом сосуде состав соли не меняется. [2]
Смешанные соли образованы замещением гидроксильных ионов основания анионами разных кислот. [3]
Смешанная соль дает простою обработкою сернонатровую соль. Для этого смешанную соль растворяют в пресной воде при 30 Цельзия до того, чтобы получить раствор в 30 Боме. Такой раствор охлаждают в огромной холодильной машине Каре и получают из кубического метра соли до 300 кг глауберовой соли, которую сушат и прокаливают, чтобы лишить почти всей кристаллизационной воды и тем облегчить перевозку. Эта соль, равно как и поваренная соль, идет для содового завода. [4]
Смешанная соль является отходом производства коксохимических заводов, представляет собой белый кристаллический порошок, хорошо растворимый в воде. Содержит 19 % роданида натрия ( NaSCN), который является действующим веществом препарата, а также 56 % гипосульфита и 25 % сульфата натрия. [5]
Смешанная соль значительно прочнее и, по-видимому, не разлагается водой. [6]
Смешанные соли образованы; амещением гидроксильных ионов основания анионаки разных кислот. [7]
Смешанная соль с участием каинита должна содержать не менее 30 % К. [8]
Смешанные соли хинина и аспарагиновой кислоты с аргинином рекомендованы в качестве жаропонижающих. Для этой цели получены аналогичные соли глутаминовой кислоты. [9]
Смешанная соль роданида натрия используется в основном в Белоруссии и в северной части Украины, где люпин без десикации, как правило, не успевает полностью созреть, поэтому необходимо ускорить его созревание путем форсирования оттока питательных веществ из листьев в бобы и постепенного подсушивания растений. Следует, конечно, учитывать, что в годы, неблагоприятные для созревания люпина, ранняя обработка препаратами может повысить урожай семян, а в годы с хорошими условиями развития люпина ранняя обработка снижает урожай. [10]
Выпускают смешанные соли двух видов: смесь хлористого калия с сильвинитом и смесь хлористого калия с сильвинитом и каинитом Калушского калийного комбината. [11]
Эти смешанные соли должны быть растворены водой умеренной температуры. [12]
Известны смешанные соли CssLi [ Fe ( CN) e ] и Gs2Li2 [ Fe ( CN) e ] [630, 1071]; аналогичные соли с другими щелочными металлами для цезия не описаны. [13]
Поля смешанных солей на диаграмме уменьшаются по мере разбавления рассолов. [15]
Смешанные соли это что
Средние соли вступают в реакцию двойного обмена с кислотными и основными гидроксидами и с другими солями:
Ag2CO3 + 2HNO3 = 2AgNO3 + CO2↑ + H2O
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Ca(NO3)2 + Na2CO3 = CaCO3↓ + 2NaNO3
Реакции, приведенные выше, являются распространенными способами получения солей. Кроме того, средние соли образуются при взаимодействии металлов с кислотами:
Fe + H2SO4(разб.) = FeSO4 + H2↑
Cu + 4HNO3(конц.) = Сu(NO3)2 + 2NO2↑ + H2O
Почти все оснóвные соли малорастворимы в воде.
Возможна и дальнейшая нейтрализация основных солей избытком кислотного гидроксида, например:
CoNO3(OH) + HNO3 = Co (NO3)2 + H2O
Двойные и смешанные соли
Известны также соли, содержащие два химически разных катиона (двойные соли) или аниона (смешанные соли). Примеры:
Часто двойные и смешанные соли малорастворимы в воде. Многие двойные и смешанные соли могут быть получены путем совместной кристаллизации при охлаждении из растворе смеси солей. Например:
K2SO4 + MgSO4 + 6H2O = K2Mg(SO4)2 · 6H2O
Смешанные соли
Двойные соли
Двойными солями называют такие соли, в состав которых входят катионы двух различных металлов (или катион аммония) и анионы одного кислотного остатка, например:
KAl(SO4)2 – сульфат алюминия калия;
KCuCl3 – хлорид меди (ΙΙ) калия.
Двойные соли образуются при соединении солей двух различных металлов одной и той же кислоты:
сульфат алюминия калия
сульфат железа (ΙIΙ) аммония
Двойные соли диссоциируют в одну ступень необратимо (по типу сильного электролита) на ионы, из которых они состоят, например:
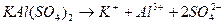

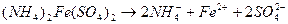



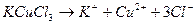
Смешанными солями называют такие соли, в состав которых входят катионы одного металла и анионы двух различных кислотных остатков и могут быть образованы при взаимодействии солей двух различных кислот одного и того же металла. Такие соли встречаются довольно редко, например:




хлоридгипохлорит кальция Ca(ClO)2 хлоридгипохлорит кальция





Смешанные соли диссоциируют в одну ступень необратимо (по типу сильного электролита) с образованием всех ионов, входящих в состав соли, например: 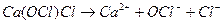
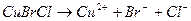
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Химические свойства и способы получения солей
Перед изучением этого раздела рекомендую прочитать следующую статью:
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
Классификация солей
Получение солей
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
2HCl + CuO → CuCl2 + H2O
4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:
6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Ca + S → CaS
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Fe + 2HCl → FeCl2 + H2
9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
2NaOH + Cl2 0 = NaCl — + NaOCl + + H2O
6NaOH + Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
Химические свойства солей
1. В водных растворах соли диссоциируют на катионы металлов Ме + и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
CaCl2 → Ca 2+ + 2Cl –
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
NaHCO3 → Na + + HCO3 –
HCO3 – → H + + CO3 2–
Основные соли также диссоциируют ступенчато.
CuOH + → Cu 2+ + OH –
Двойные соли диссоциируют в одну ступень.
Смешанные соли диссоциируют также одноступенчато.
CaCl(OCl) → Ca 2+ + Cl — + ClO –
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Хлорид аммония взаимодействует с гидроксидом натрия:
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Некоторые кислые соли могут реагировать со своими средними солями.
6. C оли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!
При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
7. Некоторые соли при нагревании разлагаются .
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся:
Смешанные соли это что
Способы получения средних солей
Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса. Большинство способов получения солей было разобрано выше.
Способы получения кислых и основных солей
Кислые соли могут быть получены либо неполной нейтрализацией кислот, либо действием избытка кислот на средние соли, щелочи, оксиды или соли:
Основные соли часто получаются при осторожном добавлении небольших количеств щелочей к растворам средних солей металлов, имеющих малорастворимые основания, или при действии солей слабых кислот на средние соли:
В общем виде способы получения кислых или основных солей из средних солей представим в виде следующей схемы:
Химические свойства солей
Многие соли устойчивы при нагревании. Однако соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются (также см. получение оксидов).
Взаимодействие растворов или расплавов солей менее активных металлов с более активными металлами:
Взаимодействие соли с кислотой, в результате которого образуется нерастворимое или летучее вещество:
`»AgNO»_3 + «HBr» → «AgBr»↓ + «HNO»_3`;
`»FeS» + 2″HCl» → «H»_2″S»↑ + «FeCl»_2`.
Взаимодействие раствора соли со щелочью, в результате которого образуется нерастворимое вещество:
`»CuCl»_2 + «KOH» → «Cu(OH)»_2 ↓+ 2″KCl»`;
`»Na»_2″CO»_3 + «Ca(OH)»_2 → «CaCO»_3↓ + 2″NaOH»`.
Взаимодействие растворов солей друг с другом, в результате которого образуется нерастворимое вещество:
`»Na»_2″CO»_3 + «Ba(NO»_3)_2 → «BaCO»_3 ↓+ 2″NaNO»_3`.
`2″FeCl»_2 + «Cl»_2 → 2″FeCl»_3`;
`2″NaNO»_2 + «O»_2 → 2″NaNO»_3`;
`»Na»_2″SO»_3 + «H»_2″O» + «Cl»_2 → «Na»_2″SO»_4 + 2″HCl»`.
Гидролиз некоторых солей:
При нагревании многие кислые соли разлагаются:
называется связь между веществами разных классов соединений, основанная на их взаимных превращениях и отражающая единство их происхождения.
Генетическая связь может быть отражена в генетических рядах.
Генетический ряд состоит из веществ, которые образованы одним химическим элементом, принадлежат к разным классам соединений и связаны взаимными превращениями.
В приведённой ниже таблице обобщены рассмотренные выше химические свойства важнейших классов неорганических соединений.














