смесь и химическое соединение в чем разница
Элементы, соединения и смеси. Как разобраться?
По мнению химиков, все вещества на нашей планете — это элементы, соединения или смеси. Что они собой представляют? Чем одни отличаются от других? Давай разбираться.
Элемент
Соединение
Соединение — это вещество, в составе которого находятся атомы двух и более элементов, соединенные между собой химической связью. Это означает, что в результате соединения атомов друг с другом образуется абсолютно новое вещество. Например, вода — это соединение водорода и кислорода, т.е. соединив кислород с водородом, мы можем получить воду! Стекло — это соединение кислорода, кремния, кальция и натрия.
Интересная особенность соединений заключается в том, что их химические и физические свойства отличаются от свойств образующих их атомов. Например, поваренная соль образуется во время реакции натрия с хлором. Несмотря на то, что хлор — ядовитый газ, полученное соединение — поваренная соль — не обладает опасными свойствами хлора.
Калий + марганец + кислород = марганцовка
Обычная марганцовка известна очень давно. Это вещество в виде порошка или кристаллов темно-фиолетового цвета довольно широко используется в медицине (как антисептик), промышленности, пиротехнике, садоводстве (для протравливания семян и избавления домашних растений от вредителей) и быту (для проведения дезинфекции).
Сточки зрения химии марганцовка, или перманганат калия, считается химическим соединением, в состав ко-торого входят калий, марганец и кислород.
Смеси
Смеси — это вещества, в состав которых входят элементы или соединения, не вступившие в химические реакции друг с другом. Это означает, что компоненты смеси перемешаны между собой, но не связаны химической связью, и их легко можно разделить. Например, перемешав металлические кнопки с осколками стекла, мы получим смесь. Для того чтобы извлечь из нее кнопки, нужно всего лишь поднести магнит, который притянет все металлические предметы. Несложно выделить чистый песок из смеси соли и песка. Для этого необходимо поместить смесь в воду, хорошо перемешать, дождаться полного растворения соли и отфильтровать раствор.
А теперь давай посмотрим с точки зрения химии на тесто. Легко представить, что тесто — это тоже смесь, в состав которой входят различные «соединения»: мука, молоко, яйца, жиры, сахар и т.д.
Однако «смесью» тесто мы можем называть только до тех пор, пока оно не попало в духовку. Готовый пирог — это уже новое «соединение».
Чай с точки зрения химии
Свойства смесей
Каждый компонент смеси сохраняет свои индивидуальные химические свойства, и все компоненты могут находиться в абсолютно любых пропорциях. Например, воздух, которым мы дышим, представляет собой смесь кислорода и других веществ, количество которых может меняться в зависимости от того места, где ты находишься. Согласись, что содержание пыли, копоти и прочих вредных веществ на оживленной загазованной улице мегаполиса будет гораздо выше, чем в лесу или парке.
Смеси могут быть твердыми, жидкими и газообразными. Например, воздух — это смесь газов, соленая вода — смесь жидкости и твердого вещества (соли), а бронза — твердая смесь (сплав меди и олова).
Основные отличительные признаки смесей:
Простые и сложные вещества. Аллотропия. Химические соединения и смеси
Все вещества делятся на простые и сложные.
Простые вещества — это вещества, которые состоят из атомов одного элемента.
В некоторых простых веществах атомы одного элемента соединяются друг с другом и образуют молекулы. Такие простые вещества имеют молекулярное строение. К ним относятся: водород H2, кислород O2, азот N2, фтор F2, хлор Cl2, бром Br2, йод I2. Все эти вещества состоят из двухатомных молекул. (Обратите внимание, что названия простых веществ совпадают с названиями элементов!)
Другие простые вещества имеют атомное строение, т. е. состоят из атомов, между которыми существуют определенные связи. Примерами таких простых веществ являются все металлы (железо Fe, медь Сu, натрий Na и т. д.) и некоторые неметаллы (углерод С, кремний Si и др.). Не только названия, но и формулы этих простых веществ совпадают с символами элементов.
Существует также группа простых веществ, которые называются благородными газами. К ним относятся: гелий Не, неон Ne, аргон Аr, криптон Kr, ксенон Хе, радон Rn. Эти простые вещества состоят из не связанных друг с другом атомов.
Каждый элемент образует как минимум одно простое вещество. Некоторые элементы могут образовывать не одно, а два или несколько простых веществ. Это явление называется аллотропией.
Аллотропия — это явление образования нескольких простых веществ одним элементом.
Разные простые вещества, которые образуются одним и тем же химическим элементом, называются аллотропными видоизменениями (модификациями).
Аллотропные модификации могут отличаться друг от друга составом молекул. Например, элемент кислород образует два простых вещества. Одно из них состоит из двухатомных молекул О2 и имеет такое же название, как и элемент— кислород. Другое простое вещество состоит из трехатомных молекул О3 и имеет собственное название — озон.
Кислород О2 и озон О3 имеют различные физические и химические свойства.
Аллотропные модификации могут представлять собой твердые вещества, которые имеют различное строение кристаллов. Примером являются аллотропные модификации углерода С — алмаз и графит.
Число известных простых веществ (примерно 400) значительно больше, чем число химических элементов, так как многие элементы могут образовывать две или несколько аллотропных модификаций.
Сложные вещества — это вещества, которые состоят из атомов разных элементов.
Примеры сложных веществ: НCl, Н2O, NaCl, СО2, H2SO4 и т. д.
Сложные вещества часто называют химическими соединениями. В химических соединениях свойства простых веществ, из которых образуются эти соединения, не сохраняются. Свойства сложного вещества отличаются от свойств простых веществ, из которых оно образуется.
Например, хлорид натрия NaCl может образоваться из простых веществ — металлического натрия Na и газообразного хлора Сl Физические и химические свойства NaCl отличаются от свойств Na и Cl2.
В природе, как правило, встречаются не чистые вещества, а смеси веществ. В практической деятельности мы также обычно используем смеси веществ. Любая смесь состоит из двух или большего числа веществ, которые называются компонентами смеси.
Например, воздух представляет собой смесь нескольких газообразных веществ: кислорода О2 (21 % по объему), азота N2 (78%), углекислого газа СО2 и др. Смесями являются растворы многих веществ, сплавы некоторых металлов и т. д.
Смеси веществ бывают гомогенными (однородными) и гетерогенными (неоднородными).
Гомогенные смеси — это смеси, в которых между компонентами нет поверхности раздела.
Гомогенными являются смеси газов (в частности, воздух), жидкие растворы (например, раствор сахара в воде).
Гетерогенные смеси — это смеси, в которых компоненты разделяются поверхностью раздела.
К гетерогенным относятся смеси твердых веществ (песок + порошок мела), смеси нерастворимых друг в друге жидкостей (вода + масло), смеси жидкостей и нерастворимых в нем твердых веществ (вода + мел).
Важнейшие отличия смесей от химических соединений:
Соединения и смеси
Большинство веществ состоит из нескольких элементов, т.е. многие вещества представляют собой соединения или смеси. Соединение — это вещество, содержащее атомы двух или более элементов, соединенные между собой химической связью. В смеси, например в морской воде или воздухе, различные вещества перемешаны, но не связаны химически. Морской песок — смесь частиц кварки, раковин и органических веществ (см. рис.). Кварц – соединение кремния и кислорода. Почти бесцветные песчинки – это частицы кварца.
Соединения
В соединении атомы двух или более элементов связаны вместе химической связью, так что образуется совершенно новое вещество. Углекислый газ — это соединение, состоящее из связанных атомов углерода и кислорода. Соединение нельзя разделить на элементы физическими методами, например путем фильтрации или выпаривания. Свойства соединения отличаются от свойств элементов. Если нагреть смесь железа с серой (слева), то произойдет реакция и образуется новое вещество – сульфид железа. После реакции железо уже нельзя отделить от серы. В отличие от железа сульфид железа не намагничивается, а в отличие от измельченной серы, тонет в воде. В каждом образце соединения элементы содержатся в одинаковой пропорции. Химическая формула отражает соотношение элементов. Формула сульфида железа FeS говорит о том, что каждый атом железа связан с одним атомом серы.
Хотя элементов всего около ста, они могут соединяться самыми разными способами, поэтому в мире существует не меньше двух миллионов соединений. Вода — это соединение водорода с кислородом. Стекло — соединение кальция, кремния, кислорода и натрии. Соединения делятся на группы в соответствии с их химическими свойствами. Так, кислоты и основания составляют особые группы. Соединения можно также разделить по признаку наличия тех или иных атомов. Например, гидриды — это вещества, содержащие водород. Хлориды содержат хлор, оксиды содержат кислород. При реакция натрия с хлором, образуется хлорид натрия — поваренная соль. Хлор — ядовитый газ, а натрий — очень активный металл. Хлорид натрия не обладает этими опасными свойствами.
Все органические соединения содержат углерод. Все живые организмы, как и ископаемое топливо, например нефть, состоят из органических соединений. Люди также производят органические соединения — пластмассы, красители, моющие средства, лекарства.
Смеси
Большинство окружающих нас веществ — смеси. Они содержат различные вещества (элементы или соединения), не вступившие в химические реакции. Смесь может содержать два или более элементов — веществ, состоящих из атомов одного типа. Смесь может содержать соединения, т.е. вещества, состоящие из атомов разных типов. Смесь может состоять из элементов и соединений. Воздух — смесь элементов (кислород) и соединений (пыль, копоть). Компоненты смеси химически не связаны, и их можно легко разделить. Например, из смеси железа с серой частицы железа можно извлечь магнитом. Частицы железа притягиваются к магниту (см. рис.), а частицы серы на магнит не реагируют. В смеси компоненты могут содержаться в любых пропорциях. Все компоненты сохраняют свои индивидуальные свойства. Тесто — это смесь различных соединений: яиц, муки, жира. Испеченный пирог представляет собой новое соединение. Соль — это соединение натрия с хлором. Масло — органическое соединение, в нем есть углерод, водород и кислород
Виды смесей
В состав смесей могут входить и твердые вещества, жидкости и газы. Воздух — это смесь газов, а морская вода — смесь твердого вещества (соли) и жидкости. Латунь — смесь двух твердых веществ, меди и цинка. Смеси металлов называются сплавами. Когда твердое вещество (например, соль) растворяется в жидкости (например, в воде), образуется раствор. Легко растворяющееся твердое вещество называют растворимым, а то, которое не растворяется, — нерастворимым. Смесь, состоящую из частиц твердого вещества, взвешенных в жидкости или газе, называют взвесью. Кровь, молоко, дым — все это взвеси. Молоко — взвесь частиц жира в воде. Шипучие напитки — смеси двух жидкостей (воды и красителя) и углекислого газа. Газ выделяется в виде пузырьков. Жидкости, которые легко образуют смеси, например вода и чернила, называются смешиваемыми. Если жидкости не образуют раствора — вода и нефть, — говорят, что они несмешиваемые. Чтобы их перемешать, нужно добавить третье вещество – эмульгатор. Эмульгатор разбивает нефть на небольшие капли, зависающие в воде. Полученная смесь называется эмульсией. Майонез — масляно-уксусная эмульсия. Эмульгатором служит яичный желток. Эмульсионная краска — это эмульсия, где в воде находятся капельки масла и красящего вещества. Мука, сахар, масло состоят из соединений углерода, водорода и кислорода. Яйца содержат углерод, азот, фосфор, водород, кислород и серу. Сок лимона – это смесь лимонной кислоты и воды.
Разделение смесей
Химики знают много способов разделение смесей на составные части. Выбор способа зависит от вида смеси. Простейший способ отделения твердых частиц, взвешенных в жидкости, — оставить взвесь в покое, чтобы частицы осели на дно. В мутной воде есть частицы песка, почвы, органических веществ, но они постепенно оседают на дно. Другой способ отделения твердых частиц от жидкости — фильтрация. Фильтр задерживает твердые частицы и пропускает молекулы жидкости. Этот метод используется на водонапорных станциях для получения чистой питьевой воды. Жидкость, прошедшая через фильтр, — фильтрат; твердые частицы, задержанные фильтром, — осадок.
Для определения состава смеси используется хроматография. Смесь растворяется в растворителе, и часть ее помещается на бумажный фильтр, который задерживает разные вещества в разной степени. На фильтре образуются цветные полосы — хроматограмма. Исследователь определяет состав смеси, сравнивая ее хроматограмму с хроматограммами известных веществ. Хроматография помогает установить, какие красители добавлены в продукт.
Выпаривание — это способ выделения твердого вещества из жидкого раствора. Раствор разогревают, он закипает, жидкость испаряется и на дне остается твёрдое вещество. Лимонный сок — водный раствор лимонной кислоты. Если сок кипятить, вода испарится и на дне кастрюли останутся кристаллы лимонной кислоты. Дистилляция — метод получения чистой жидкости, в частности воды, из растворов. Этот процесс аналогичен выпариванию, но испарившуюся жидкость после охлаждения собирают. Для отделения твердых частиц от жидкости применяется также центрифугирование. В специальной машине — центрифуге — сосуд с жидкостью очень быстро вращается. Центробежная сила отбрасывает твердые частицы к стенкам сосуда, после чего жидкость сливают или фильтруют. Пример центрифуги — сушильный барабан. В медицине центрифугу используют для отделения красных кровяных телец от крови, которая представляет собой взвесь кровяных пластинок и красных и белых телец в особой жидкости — плазме.
Растворы, механические смеси и химические соединения
Однородность растворов делает их очень сходными с химическими соединениями.
Химическое соединение — сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов.
Раствор это не одно химическое соединение, а как минимум два смешанных соединения. В отличие от простого смешивания веществ, при растворении происходит взаимодействие между частицами, образующими раствор.
Выделение теплоты при растворении некоторых веществ тоже указывает на химическое взаимодействие между растворителем и растворяемым веществом.
Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах. Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения.
Непостоянство состава растворов приближает их к механическим смесям.
Механическая смесь — физико-химическая система, в состав которой входят два или несколько химических соединений (компонентов). В смеси исходные вещества включены неизменными. При смешивании не возникает никакое новое вещество.
От механических смесей растворы резко отличаются своею однородностью. Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями.
Процесс растворения
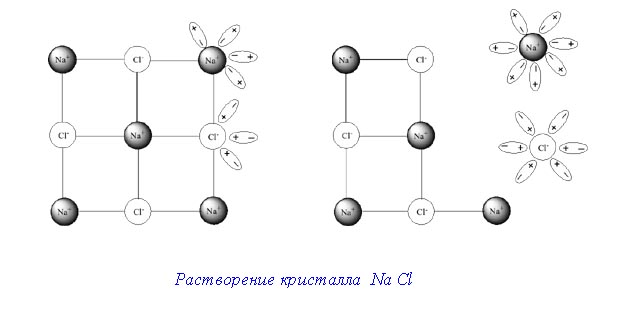
Растворение кристалла в жидкости протекает следующим образом.
Когда вносят кристалл в жидкость, в которой он может растворяться, от поверхности его отрываются отдельные молекулы. Последние благодаря диффузии равномерно распределяются по всему объёму растворителя.
Отделение молекул от поверхности твёрдого тела вызывается, с одной стороны, их собственным колебательным движением, а сдругой – притяжением со стороны молекул растворителя.
Этот процесс должен был бы продолжаться до полного до полного растворения любого количества кристаллов, если бы не происходил обратный процесс – кристаллизация. Перешедшие в раствор молекулы, ударяясь о поверхность ещё не растворившегося вещества, снова притягиваются к нему и входят в состав его кристаллов.
Понятно, что выделение молекул из раствора будет идти тем быстрее, чем большеконцентрация раствора. А так как последняя по мере растворения вещества увеличивается, то, наконец наступает такой момент, когда скорость растворения становится равной скорости кристаллизации. Тогда устанавливаетсядинамическое равновесие, при котором в единицу времени растворяется и кристаллизуется одинаковое число молекул.
Раствор, находящийся в равновесии с растворяющимся веществом, называетсянасыщенным раствором.
Концентрация растворов
Насыщенными растворами приходится пользоваться сравнительно редко. В большинстве случаев употребляются растворы ненасыщенные, т.е. с меньшей концентрацией растворённого вещества, чем в насыщенном растворе.
Концентрацией раствора называется количество растворённого вещества, содержащееся в определённом количестве раствора или растворителя.
Растворы с большой концентрацией растворённого вещества называютсяконцентрированными, с малой – разбавленными.
Концентрацию раствора можно выражать по разному:
1. В процентах растворённого вещества по отношению ко всему количеству раствора.
2. Числом грам-молекул растворённого вещества, содержащегося в 1 литре раствора.
3. Числом грамм-молекул растворённого вещества, содержащегося в 1000 г растворителя
и т.д.
Растворимость
Растворимостью называется способность вещества растворяться в том или ином растворителе.
Мерой растворимости вещества при данных условиях служит концентрация его насыщенного раствора.
Растворимость различных веществ колеблется в широких пределах.
· Если в 100 граммах воды растворяется более 10 г вещества, то такое вещество
принято называть хорошо растворимым.
· Если растворяется менее 1 г вещества – малорастворимым.
· Если в раствор переходит менее 0,01 г вещества, то такое вещество называют
практически нерастворимым.
Принципы, позволяющие предсказать растворимость вещества, пока не известны. Однако, обычно вещества, состоящие из полярных молекул, и вещества с ионным типам связи лучше растворяются в полярных растворителях (вода, спиры, жидкий амиак), а неполярные вещества – в неполярных растворителях (бензол, сероуглерод).
Растворение большинства твёрдых тел сопровождается поглощением теплоты. Это объясняется затратой значительного количества энергии на разрушение кристаллической решётки твёрдого тела, что обычно не полностью компенсируется энергией, выделяющейся при образовании гидратов (сольватов).
Как правило, повышение температуры должно приводить к увеличению растворимости твёрдых тел.
Гидраты и сольваты.
При растворении многих веществ их молекулы или ионы связываются с молекулами растворителя, образуя соединения, называемые сольватами (от латинского solvere – растворять). Этот процесс называется сольватацией.
В частном случае, когда растворителем является вода, эти соединения называютсягидратами, а самый процесс их образования – гидратацией.
В зависимости от природы растворённого вещества, сольваты могут образовываться разными путями.
1. При растворении веществ с ионной структурой молекулы растворителя удерживаются около иона силами электростатического притяжения. В этом случае говорят о ион-дипольном взаимодействии.
2. Может иметь место донорно-акцепторное взаимодействие. Здесь ионы растворённого вещества обычно выступают в качестве акцепторов, а молекулы растворителя – в качестве доноров электронных пар. В таком взаимодействии могут участвовать растворители, молекулы которых обладают неподеленными электронными парами (например, вода, аммиак).
3. При растворении веществ с молекулярной структурой сольваты образуются вследствие диполь-дипольного взаимодействия. Диполи растворённого вщества могут быть при этом постоянными (у веществ с полярными молекулами) или наведёнными (у веществ с неполярными молекулами).
Кристаллогидраты
Вещества, в кристаллы которых входят молекулы воды, называютсякристаллогидратами, а содержащаяся в них вода – кристаллизационной.
Состав кристаллогидратов принято изображать формулами, показывающими, какое количество кристаллизационной воды содержит кристаллогидрат.
· кристаллогидрат сульфата меди (медный купорос), содержащий одну грамм-
молекулу CuSO4 и пять грамм-молекул воды, изображается формулой
CuSO4 · 5 H2O;
· кристаллогидрат сульфата натрия (глауберова соль) изображается формулой
Na2SO4 · 10H2O.
· Алюмокалиевые квасцы могут изображаться формулой:
K2SO4 · Al2(SO4)3 · 24H2O или после сокращения на два: KAl(SO4)2 · 12H2O
Свойства гидратов
Гидраты, как правило, нестойкие соединения, во многих случаях разлагающиеся уже при выпаривании растворов.
Но иногда гидраты настолько прочны, что при выделении растворённого вещества из раствора вода входит в состав его кристаллов.
Прочность связи между веществом и кристаллизационной водой в кристаллогидратах различна. Многие из них теряют кристаллизационную воду уже при комнатной температуре.
Так, прозрачные кристаллы «бельевой» соды (Na2СO3 · 10H2O), если оставить их лежать на воздухе, очень легко «выветриваются», т.е., теряя воду, становятся тусклыми и постепенно рассыпаются в порошок. Для обезвоживания других кристаллогидратов требуется довольно сильное нагревание.
Разница между соединением и смесью
Соединение состоит из различных видов атомов, которые химически связаны. Смесь состоит из двух или более различных видов веществ (атомов, молекул или соединений), которые физически перемешаны. Основн
Содержание:
Соединение состоит из различных видов атомов, которые химически связаны. Смесь состоит из двух или более различных видов веществ (атомов, молекул или соединений), которые физически перемешаны. Основное различие между Соединением и Смесью состоит в том, что соединения химически связаны, а смеси нет.
Эта статья объясняет,
1. Что такое соединение?
— Определение, характеристики, виды склеивания, примеры
2. Что такое смесь?
— определение, характеристики, примеры
3. В чем разница между соединением и смесью?
В некоторых соединениях пропорции содержания атома остаются постоянными и являются уникальными для этого конкретного соединения. Если пропорция отличается, это порождает новое соединение. Этот сценарий разработан на следующих примерах.
Азот и кислород дают начало этим двум соединениям.
N2 (г) + O2 (г) → 2НО(г) Оксид азота или оксид азота
2NO(г) + O2 (г) → 2NO2 (г) Закись азота или диоксид азота
Хотя оксид азота и диоксид азота состоят из одних и тех же элементов, их составы различны. Следовательно, это приводит к двум различным соединениям.
Соединения образуются, когда силы притяжения между атомами-членами больше, чем силы отталкивания. Соединения обычно получают либо ковалентной, либо ионной связью. Энергия либо берется, либо выделяется при создании соединений путем химической связи.
Ковалентная связь
Электроны распределяются между участвующими атомами, как показано ниже. Эти виды соединений называются ковалентными соединениями. Если два атома одинаково притягиваются к электронам (подобная электроотрицательность), соединение неполярно. Однако, если разрыв электроотрицательности между двумя атомами огромен, соединение становится полярным. Молекула воды является лучшим примером этого явления.
Ионная связь
Электроны полностью переносятся с одного атома на другой. Следовательно, электронный заряд появляется на обоих атомах, участвующих в связи. Соединения, рожденные из этих связей, представляют собой в основном твердые вещества с высокой температурой плавления и могут проводить электрический ток. Металлические и неметаллические элементы участвуют в образовании соединений такого типа.
Компоненты соединения не могут быть физически разделены. Их можно отделить только химическими методами или электролизом.
Смесь представляет собой комбинацию двух или более элементов и / или соединений. Хотя эти компоненты присутствуют вместе, они не связаны химически и не создают новые вещества. Хорошим примером является смесь песка и воды, где оба компонента химически не связаны и могут быть отделены в виде отдельных веществ фильтрацией. Другими физическими способами разделения являются выпаривание, дистилляция, хроматография, центрифугирование и экстракция. Для этих методов разделения рассматриваются физические свойства компонентов в смеси. Некоторыми из этих физических свойств являются плотность, размер и растворимость.
Компоненты в соединениях сохраняют свои индивидуальные характеристики. Когда вы попробуете соленый водный раствор, вы почувствуете соленый вкус на своем языке. Это указывает на то, что соль способна выдавать свой характерный вкус даже при смешивании с водой. Смеси не имеют своих собственных свойств, как соединения.
Смеси часто бывают гомогенными или гетерогенными.
Воздух, которым мы дышим, и огромный синий океан можно рассматривать как самые большие смеси, найденные на земле. Оба являются гетерогенными смесями.
Разница между соединением и смесью
облигация
Соединения:Компоненты химически связаны.
Смеси:Компоненты не связаны химически.
разделение
Соединения:Компоненты не могут быть физически разделены. Их можно отделить электролизом.
Смеси:Компоненты могут быть легко разделены физически с помощью таких методов, как фильтрация, хроматография, центрифугирование, диализ, выпаривание и дистилляция.
Характеристики
Соединения: Соединения показывают свои особенности, а не индивидуальные особенности компонентов.
Смеси:Соединения не показывают свои особенности. Индивидуальные особенности компонентов отображаются.
соотношение
Соединения:Соотношение компонентов является фиксированным.
Смеси:Соотношение компонентов может отличаться.
Точка кипения и плавления
Соединения:Температура кипения и температура плавления являются постоянными для конкретного соединения.
Смеси:Температура кипения и температура плавления не постоянны.
Передача энергии
Соединения: Энергия выделяется или используется для приготовления соединений посредством химической связи.
Смеси:Передача энергии отсутствует или незначительна.
категории
Соединения: Соединения могут быть ковалентными или ионными.
Смеси: Смеси могут быть гомогенными или гетерогенными.
«Наша цель» Различают смесь и соединение (теория): класс 9: химия: Amrita Online Lab, Н.п., н.д. Web. 31 января 2017 года. Ophardt, Charles. Введение в Ионные Соединения. Виртуальный Чембук, Elmhurt College, 2003. Веб. 31 января 2017 г.