слизистая пищевода белесоватая что значит
Лейкоплакия
Различают три вида лейкоплакии, которые являются последовательными формами развития одного и того же заболевания:
Причины
Различная локализация лейкоплакии вызывается разными причинами и требует индивидуального подхода в разработке стратегии лечения.
Волосатая лейкоплакия развивается на фоне пониженного и ослабленного иммунитета, поэтому чаще всего такой вид заболевания диагностируют у пациентов с ВИЧ, различными иммунодефицитами и во время реабилитации после трансплантации органов, когда назначается курс иммунодепрессантов.
Точных причин развития этого заболевания во рту официальная медицина по сегодняшний день не знает. Тем не менее, выделен ряд факторов, повышающих шансы на появление лейкоплакии:
Лейкоплакия мочевого пузыря – это затяжное хроническое заболевание, которое характеризуется перерождением клеток переходного эпителия в клетки плоского. Ороговевший эпителий неустойчив к компонентам мочи, что вызывает очаги воспаления в полости мочевого пузыря. Основной причиной развития заболевания является восходящее инфицирование возбудителями, передающимися половым путем. Поэтому лейкоплакия в мочевом пузыре развивается чаще у женщин – их мочевой канал значительно короче мужского, поэтому инфекции легче через него проникнуть.
В отдельных случаях причиной лейкоплакии может стать нисходящее инфицирование, когда с током крови из близлежащих органов проникает возбудитель: стафилококки, протеи, стрептококки, кишечная палочка и другие. Развитию заболевания благоприятствуют:
Лейкоплакией шейки матки называют белесые образования (пятна или бляшки), которые появляются на слизистой оболочке. Для диагностики заболевания достаточно профилактического осмотра с помощью гинекологического зеркала.
Как и дисплазия, лейкоплакия шейки матки требует обязательного лечения, поскольку является предраковым заболеванием. Причин для появления таких изменений тканей немало:
Симптомы лейкоплакии
Лейкоплакия полости рта на фото выглядит по-разному в зависимости от стадии развития заболевания. Все начинается с подсушенных уплотненных очагов белого или светло-серого цвета, которые могут располагаться симметрично с двух сторон или только с одной. Поскольку на этом этапе пациент не испытывает практически никакого дискомфорта, выявить это заболевание можно только во время осмотра у стоматолога.
Без должного лечения лейкоплакия переходит на вторую, веррукозную стадию, на которой пятна на слизистой оболочке уплотняются и утолщаются, становясь похожими на бляшки или бородавки. Эта форма заболевания считается предраковой, ведь образования в любой момент могут трансформироваться в злокачественные.
Симптоматически волосатая лейкоплакия практически не отличается от других, а располагается преимущественно на слизистых оболочках рта симметрично с двух сторон. Свое название волосатая лейкоплакия рта получила за внешний вид материала, снятого с поврежденной поверхности для гистологического исследования.
Лейкоплакия вульвы уже на ранних стадиях характеризуется зудом, который усиливается в ночное время. При расчесывании к поражению слизистой может присоединиться грибковая или бактериальная инфекция, которая вызовет острый воспалительный процесс. На фото лейкоплакия вульвы выглядит как бляшки размером от просяного зерна до пятикопеечной монеты, окруженные валиком, расположение может быть одиночным или распространенным.
Симптоматика лейкоплакии мочевого пузыря сходна с симптомами цистита, что приводит к неверной диагностике и долгому безрезультатному лечению. На первых этапах пациент испытывает тупую ноющую боль в области мочевого пузыря, слегка учащенное и дискомфортное мочеиспускание (особенно при лейкоплакии шейки мочевого пузыря). С прогрессированием заболевания болевые ощущения усиливаются, мочеиспускание учащается, присоединяется чувство не до конца опорожненного мочевого пузыря.
Большинство пациенток только от лечащего врача узнают, что такое лейкоплакия шейки матки, как и о том, что страдают этим заболеванием. В гинекологии оно протекает бессимптомно, в отдельных случаях могут появляться обильные белесые выделения или капли крови после совершения полового акта, а также боли во время него.
Если Вы обнаружили у себя схожие симптомы, незамедлительно обратитесь к врачу. Легче предупредить болезнь, чем бороться с последствиями.
Диагностика
В зависимости от вида заболевания и его локализации различаются методы диагностирования и лечения лейкоплакии у пациентов. При наличии веррукозной или эрозивной формы заболевания необходимо регулярно консультироваться у онколога, чтобы вовремя диагностировать появление злокачественного образования.
Для диагностики врач должен изучить карту пациента и сделать анализ на наличие вирусов, которые являются наиболее частыми возбудителями волосатой лейкоплакии языка и других частей рта.
Самым эффективным исследованием для подтверждения диагноза «лейкоплакия шейки матки» является биопсия – изучение клеточного строения кусочка биоматериала, взятого непосредственно на измененном участке слизистой оболочки.
Лечение лейкоплакии
Лечение лейкоплакии во многом зависит от возраста пациента, стадии заболевания, его локализации, анамнеза и сопутствующих нарушений.
Лейкоплакия наружных половых органов у женщин
Для лечения лейкоплакии вульвы необходимо соблюдать комплекс мер, направленных на нормализацию работы организма в целом:
Лечится лейкоплакия вульвы чаще консервативными методами: физиотерапией в сочетании с препаратами общего и местного воздействия. Дополнительно показаны подмывания отваром ромашки или пищевой соды, которые помогут уменьшить воспаление тканей. Хирургическое вмешательство может использоваться только в случае неэффективности консервативного лечения для предотвращения развития онкозаболевания.
Лейкоплакия шейки матки
Лечение лейкоплакии шейки матки на самых ранних стадиях можно ограничить консервативными методами, однако, бессимптомность этого заболевания в большинстве случаев становится причиной того, что его слишком поздно диагностируют. В большинстве клиник используют хирургические методы с применением современной аппаратуры для удаления ороговевшего участка слизистой оболочки шейки матки: электрокоагуляцию, крио- и лазерную терапию.
Лейкоплакия мочевого пузыря
Для лечения лейкоплакии применяют как медикаментозную, так и хирургическую терапию. Консервативные методы включают прием антибактериальных препаратов для подавления выявленного возбудителя, дополнительные орошения стенок мочевого пузыря и физиотерапевтические процедуры, направленные на уменьшение воспаления и снижения болезненных ощущений.
Если медикаментозное лечение не дает ожидаемого эффекта или болезнь слишком запущена, может быть выбран хирургический метод лечения с применением цитоскопического трансуретрального срезания пораженного участка слизистой оболочки мочевого пузыря. Большинство отзывов после операции по удалению лейкоплакии мочевого пузыря подтверждают высокую эффективность такого лечения, которое при вовремя пролеченных инфекциях не дает рецидивов.
Лейкоплакия пищевода
Самым эффективным лечением этого заболевания является хирургическое вмешательство с применением жидкого азота, лазера или электрокоагулятора, причем именно криохирургия дает самые устойчивые результаты с минимальным количеством рецидивов заболевания.
При лечении лейкоплакии в пищеводе важно придерживаться комплексного подхода: помимо прижигания поврежденных участков, пациенту потребуется пройти курс антибактериальной терапии, а также придерживаться достаточно строгой диеты без алкоголя, тяжелой, острой и соленой пищи.
Лейкоплакия полости рта
Для лечения лейкоплакии полости рта врачи отдают предпочтение консервативным методам лечения, основанным на насыщении организма жирорастворимыми витаминами, а также общем укреплении организма. Течение заболевания непредсказуемо и индивидуально у каждого пациента – некоторые живут десятилетиями с начальной формой лейкоплакии, которая не вызывает дискомфорта, а у других уже спустя несколько месяцев может развиться плоскоклеточный рак. При неэффективности консервативного лечения пациенту показано хирургическое вмешательство с удалением новообразования и его тщательным гистологическим исследованием.
Опасность
Без своевременного лечения самую большую угрозу при лейкоплакиях составляет риск развития злокачественного образования, именно поэтому это заболевание относят к группе предраковых. Особенно подвержены трансформации язвенная и веррукозная формы лейкоплакии, а также локализация заболевания в области языка.
Профилактика лейкоплакии
Ключевыми мерами при профилактике лейкоплакии являются элементарные правила личной гигиены и укрепления иммунитета:
Данная статья размещена исключительно в познавательных целях и не является научным материалом или профессиональным медицинским советом.
Слизистая пищевода белесоватая что значит
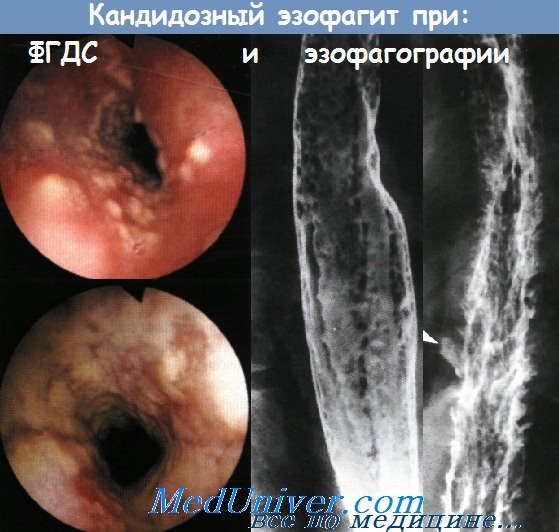
У неспецифического эзофагита, который проявляется болью при глотании и изжогой, существует целое множество причин. Наиболее распространенным этиологическим фактором инфекционного эзофагита является микроорганизм Candida albicans. Риск данного заболевания повышен у пациентов с иммунодефицитом, либо длительно принимающим антибактериальные препараты; основными симптомами являются боль и дисфагия.
Для постановки диагноза исследования только лишь полости рта недостаточно, потому что часто кандидозный эзофагит не сопровождается образованием налетов в полости рта или глотке. Грибковую инфекцию стоит заподозрить при обнаружении при эзофагоскопии белесоватых бляшек с эритематозным основанием. Лечение состоит в назначении топических или системных противогрибковых препаратов. Топическое лечение можно начать с назначения раствора нистатина для полоскания и глотания (400000-600000 ЕД 4 раза в день) или пастилок клотримазола (одна 10 мг пластинка медленно рассасывается 5 раз в день). При применении топических препаратов эффективность лечения зависит от достаточного контакта между препаратом и слизистой оболочкой.
Если топическое лечение оказывается неэффективным, предпочтительно назначение перорального флюконазола. Минимальная начальная нагрузочная доза составляет 200 мг, затем по 100-200 мг в течение 14-21 дня. При неэффективности такого лечения следует взять биопсию с посевом культуры гриба.
Лекарственный эзофагит сопровождается появлением точечных изъязвлений на слизистой пищевода, вызван он постоянным длительным контактом слизистой оболочки с лекарственным препаратом. По всей видимости, лекарственный эзофагит развивается из-за того, что лекарственный препарат медленнее проходит по пищеводу и вызывает его местное химическое раздражение. Наиболее часто лекарственный эзофагит вызывается теграциклинами, хлористым калием, доксициклином, аспирином и бифосфатами.
К основному фактору риска развития лекарственного эзофагита относится неправильный прием медикаментов (прием препарата без достаточного количества жидкости и/или прием препарата сразу перед тем, как принять горизонтальное положение). Степень повреждения может разниться от поверхностного воспаления до формирования глубоких язв и стриктур. Как правило, заболевание разрешается самостоятельно в течение нескольких дней. Самым главным является его предотвращение, а не лечение. По мере заживления пищевода все препараты желательно принимать в жидком виде. В качестве дополнительного лечения могут использоваться антирефлюксные препараты. Также способствует заживлению и защищает слизистую оболочку суспензия сукральфата.
Пациентов нужно предупреждать о том, что лекарственные препараты следует запивать большим количеством воды, а после их приема находиться в вертикальном положении. Если пациент не может пить и принимать пищу из-за выраженных болей при глотании, на небольшой период времени его можно перевести на парентеральное питание и внутривенное введение жидкостей.
К редким воспалительным заболеваниям пищевода относится эозинофильный эзофагит. Согласно заключению рабочей группы Американского общества гастроэнтерологов, эозинофильный эзофагит является клинико-патологическим заболеванием, которое характеризуется следующими признаками:
(1) симптомы включают, но не ограничиваются дисфагией и затруднением прохождения пищи;
(2) потеря аппетита и симптомы гастроэзофагеальной рефлюксной болезни (ГЭРБ) у детей;
(3) наличие более 15 эозинофилов в поле зрения при анализе биоптата слизистой оболочки пищевода.
Причины заболевания неизвестны. В последнее время диагноз эозинофильного эзофагита выставляется все чаще и чаще. Считается, что его природа связана с аллергией. Для объяснения патогенеза эозинофильного эзофагита были предложены две гипотезы. Согласно первой из них, клеточный ответ на определенную пищу или аллергены вызывает продукцию цитокинов. Согласно результатам исследований питающихся элементными смесями детей, перевод на такую гипоаллергенную диету может вести к полному разрешению эозинофилии; следовательно, хотя бы у некоторого числа пациентов эозинофильный эзофагит связан с пищевыми аллергенами.
Согласно второй теории, ГЭРБ приводит к пептическому повреждению межклеточных контактов эпителиальных клеток, в результате чего их проницаемость повышается, а в очаг воспаления мигрируют воспалительные клетки, в особенности эозинофилы. Одним из общепризнанных диагностических критериев является обнаружение 15 и более эозинофилов в поле зрения при исследовании биоптата. Слизистая пищевода уникальна в том отношении, что в норме она лишена эозинофилов. Тем не менее, эозинофилы могут появляться в ней при самых различных заболеваниях, например, при ГЭРБ, болезни Крона, системных коллагенозах, лекарственном эзофагите.
Следовательно, перед постановкой диагноза эзонофильного эзофагита больного требуется тщательно обследовать и исключить все другие возможные причины его состояния. При проведении дифференциальной диагностики необходимо учитывать анамнез пациента, клиническую картину, эндоскопические признаки и точный подсчет эозинофилов под микроскопом. У взрослых обычно не отмечается повышение эозинофилов или IgE в периферической крови. При эндоскопии может отмечаться «трахеолизация» пищевода, когда на его внутренней поверхности появляются кольца. Но в некоторых случаях пищевод может выглядеть абсолютно нормальным, поэтому для постановки диагноза требуется высокая степень настороженности.
К эндоскопическим признакам эозинофильного эзофагита относят появление продольных борозд, кровоточивость, отек, продольные разрывы, возвышающиеся белесоватые бляшки, белый налет, вид слизистой оболочки, напоминающий «гофрированную бумагу», сужение пищевода, временные или постоянные кольца на пищеводе. В обзоре, выполненном Американским обществом гастроэнтерологов, у 86% пациентов обнаруживались кольца, стриктуры или сужение пищевода. И хотя ни один из этих признаков не может считаться патогномоничным, при определенных условиях одновременное наличие нескольких из них может свидетельствовать в пользу эозинофильного эзофагита. Лечение начинается после проведения эндоскопии и взятия биопсии. Возможно назначение местных или системных кортикостероидов, оценка аллергического статуса, пробное исключение возможных аллергенов. При проведении эзофагоскопии следует быть особенно осторожным, потому что пациенты с эозинофильным эзофагитом имеют повышенный риск травматизации слизистой и перфорации пищевода.
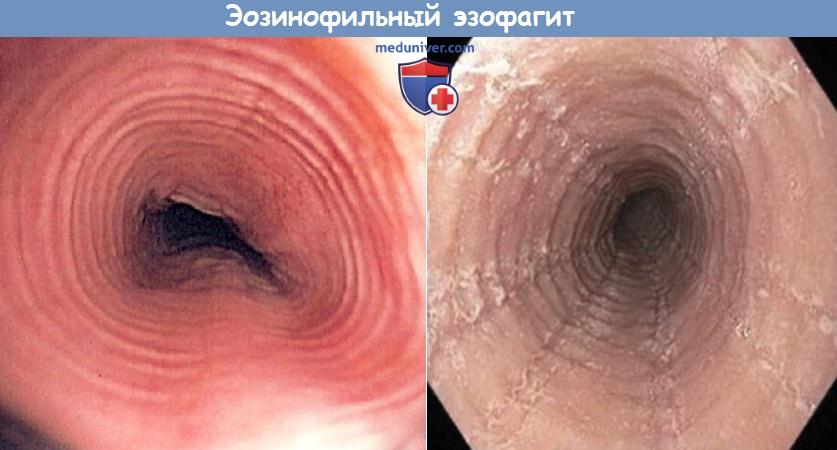
Обратите внимание на отек слизистой оболочки, продольные бороды,
вид слизистой по типу «гофрированной бумаги» и белые налеты.
Полимиозит представляет собой воспалительно-дегенеративное заболевание поперечно-полосатой мускулатуры, которые сопровождается ослаблением функции пораженных мышц. Наиболее частым симптомом полимиозита является слабость проксимальных мышц плечевого пояса и бедер. Если полимиозит сопровождается появлением высыпаний на коже, то такое состояние обозначают как «дерматомиозит». При полимиозите возможно снижение силы перистальтики, дискоординация сократительной активности пищевода, расширение просвета пищевода. При манометрии определяется снижение тонуса верхнего пищеводного сфинктера и уменьшение силы перистальтических волн. Лечение направлено на увеличение силы пораженных мышц и предотвращение внемышечных осложнений.
При дерматомиозите лечение направлено на устранение симптомов со стороны кожи. Чаще всего для обследования и лечения пациенты с полимиозитом направляются к ревматологу. Обычно назначают кортикостероиды, иногда могут использоваться азатиоприн и метотрексат. Длительность приема системных кортикостероидов может составлять один год.
Для ГЭРБ характерен заброс содержимого желудка обратно в пищевод. Это заболевание является наиболее частой причиной эзофагита. Дальнейший заброс пищи в глотку носит название ларингофарингеальной рефлюксной болезни (ЛФРБ) или внепищеводного рефлюкса. К типичным симптомам ГЭРБ относят регургитацию, изжогу, боль за грудиной. К симптомам ЛФРБ относят дисфагию, периодическую дисфонию, желание «прочистить горло», ощущение кома в горле и кашель. Механизм развития ГЭРБ связан с периодическими аномальными сокращениями нижнего пищеводного сфинктера и с растяжением желудка. Механизм развития ЛФРБ изучен менее подробно, но, вероятно, связан с аномальными сокращениями верхнего пищеводного сфинктера.
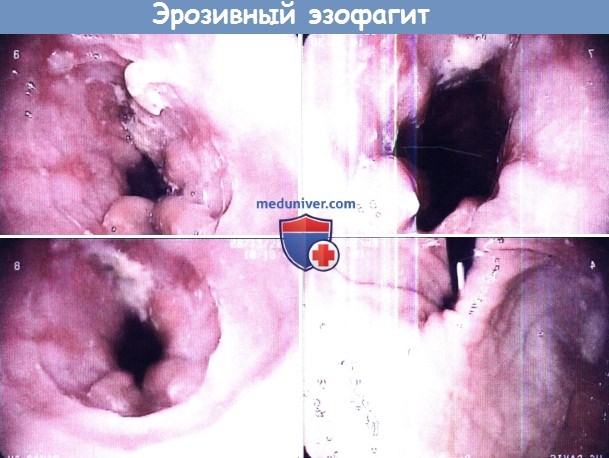
Забрасываться обратно в пищевод может пища, воздух, желудочная кислота, желчные кислоты (желчный рефлюкс), содержимое пищевода (при пищеводно-глоточном рефлюксе). Повреждение пищевода при ГЭРБ может проявляться эрозивным эзофагитом и пептическими стриктурами. Для постановки диагноза рефлюкса обнаружение эндоскопических изменений в пищеводе не требуется (неэрозивная рефлюксная болезнь). Рефлюкс часто сопровождает грыжу пищеводного отверстия диафрагмы. Длительно существующая ГЭРБ повышает риск развития пищевода Баррета и аденокарциномы пищевода. Тем не менее подход со сведением заболеваний в «единый» спектр сменило подразделение ГЭРБ на несколько «категорий»: неэрозивный эзофагит, эрозивный эзофагит, пищевод Баррета; а переход из одной категории в другую является достаточно редким явлением.
По имеющимся данным тяжесть ГЭРБ может со временем усиливаться, но по данным наблюдений за 20 лет процесс идет относительно медленно. Для постановки диагноза ГЭРБ в амбулаторных условиях выполняется pH-метрия и манометрия. Манометрия полезна для подтверждения правильного расположения рН-пробы и для диагностики нарушений моторики. Перед проведением pH-метрии необходимо прекратить прием антисекреторных препаратов. Согласно рекомендациям Американского общества гастроэнтерологов, всем пациентам с ГЭРБ и дисфагией, у которых эмпирическое назначение ингибитора протонной помпы два раза в день оказалось неэффективным, требуется выполнение эндоскопии с биопсией. Лечение рефлюксной болезни состоит в изменении образа жизни и назначении препаратов, снижающих секрецию соляной кислоты, например, ингибиторов протонной помпы.
Сами ингибиторы протонной помпы никак не влияют на рефлюкс, вместо этого они снижают кислотность забрасываемых в пищевод продуктов (повышают pH). К сожалению, даже вещества с нейтральным или слабокислым pH могут повреждать пищевод и вызывать симптомы рефлюкса.
Пищевод Баррета является потенциальным осложнением длительно существующей ГЭРБ. Для данного заболевания характерно превращение нормального плоского эпителия проксимальной части пищевода в цилиндрический эпителий кишечного типа (метаплазия). Пищевод Баррета является самым значительным последствием ГЭРБ, способным привести к развитию аденокарциномы пищевода. Соответственно, всем пациентам с длительно существующим ГЭРБ, особенно мужчинам-европеоидам среднего возраста, рекомендуется периодически проходить эндоскопический скрининг на предмет пищевода Баррета.
При подтверждении диагноза необходимы регулярные эндоскопические осмотры, чтобы вовремя определить развитие дисплазии и аденокарциномы. Риск развития аденокарциномы на фоне существующего пищевода Баррета составляет около 0,5% в год, но значительно возрастает у пациентов с дисплазией высокой степени и с обширным повреждением пищевода (более 3 см). Цель наблюдения — диагностировать рак на ранней стадии, когда еще сохраняется вероятность успешного лечения. Согласно рекомендациям по эндоскопическому скринингу, биопсию следует брать из четырех квадрантов с интервалами по 2 см так, чтобы захваченным оказался весь пораженный участок пищевода. Частота проведения эндоскопии зависит от выраженности дисплазии.
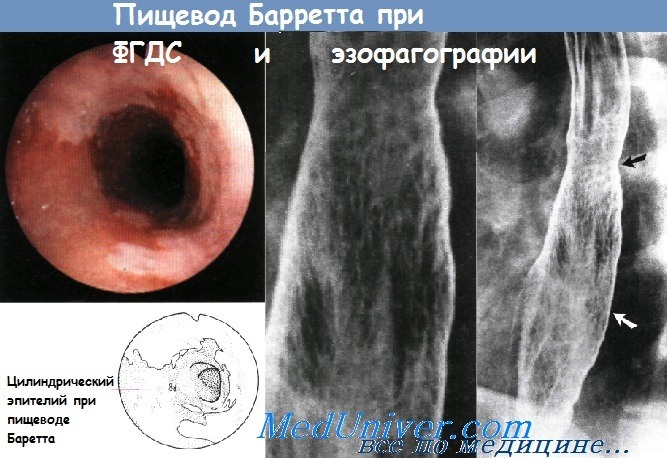
При эзофагографии пищевода Барретта с двойным контрастированием виден сетчатый рисунок слизистой оболочки. В середине пищевода заметны нежные стриктуры с характерным ретикулярным рисунком (черная стрелка), дистально продолжающимся на значительное расстояние от стриктуры (к уровню белой стрелки). Сетчатый рисунок лучше виден на увеличенном изображении.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Кандидоз пищевода: диагностика и современный выбор лечения
Оппортунистические инфекции, включая микозы органов пищеварения, представляют собой актуальную проблему современной гастроэнтерологии.
Оппортунистические инфекции, включая микозы органов пищеварения, представляют собой актуальную проблему современной гастроэнтерологии. Диагностика и лечение кандидоза пищевода в ряде случаев сопряжены с определенными трудностями.
Дрожжи рода Candida широко распространены в окружающей среде. Жизнеспособные клетки Candida spp. могут быть обнаружены в почве, питьевой воде, пищевых продуктах, на коже и слизистых оболочках человека и животных. Таким образом, контакт «открытых систем» индивида (кожи и слизистых оболочек) с этими грибами можно охарактеризовать как ординарный факт.
Исход контакта с дрожжеподобными грибами рода Candida обусловлен состоянием системы антифунгальной резистентности индивида. В большинстве случаев такой контакт формирует транзиторное кандидоносительство, когда структуры и механизмы антифунгальной резистентности обеспечивают деконтаминацию макроорганизма. В то же время у лиц с нарушениями в системе антифунгальной резистентности контакт может сформировать как персистирующее носительство, так и кандидоз. Таким образом, кандидоз пищеварительного тракта имеет типичные черты оппортунистический инфекции.
Заболевание кандидозом пищевода предопределено наличием факторов патогенности Candida spp. В частности, клетки гриба могут прикрепляться к эпителиоцитам (адгезия), а затем через трансформацию в нитевидную форму (псевдомицелий) внедряться в слизистую оболочку и даже «закрытые» системы (инвазия) и вызывать некроз тканей макроорганизма за счет секреции аспартилпротеиназ и фосфолипаз [1]. Перечисленным факторам патогенности естественным образом противостоят многочисленные факторы антифунгальной резистентности. В частности, большое значение имеет целостность слизистой оболочки пищеварительного тракта и мукополисахариды слизи. Защитная роль отводится антагонизму дрожжеподобных грибов и облигатных бактерий пищеварительного тракта, активности пищеварительных ферментов и фунгистатического действия неспецифических гуморальных факторов, таких как лизоцим, комплемент, секреторный IgA, трансферрин, лактоферин и др.
Однако решающее значение в системе антифунгальной резистентности имеет функция клеток фагоцитарного ряда — полиморфноядерных лейкоцитов, в первую очередь, и, в меньшей степени, мононуклеарных фагоцитов и естественных киллеров. Специфический антифунгальный гуморальный ответ реализуется за счет синтеза В-клетками специфических противокандидозных антител классов IgA, IgM, IgG и в определенной степени IgE. Наконец, сложная кооперация дендритных клеток, Т-хелперов 1 и 2 типа, а также Т-регуляторных клеток обеспечивает адекватный специфический клеточный иммунный ответ.
Дефекты в описанной выше системе антифунгальной резистентности являются факторами, способствующими возникновению кандидоза, или так называемыми факторами риска. Группы риска по развитию кандидоза пищеварительного тракта представлены ниже.
В указанных группах кандидоз выявляют чаще обычного. Отметим, что иногда причину нарушения антифунгальной резистентности определить не удается.
Патогенез кандидоза пищеварительного тракта характеризуется последовательным прохождением грибами следующих этапов — адгезии, инвазии, кандидемии и висцеральных поражений. На первом этапе дрожжи адгезируются к эпителиоцитам какого-либо участка слизистой оболочки. В дальнейшем дефекты в системе резистентности позволяют дрожжам через трансформацию в псевдомицелий внедряться (инвазироваться) в слизистую оболочку и подлежащие ткани. Цитопения — решающий фактор, который позволяет инвазирующим грибам достигать стенки сосудов, разрушать ее и циркулировать в сосудистом русле. Такой этап называют кандидемией. В отсутствие адекватной терапии кандидемия приводит к образованию очагов инвазивного кандидоза в висцеральных органах, например, печени, легких, центральной нервной системе и др.
Парадоксально, но внедрение грибов рода Candida чаще наблюдается в участках, представленных многослойным эпителием (полость рта, пищевод) и значительно реже в однослойный эпителий (желудок, кишечник).
На практике клиницисту приходится сталкиваться преимущественно с кандидоносительством, частота которого у здоровых лиц достигает в полости рта 25%, а в кишечнике — до 65–80%.
Объем обследования при кандидозе органов пищеварения включает изучение анамнеза и клинической картины, оценку рутинных клинических тестов, эндоскопические исследования, микологические (культуральные, морфологические и серологические) и иммунологические тесты.
Кандидоз пищевода встречается у больных общего профиля в 1–2% случаев, у больных сахарным диабетом 1 типа — в 5–10% случаев, у больных СПИДом — в 15–30% случаев. В то же время, по сообщению Yoo S.S. и соавт., при эндоскопическом исследовании 6683 практически здоровых лиц у 0,25% выявлен кандидоз пищевода. Среди местных факторов риска называют ожог, ахалазию, дивертикулез, полипоз пищевода. Характерными жалобами являются дисфагия, одинофагия, ретростернальный дискомфорт, однако встречается и латентное течение. Симптомы кандидоза пищевода могут нарушить акт глотания, что в свою очередь приводит к нарушению питания и значительному снижению качества жизни.
Показаниями для эндоскопического исследования с целью исключения кандидоза пищевода является: группа риска, клинические признаки эзофагита и верифицированный кандидоз других локализаций (например, орофарингеальный, кандидоз урогенитальной системы, диссеминированный кандидоз).
Эндоскопические признаки кандидоза пищевода — гиперемия и контактная ранимость слизистой оболочки, а также фибринозные налеты различной локализации, конфигурации и размеров. Среди всего разнообразия визуальных признаков кандидоза пищевода можно выделить три группы типичных изменений:
Напомним, что схожие эндоскопические изменения могут наблюдаться при рефлюкс-эзофагите, пищеводе Барретта, герпес-эзофагите, плоских лейкоплакиях, красном плоском лишае, ожоге или опухоли пищевода. Поэтому диагностика кандидоза пищевода основана на эндоскопическом исследовании и лабораторном изучении биопсийных материалов из пораженных участков. Необходимо учитывать, что при однократной биопсии чувствительность лабораторных методов недостаточна.
«Стандарт» диагностики кандидоза слизистых оболочек — обнаружение псевдомицелия Candida spp. при морфологическом исследовании.
С целью обнаружения псевдомицелия используют морфологические микологические методы: цитологический — с окраской мазков по Романовскому–Гимза, и гистологический — с окраской биоптатов ШИК-реакцией. Таким образом, учет диморфности Candida spp. является ключом к дифференциальному диагнозу между кандидозом и кандидоносительством. В современных условиях клиницист должен требовать от морфолога точного описания морфологических структур гриба, ведь обнаружение отдельных дрожжевых клеток, как правило, свидетельствует о кандидоносительстве, а обнаружение псевдомицелия позволяет подтвердить диагноз кандидоза.
К недостатку морфологических методов можно отнести их ограниченную чувствительность при эндоскопической биопсии. Известно, что биопсионные щипцы позволяют получить для изучения миниатюрный фрагмент ткани, и вероятность обнаружения информативного признака при однократной биопсии недостаточна.
Культуральный микологический метод основан на посеве биоматериалов слизистых оболочек на среду Сабуро. Преимущество данного метода — в возможности видовой идентификации грибов рода Candida и тестирования культуры на чувствительность к антимикотикам. Актуальность таких исследований обусловлена тем, что различные виды Candida, в частности C. albicans, C. tropicalis, C. parapsilosis, C. krusei, C. glabrata и др. имеют различную чувствительность к современным антимикотическим препаратам. Недостаток культурального метода — в невозможности дифференцировать кандидоносительство и кандидоз при исследовании материалов «открытых систем», поскольку слизистые оболочки и в норме могут быть контаминированы колониеобразующими единицами Candida spp.
Культуральное исследование биоматериалов слизистых оболочек с определением вида возбудителя становится строго необходимым при рецидивирующем течении кандидоза или резистентности к стандартной антимикотической терапии.
Чувствительность и специфичность серологических тестов диагностики кандидоза пищевода (иммуноферментный анализ с антигеном Candida, уровень специфического IgE, тест латекс-агглютинации Platelia) пока не достигли требуемой точности и в практике применяются редко.
Кандидоз пищевода, даже протекающий субклинически, опасен своими осложнениями — стриктурой, кровотечением, перфорацией и диссеминацией микотического поражения.
Рентгенографический метод при кандидозе органов пищеварения малоинформативен, так как не уточняет этиологии процесса, но при развитии осложнений (например, стриктура, язва, перфорация) приобретает решающее значение.
Развитие стриктуры пищевода отмечают у 8–9% пациентов с кандидозным эзофагитом. Чаще они локализованы в верхней или средней трети грудного отдела пищевода и вызывают перманентную дисфагию. Другим частым осложнением кандидоза верхних отделов органов пищеварения является кровотечение, вызванное контактной ранимостью слизистой оболочки. Такое хроническое малоинтенсивное кровотечение приводит к анемии, а у пациентов с цитопенией кровотечение может развиваться стремительно (нередко наблюдается рвота алой кровью и псевдомембранозными массами) и приводить к серьезной потери крови. Клиническая картина перфорации пищевода характеризуется, кроме интенсивного болевого синдрома, развитием пневмомедиастинума и подкожной эмфиземы в области шеи.
В план ведения пациентов с кандидозом пищевода необходимо включить диагностику и коррекцию фоновых заболеваний, других очагов кандидозной инфекции, рациональную антифунгальную терапию и иммунокоррекцию. В клинике НИИ медицинской микологии СПбМАПО у пациента с кандидозом пищевода проводится уточнение фармакологического анамнеза, клинический анализ крови, анализ крови «Комбибест ВИЧ-1, 2 Аг/Ат», анализ крови на гликозилированный гемоглобин. Также необходимо исключение наиболее часто встречающихся злокачественных опухолей и в связи с этим — рентгенография легких, фиброколоноскопия, дополнительно для мужчин — УЗИ предстательной железы, дополнительно для женщин — УЗИ молочных желез и малого таза с консультацией гинеколога.
Лечение кандидоза пищевода основано на применении антифунгальных препаратов. Общий принцип действия всех антифунгальных средств — угнетение биосинтеза эргостерина клеточной стенки дрожжей. Антифунгальные средства, используемые для лечения кандидоза в целом, можно разделить на три группы. Первая группа — полиеновые антимикотики, практически нерезорбируемые при приеме per os. К ним относят амфотерицин В, нистатин и натамицин. Вторая группа — азольные антимикотики, относительно хорошо резорбируемые при приеме per os. К ним относятся: кетоконазол, флуконазол, итраконазол, вориконазол, позаконазол. Третья группа — эхинокандины: каспофунгин, анидулафунгин, микафунгин.
Цель лечения кандидоза слизистых оболочек верхних отделов пищеварительного тракта — устранение симптомов и клинико-лабораторных признаков заболевания, а также предотвращение рецидивов.
Нужно подчеркнуть, что при кандидозе пищевода местная терапия неэффективна. У больных с выраженной одинодисфагией, которые не способны глотать, должна использоваться парентеральная терапия.
Препаратом выбора для лечения кандидоза пищевода является флуконазол 100–200 мг/сут, назначаемый перорально или внутривенно в течение 2–4 нед. Подчеркнем, что как средство лечения кандидоза пищевода флуконазол превосходит по эффективности и кетоконазол, и итраконазол в капсулах из-за непостоянной абсорбции последних.
Лишь в случаях непереносимости флуконазола или резистентности возбудителя (чаще это C. krusei, C. glabrata, C. pseudotropicalis) показаны препараты второй линии (также в течение 2–4 недель ). Препаратами второй линии при кандидозе пищевода являются:
Необходимо добавить, что применение нерезорбируемых антимикотиков (нистатин, натамицин) неэффективно.
Несмотря на высокую эффективность флуконазола у пациентов с сохраняющимся иммунодефицитным состоянием высока вероятность рецидивов кандидоза пищевода. Необходимо помнить, что безрецидивного течения кандидоза можно достичь только у больных с полной коррекцией фонового состояния. Так, например, при СПИДе рецидивы кандидоза прекращаются только при успешной антиретровирусной терапии, обеспечивающей снижение вирусной нагрузки и увеличение числа CD4-лимфоцитов.
Для предотвращении рецидивов может быть эффективна длительная поддерживающая терапия флуконазолом (100мг/день) или назначение дозы флуконазола 200 мг еженедельно.
Литература
М.А. Шевяков, доктор медицинских наук, профессор СПбМАПО, Санкт-Петербург