слабый фолликулярный аппарат что делать
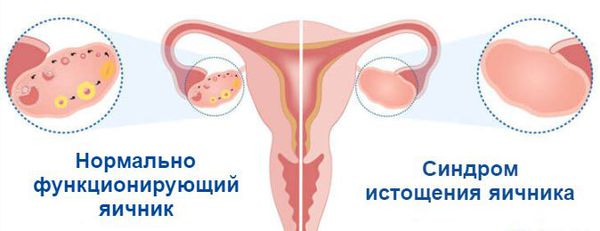
Что такое синдром истощения яичников? Причины возникновения, диагностику и методы лечения разберем в статье доктора Вихаревой М. А., врача УЗИ со стажем в 19 лет.
Определение болезни. Причины заболевания
Причинами заболевания могут быть несколько факторов. Первое место среди них занимает наследственность: если у матери была данная проблема, то с высокой долей вероятности она возникнет и у её дочери. Этот фактор вызван нарушением в половой Х-хромосоме. Именно в ней находится большинство генов, отвечающих за функционирование репродуктивной системы.
К генетическим дефектам, которые вызывают ранний «климакс», относятся:
На втором месте причин появления синдрома — негативное влияние факторов во время внутриутробного развития, когда у девочки идёт закладка фолликулов (части яичника). Приём беременной антибиотиков и других препаратов, которые не рекомендуются при беременности, перенесённое простудное заболевание — всё это откладывает отпечаток на репродуктивное здоровье девочки.
На третьем месте — оперативное вмешательство, например, удаление яичника или его части (резекция яичника), операция по удалению кисты, образования или эндометриоидного очага на яичнике. После удаления одного яичника второй работает усиленно, но этого бывает недостаточно, впоследствии развивается синдром истощения яичников.
Поддерживать функцию яичников очень важно для женщины. Контролировать данный процесс нужно с молодости. Строгая диета, малый вес, отказ от пищи — всё это приводит к разрушению нормальной работы яичников, происходит их разрушение и снижение функции.
Симптомы синдрома истощения яичников
Первым проявлением болезни является нарушение менструального цикла. На первом этапе задержки могут быть до 1-2 недель, а затем до 2-3 месяцев или полугода, вплоть до полного прекращения месячных. В такой ситуации нужно срочно обратиться к врачу. Зачастую женщины готовы пойти на любые жертвы, чтобы улучшить ситуацию, но самолечение, как правило, только ухудшает и ускоряет процесс. Поэтому в первую очередь необходимо посетить врача и сдать все анализы, чтобы правильно оценить ситуацию и начать лечение.
Вероятность того, что женщина при таком синдроме сможет забеременеть, всё же есть, но не большая. Так как синдром истощение яичников — длительный процесс снижения репродуктивной функции, временами менструальный цикл может возобновляться без какого-либо медицинского вмешательства. В этот период может произойти зачатие. Однако в дальнейшем возникает сложность в вынашивании ребёнка.
Патогенез синдрома истощения яичников
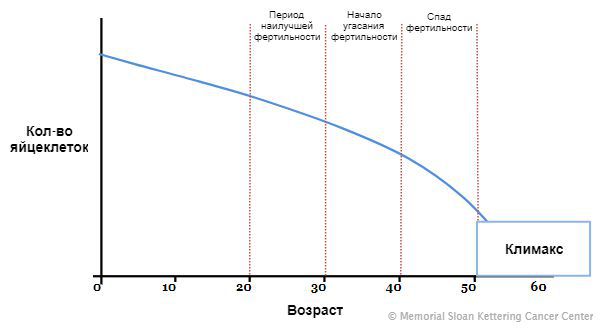
На седьмой неделе внутриутробного развития в организме девочки формируются яичники. В них, в зависимости от генетики, закладывается определённое количество яйцеклеток: обычно около одного миллиона. Их число со временем сокращается, так как новые яйцеклетки после формирования резерва уже не образуются, а уже существующие выделяются в овуляции и постепенно отмирают. Этот естественный процесс приводит к тому, что к 45 годам их количество снижается. Поэтому данный возраст считают окончанием репродуктивного периода. Как только запас яйцеклеток иссякает, яичники перестают вырабатывать женские половые гормоны, ежемесячные менструации прекращаются, и наступает климакс (менопауза) .
Классификация и стадии развития синдрома истощения яичников
В зависимости от причин возникновения синдром истощения яичников бывает двух типов:
Отдельно выделяют классификацию первичного синдрома истощения яичников. Она основана на клинических проявлениях и уровне фолликулостимулирующего гормона:
Также выделяют несколько стадий развития синдрома:
Осложнения синдрома истощения яичников
Со стороны сердечно сосудистой системы могут проявиться осложнения в виде гипертонических кризов (чрезмерного повышения артериального давления), инсультов и инфарктов в молодом возрасте. Проявляются эти осложнения болью в сердце, головной болью, нарушением сознания и координации.
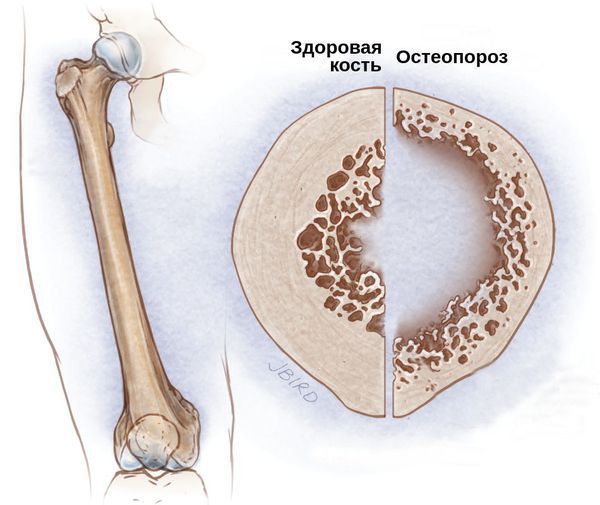
Со стороны костной системы возможны переломы шейки бедра, патологические переломы различных остей и позвоночника, грыжи и осложнённые формы остеохондроза. Развитие подобных осложнений связано с гормональным дисбалансом. Из-за дефицита половых гормонов костный метаболизм начинает ускоряться, что приводит к преобладанию процесса резорбции — разрушения костных тканей и, следовательно, к остеопорозу и переломам.
В самых тяжёлых случаях при отсутствии лечения возникают все перечисленные осложнения.
Диагностика синдрома истощения яичников
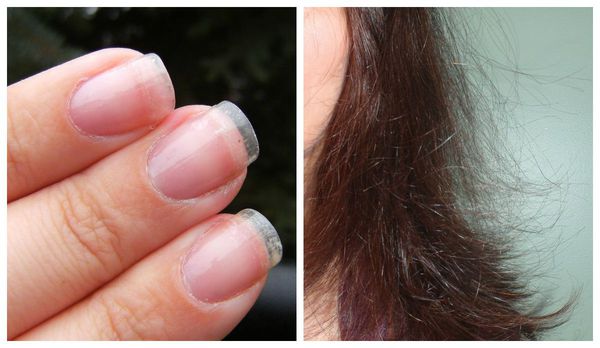
Первичную диагностику осуществляет врач акушер-гинеколог. Он собирает жалобы, изучает историю болезни (анамнез), проводит осмотр. Всё это позволяет заподозрить синдром истощения яичников. Пациентка с таким синдромом выглядит, как правило, старше своих лет: у неё появляются преждевременные морщины, волосы становятся тонкими, безжизненными, тусклыми, ногти — ломкими.
Для подтверждения диагноза необходимо сдать кровь для определения уровня нескольких гормонов: фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ) и эстрадиола. Анализ крови на ФСГ, ЛГ и эстрадиол нужно делать 2-3 раза независимо от цикла. Кровь сдаётся один раз в неделю. На наличие синдрома будет указывать повышение ФСГ, ЛГ и снижение эстрадиола.
Женщинам с семейным анамнезом раннего «климакса» требуется генетическое консультирование для изучения кариотипа женщины (набор хромосом). В рамках данного исследования необходимо сдать кровь из вены.
Лечение синдрома истощения яичников
Основные цели гормонотерапии:
Побочные эффекты гормонотерапии :
Противопоказания к заместительной гормонотерапии:
Физиотерапевтические процедуры также показаны при выявлении раннего «климакса». Они включают в себя:
Прогноз. Профилактика
Если женщина не планирует зачатие ребёнка, ей необходимо продолжать приём гормональных средств до тех пор, пока не наступит естественный климакс. Вылечить бесплодие и восстановить фертильность при синдроме истощения яичников крайне сложно. Наступление беременности у женщин с таким диагнозом возможно только благодаря ЭКО с использованием донорской яйцеклетки. Но если изменения в эндометрии (внутреннем слое матки) из-за гормональных нарушений уже стали необратимыми (атрофическими), то и эту программу выполнить не удастся.
Для профилактики данного заболевания беременная женщина должна внимательно следить за своим здоровьем и стараться оградить свой организм от вредных внешних факторов. Особенно это касается тех, кто вынашивает девочку, так как основной причиной развития синдрома являются заболевания, возникшие у плода во время внутриутробного развития. Саму новорождённую девочку по возможности нужно также ограждать от инфекционных заболеваний и стресса.
С целью профилактического осмотра нужно минимум два раза в год обследоваться у гинеколога. Это позволит выявить синдром на ранних стадиях заболевания и вовремя начать лечение.
Синдром преждевременного истощения яичников
Синдром истощенных яичников – состояние, развивающееся у женщин, не достигших 40 лет, из-за того, что их яичники раньше времени прекращают функционировать.
Эта патология является относительно редкой и диагностируется примерно у 1-2 женщин из 100. Если женщина обратилась врачу по причине развития вторичной аменореи (полного прекращения месячных после того, как менструальный цикл уже установился), вероятность того, что у нее будет выявлен ранний климакс, составляет 1/10.
Причины фолликулярного истощения яичников
Пока еще причины развития раннего климакса изучены не до конца, однако существует ряд теорий, способных объяснить, почему яичники, не имеющие аномалий, неожиданно прекращают функционировать.
Специалисты предполагают, что в основе СИЯ могут лежать иммунологические нарушения, поскольку у многих женщин с этим диагнозом обнаружены такие патологии, как системная красная волчанка или аутоиммунный тиреоидит.
Почти у половины пациенток с этим диагнозом имеются родственницы с такими нарушениями менструального цикла, как позднее менархе, олигоменорея, аменорея и менопауза, наступившая ранее 42 лет.
На основании этих данных ученые предположили, что истощение яичников может происходить вследствие плохой наследственности под влиянием негативных внешних факторов, к которым можно отнести стрессы, контакт с токсичными веществами или, например, инфекционные заболевания.
Нельзя исключать, что повреждение фолликулярного аппарата яичников может быть спровоцировано воздействием химических соединений, токсинов или радиации в перинатальном периоде, а также осложнениями во время беременности матери.
Кроме того, причинами патологии могут являться плохое питание, недостаток витаминов и инфекционные заболевания, перенесенные в раннем детстве.
По мнению ученых, спровоцировать развитие СИЯ может любое хирургическое вмешательство на яичниках.
Симптомы истощения яичников
У женщин выявляются следующие признаки патологии:
Как правило, первые симптомы у пациенток появляются в возрасте 36-38 лет.
Диагностика патологии
В ходе диагностики врач собирает анамнез и назначает тщательное обследование, включающее в себя:
Лечение истощения яичников
Беременность при истощении яичников
Хотя СИЯ нередко именуют ранним климаксом, нужно отметить одно существенное различие между этим состоянием и периодом менопаузы.
Во втором случае процесс атрезии фолликулов и апоптоза (запрограммированной гибели) ооцитов растягивается на достаточно длительное время. По этой причине в течение нескольких лет до наступления климакса возможны овуляторные циклы и, как следствие, естественное зачатие. У женщин с СИЯ спонтанная беременность наступить не может. На основании этих данных специалисты сделали вывод, что синдром истощенных яичников является не ранней менопаузой как таковой, а отдельным патологическим состоянием.
На самых ранних этапах СИЯ есть шансы на наступление беременности в результате стимуляции суперовуляции, однако они крайне малы. В такой ситуации может быть рекомендована программа экстракорпорального оплодотворения с донорскими яйцеклетками.
Если слизистая оболочка матки уже претерпела значительные атрофические изменения, целесообразно проведение процедуры суррогатного материнства с использованием ооцитов донора.
Профилактика патологии
Чтобы снизить риск преждевременного истощения яичников, женщинам рекомендуется:
Кроме того, необходимо:
ПРЕЖДЕВРЕМЕННАЯ МЕНОПАУЗА
Термин «менопауза» образован от греческих «менос» (месяц) и «паузос» (окончание) и означает стойкое прекращение менструации или менструальных циклов, обусловленное выраженным снижением и/или прекращением (выключением) функции яичников. В зависимости
Термин «менопауза» образован от греческих «менос» (месяц) и «паузос» (окончание) и означает стойкое прекращение менструации или менструальных циклов, обусловленное выраженным снижением и/или прекращением (выключением) функции яичников.
В зависимости от времени наступления различают следующие типы менопаузы:
Как преждевременная, так и поздняя менопауза требуют пристального внимания и коррекции возможных нарушений. Ввиду того что всегда трудно оценить, какая менструация была последней, принято оценивать дату менопаузы ретроспективно, а именно: спустя один год после последней менструации.
Возраст менопаузы чаще зависит от наследственности, что убедительно показано на однояйцовых близнецах, когда разница возраста первой и последней менструации у близнецов колеблется в пределах 4-6 мес. Однако важную роль играют болезни, перенесенные данным индивидуумом, и факторы окружающей среды.
Преждевременная менопауза довольно редкое явление (1-2%), однако причин ее возникновения существует множество. Нередко истинную причину установить довольно трудно.
Яичник представляет собой сложную структуру, в рамках которой различают корковый и мозговой слои. В коре яичника внутриутробно закладываются яйцеклетки, окруженные гранулезными клетками, формируя фолликулы с яйцеклетками. К моменту первой менструации в пубертатном периоде в яичниках обнаруживается 300-400 тыс. этих фолликулов. В течение 25-30 лет репродуктивного периода в яичниках постоянно происходит созревание фолликулов, овуляция и гибель (атрезия) фолликулов посредством апоптоза. Лишь 0,1% от числа фолликулов овулирует и может давать жизнь потомству, а 99,9% атрезируется. К возрасту 40 лет остается в среднем около 10 тыс. фолликулов. Кроме того, в яичниках синтезируются как женские (эстрогены и прогестерон), так и, в меньшей степени, мужские половые гормоны. Эти гормоны участвуют в формировании типично женского телосложения и ежемесячно готовят репродуктивные органы к беременности.
Рецепторы к эстрогенам и прогестерону выявлены не только в репродуктивных органах. Гормональные рецепторы (представительства), через которые оказывают свое воздействие половые гормоны, обнаружены в сердце и стенках сосудов, в ЦНС, костной, мочеполовой и других органах и системах организма. Поскольку у молодой женщины половые гормоны выделяются в циклическом режиме, то соответственно органы и ткани испытывают на себе их воздействие также в циклическом режиме.
При преждевременной менопаузе соответственно прекращается циклическое выделение и влияние женских половых гормонов на различные органы и ткани, которые в течение десятилетий испытывали на себе это воздействие. Кроме того, женщина утрачивает и способность к зачатию.
В последние годы все большее распространение получает мнение, что может быть целесообразнее это состояние называть не «преждевременной менопаузой», а «преждевременной недостаточностью яичников». Хотя, по сути, речь идет об одном и том же процессе, но с точки зрения деонтологии терминологически и врачу, и пациенту целесообразнее называть это состояние «преждевременной недостаточностью яичников».
Основные причины преждевременной недостаточности яичников:
Согласно нашей практике преждевременная яичниковая недостаточность отмечается нередко у матери и дочери. Несмотря на то что причин много, но процессы в яичниках в основном происходят по двум основным сценариям:
Клиническая картина
Общее при обоих вариантах:
Основные различия двух форм преждевременной недостаточности яичников заключаются в следующем.
При истощении фолликулярного аппарата:
при резистентности яичников:
При истощении яичников симптомы эстроген-дефицита или симптомы типичного климактерического синдрома более выражены.
При синдроме резистентных яичников менее выражены эстроген-дефицитные симптомы, так как возможны, хотя и проявляются крайне редко, активация функции яичников и, соответственно, улучшение общего состояния.
Тактика ведения больных с преждевременной недостаточностью яичников
Поскольку менопауза преждевременная, а в этом возрасте в норме яичники функционируют, следовательно, преждевременный дефицит половых гормонов может способствовать более раннему появлению типичных климактерических расстройств, частота которых составляет 60-70%.
Классификация климактерических расстройств
Вазомоторные: приливы жара, ознобы, повышенная потливость, головные боли, гипотония или гипертензия, учащенное сердцебиение.
Эмоционально-вегетативные: раздражительность, сонливость, слабость, беспокойство, депрессия, забывчивость, невнимательность, снижение либидо.
Урогенитальные: сухость во влагалище, боль при половом сношении, зуд и жжение, уретральный синдром, цисталгии, недержание мочи.
Кожа и ее придатки: сухость, ломкость ногтей, морщины, выпадение волос.
Сердечно-сосудистые заболевания (ИБС, атеросклероз), постменопаузальный остеопороз или остеопения.
Индивидуальный подбор терапии
Принимая во внимание вышесказанное, представляется важным выработать на долгосрочную перспективу индивидуальную «программу восстановления и сохранения здоровья» с учетом семейного и личного риска основных болезней старения. Такая программа должна включать регулярное обследование, а именно УЗИ, маммографию, денситометрию и/или определение биохимических маркеров костного ремоделирования, липидограмму, онкомаркеры и т. д., а также рекомендации по изменению образа жизни, поскольку повышение двигательной активности, сбалансированная диета, отказ от курения и других вредных привычек способствуют снижению риска сердечно-сосудистых заболеваний и остеопороза.
В последние годы ведется постоянный поиск и совершенствование терапевтических подходов к рациональному использованию ЗГТ у каждой конкретной пациентки (индивидуализация терапии). Препараты для ЗГТ отличаются друг от друга только своим прогестагенным компонентом, так как эстрогенный компонент представлен 17β-эстрадиолом или эстрадиола валератом, которые по структуре соответствуют яичниковому эстрадиолу. Кроме того, в последнее время большое внимание уделяется выбору пути введения препарата (оральный или трансдермальный).
Подбор типа гормонотерапии проводится также с учетом следующих факторов:
Основные принципы и показания для назначения ЗГТ
Необходимо предоставлять женщинам соответствующую информацию, которая позволяла бы им принимать осознанное решение на проведение ЗГТ. Все женщины должны быть проинформированы:
Для обеспечения оптимального клинического эффекта с минимальными побочными реакциями крайне важно определить наиболее приемлемые оптимальные дозы, типы и пути введения гормональных препаратов.
Существуют три основных режима ЗГТ.
Режим 2 и 3 назначается женщинам с интактной маткой.
Монотерапия эстрогенами: прерывистые курсы (эстрофем, прогинова, эстримакс, дивигель, эстрожель, пластырь климара, овестин) или непрерывный режим по 3-4 нед с недельными перерывами.
Комбинированная терапия (эстрогены с прогестагенами) в циклическом режиме:
При этом режиме наблюдается менструальноподобная реакция, что крайне важно в психологическом плане для молодой женщины.
Монофазная комбинированная терапия (эстрогены с прогестагенами) в непрерывном режиме (клиогест, климодиен, паузогест).
При непрерывном режиме гормонотерапии менструальноподобная реакция исключается.
Ливиал (тиболон) в непрерывном режиме обладает эстрогенной, прогестагенной и слабой андрогенной активностью.
Если гистерэктомия произведена по поводу генитального эндометриоза, предпочтение отдается монофазной комбинированной терапии (климодиен, клиогест, паузогест) или ливиалу с целью исключения стимуляции возможных эндометриоидных гетеротопий монотерапией эстрогенами.
Если в клинической картине доминируют изменения в сердечно-сосудистой системе и атерогенные фракции липидов в крови, предпочтение следует отдавать двух- или трехфазным препаратам, в которых гестагенный компонент представлен производными прогестерона (климен, фемостон).
При урогенитальных расстройствах в перименопаузе предпочтение отдается местной (вагинальной) монотерапии эстриолом без добавления прогестагенов. При сочетании урогенитальных расстройств с системными обменными нарушениями (остеопороз, атеросклероз) возможно сочетание местной и системной терапии.
Циклическая двух- и трехфазная ЗГТ наряду с улучшением общего состояния способствует регуляции менструального «цикла», а также профилактике гиперпластических процессов в эндометрии благодаря циклическому добавлению прогестагенов. Крайне важно информировать женщину о следующем:
Итак, комбинированные двух- и трехфазные препараты наиболее приемлемы для женщин с преждевременной менопаузой, так как обеспечивают циклическую защиту эндометрия прогестагенами, подобно тому, как это происходит в нормальном менструальном цикле.
При тяжелых заболеваниях печени, поджелудочной железы, мигренях, артериальном давлении более 170 мм рт. ст., тромбофлебитах в анамнезе показано парентеральное назначение эстрогенов в виде еженедельного пластыря (климара) или геля (дивигель, эстражель). В подобных случаях при интактной матке обязательно добавление прогестерона и его аналогов (дюфастон, утрожестан).
Рекомендуется следующее обследование перед назначением ЗГТ:
Противопоказания для назначения ЗГТ:
При противопоказаниях к ЗГТ решается вопрос об использовании альтернативной терапии: фитоэстрогены (климадинон) или гомеопатические средства (климактоплан).
Гормонотерапию следует продолжать до возраста естественной менопаузы (50-55 лет); в дальнейшем вопрос решается индивидуально с учетом желания женщины, состояния ее здоровья, реакции на гормональные препараты.
В. П. Сметник, доктор медицинских наук, профессор
ГУ Научный центр акушерства, гинекологии и перинатологии РАМН, Москва
(по материалам практических руководств Американского общества Репродуктивной медицины (ASRM, 2012), Европейского общества репродуктологов и эмбриологов (ESHRE, 2012) и собственным научно-клиническим данным (2010-2012) и видеоматериалам)
Способна ли я зачать здорового ребенка? Каковы мои шансы? В последнее время возраст женщины, планирующей беременность, растет, и по поводу бесплодия обращаются женщины старше 35 лет. Очень важным вопросом при работе с супружеской парой среднего и позднего репродуктивного возраста является оценка ресурса яичников в отношении продукции яйцеклеток.
По сути дела, овариальный резерв – это показатель, который характеризует как наличие яйцеклеток в яичнике, так и, косвенно, их полноценность.
Низкий овариальный резерв может быть обусловлен, как уменьшением количества ооцитов, так и их качества.
Точная оценка овариального резерва уже давно была ключевой задачей в области репродуктивной медицины.
Достоверно известно, что во время внутриутробного развития происходит закладка нескольких миллионов «начальных» (примордиальных) фолликулов. До момента начала репродуктивного периода у девочек их яичники находятся в «спящем» состоянии. В 10-13 лет они «просыпаются», начиная вырабатывать гормоны, формируя менструальный цикл. Каждый месяц то в одном, то в другом яичнике начинают расти фолликулы, но, как правило, только один становится доминантным. Именно в нем созревает яйцеклетка и происходит овуляция.
В среднем за время репродуктивного периода у женщины происходит 400-450 овуляций, остальные фолликулы рассасываются, так и не успев вырасти.
В программах ЭКО, под действие сильных гормональных препаратов, добиваются суперовуляции, когда в яичниках созревают до 20 фолликулов одномоментно.
Существует теория, что у млекопитающих в яичниках, есть стволовые клетки, которые способны к неогенезу и формированию новых примордиальных фолликулов в течение всей жизни. Но эта теория, пока не нашла достоверного подтверждения.
В мировом научном обществе термин «снижение овариального резерва» означает уменьшение количества и качества яйцеклеток у женщин с регулярными менструальным циклом, по сравнению с их возрастной группой а также снижение ответа яичников при стимуляции овуляции. Не стоит путать СОР с менопаузой, физиологическим «выключением» яичников или преждевременным истощением яичников, когда полностью прекращается менструальная функция.
В настоящее время ученые не могут понять, связан ли низкий овариальный резерв с более быстрой атрезией фолликулов при нормальном их количестве или изначально малом их формированием во внутриутробном развитии.
Причины снижения овариального резерва
Причинами СОР могут быть как физиологические изменения, так и патологические состояния.
К физиологическим причинам в первую очередь относят возраст женщины. Доказано, что с возрастом число как рассасывающихся фолликулов, так и фолликулов небольшого размера, увеличивается, а значит быстрее уменьшается запас примордиальных фолликулов, что, конечно же, уменьшает возможность получить достаточное количество полноценных яйцеклеток при ЭКО.
Особую роль в снижении овариального резерва играют генетические и аутоммунные факторы. Это те случаи, когда, несмотря на молодой возраст, яичники не способны продуцировать нормальные яйцеклетки. В ряде исследований показана роль мутаций в определенных генах, а также наличие антиовариальных антител в плохом ответе яичников на стимуляцию. Получается, что организм как бы борется со своими яичниками, вырабатывая защитные вещества, «убивая» жизнеспособные яйцеклетки. Причины подобных генетических нарушений пока не известны.
К патологическим причинам снижения овариального резерва относятся:
Интересно, что многие химические вещества, используемые в промышленности и сельском хозяйстве, негативно сказываются на работе яичников. Подобно эстрогенам организма женщины они связываются с их рецепторами, блокируя и нарушая гормональную активность яичников. Не последнюю роль в работе яичников и снижении овариального резерва играет курение. По последним исследованиям, у курящих женщин ответ на стимуляцию яичников в несколько раз ниже, чем у некурящих.
Диагностика состояния овариального резерва
Исследование овариального резерва проводят по нескольким критериям:
К биохимическим маркерам относят уровень ФСГ, антимюллерового гормона (АМГ), эстрадиола. К ультразвуковым – количество антральных фолликулов.
Наибольшее значение в последние годы играет уровень антимюллерового гормона (АМГ).
Уникальность этого гормона состоит в том, что он вырабатывается гранулезой преантральных фолликулов, то есть непосредственно в яичниках. Его уровень начинает расти вместе с ростом фолликула и снижается, когда фолликул становиться более 8 мм и переходит в доминантный.
Именно с этим связаны рекомендации о том, что исследование содержания этого гормона необходимо проводить на 2-3 дни цикла.
Наибольшее применение АМГ получил в программах экстракорпорального оплодотворения.
По данным литературы, низкий уровень АМГ сочетается (но не всегда предопределяет) с «бедным» ответом яичников на проводимую стимуляцию овуляции, низким качеством яйцеклеток и сниженным количеством успешных беременностей в результате проведения ЭКО.
Довольно часто женщинам с низким АМГ отказывают в стимуляции, предлагая донорские программы. Это связано с тем фактом, что при уровне АМГ от 0,2 до 0,7 нг/мл получают в среднем до 3 фолликулов и получают яйцеклетки всего в 2-4 % случаев (специфичность исследования 78-92% и чувствительность 40-97%).
Тем не менее, исследования зарубежных специалистов доказывают, что не следует так категорично подходить к этому вопросу. По данным этого исследования у женщин с АМГ от 0,16 до 0,5 нг/мл, средний возраст которых составлял 39,3 года, в процессе стимуляции получали до 6 яйцеклеток и почти в 26% случаев наступила беременность. Но, что более удивительно, у женщин с АМГ менее 0,16 нг/мл, средний возраст которых составлял 40,2 года, получали до 4 яйцеклеток и беременность наступила в 19% случаев.
Поэтому, несмотря на большее значение АМГ при бесплодии в программах ЭКО, не стоит оценивать ситуацию только основываясь на его показателях.
По-прежнему немаловажную роль в качестве маркеров овариального резерва играют ФСГ и эстрадиол. По данным ВОЗ возможно прогнозировать слабый ответ яичников на стимуляцию (не более 2-3 фолликулов) при значениях ФСГ более 10 МЕ/л (специфичность от 80 до 100%), в то время как чувствительность может варьировать от 10 до 80%.
Наличие нормального показателя базального ФСГ при уровне эстрадиола не более 60-80 пг/мл также ассоциируют со снижением овариального резерва и низкой частотой наступления беременности.
Это исследование проводится в раннюю фолликулярную стадию, при этом подсчитывается количество фолликулов в размере от 2-10 мм в обоих ячниках. Этот метод имеет хорошую специфичность от 70-100%, но низкую чувствительность: 9-70% даже при низких показателях (не более 3-4 фолликулов в обоих яичниках).
Учитывая данные о состоянии овариального резерва в программах вспомогательных репродуктивных технологий при бесплодии проводится индивидуальный подбор протокола в каждом случае.
Дискуссионные вопросы тактики ведения пациенток с бесплодием и кистами яичников
До сих пор ведутся дискуссии по поводу проведения программы ЭКО при наличии кист яичников. Согласно рекомендациям Европейского общества репродуктологов и эмбриологов возможно проведение программ вспомогательных репродуктивных технологий при наличии эндометриоидных кист яичников не более 2-3см. В данном случае идет речь только об этом типе кист (эндометриомы), поскольку подозрение при УЗИ на кистому, особенно неоднородной структуры, обязательным является проведение гистологического исследования.
С одной стороны киста сама по себе уменьшает овариальный резерв, постепенно «поглощая» здоровую ткань яичника. К тому же ни один врач не даст 100% ответа о природе кисты (не даст гарантии, что киста не является злокачественной), пока её не удалят и не проведут гистологическое исследование, а также не предскажет, как она себя поведет во время приема больших доз гормональных препаратов во время стимуляции.
Но, к сожалению, у некоторых женщин нет времени ждать, пока яичники «реанимируются» после операции. В силу возраста или перенесенных ранее оперативных вмешательств на яичниках у такой группы больных овариальный резерв снижен. Такие ситуации очень сложны для репродуктологов, т.к. им необходимо учесть множество факторов: возраст женщины, размеры кисты, одно- или двустороннее их расположение и оценить насколько риск удаления кисты и повреждения яичника выше риска неудачи ЭКО или злокачественного перерождения образования после стимуляции.
Появление новых технологий и энергий, используемых во время операций, значительно помогает решить эту задачу. В частности, в последние годы нами и зарубежными коллегами доказано щадящее воздействие аргоноплазменной коагуляции на ткань яичника при удалении кист яичника, положительное влияние на состояние овариального резерва, а также улучшение отдаленных результатов (восстановление овуляции и наступление беременности как естественной, так и в программах ЭКО).
Основными преимуществами арогоноплазменной коагуляции являются:
В видеопримере ниже показан этап обработки ложа удаленной кисты с использованием современного вида энергии: аргоноплазменной коагуляции. Через 2 месяца в этом яичнике у пациентки произошла первая овуляция.
Данный вид энергии используется также при проведении лапароскопии по поводу наружного генитального эндометриоза, ретроцервикального эндометриоза, при обработке ложа удаленных миоматозных узлов, при лечении шейки матки и ряде других заболеваний в гинекологии.
В зависимости от стадии наружного генитального эндометриоза, вида кист яичников нами разработаны и апробированы протоколы, применение которых обеспечивает щадящий деструктивный эффект.
И не следует отчаиваться при «плохих» результатах предоперационного обследования, т.к. снижение овариального резерва ещё не означает неспособность к зачатию и рождению здорового малыша.
Основная используемая литература: