слабый антиген d что это
Слабый антиген d что это
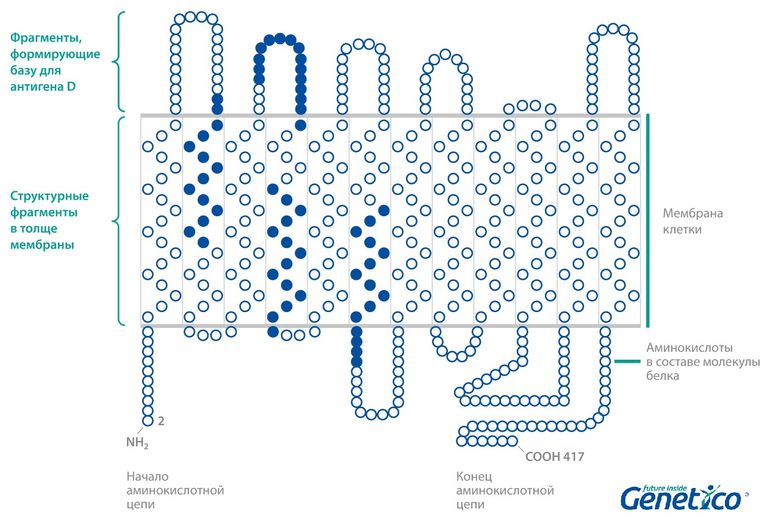
В этой статье мы расскажем о редких вариантах гена RHD и особенностях оценки риска возникновения резус-конфликта. Гены RHD и RhCE у человека работают вместе: они кодируют белки, которые формируют в мембране комплекс, образовывающий базу для антигенов D (резус-фактор), C, c, E, e. Эти белки представляют собой как бы нитки, прошивающие мембрану петлями: их небольшие фрагменты торчат из мембраны, а основная часть находится в ее толще. То есть какие-то аминокислоты белка выполняют строительную функцию – держат белок в мембране, а другие основную – формируют площадку для антигена.
Если гена RHD нет из-за делеции этого участка хромосомы, то и белка на мембране нет. В таком случается получается истинный Rh- фенотип. Однако в редких случаях ген RHD не полностью отсутствует, а несет в себе мутацию. Тогда структура соответствующего белка может нарушаться и приводить не к полному отсутствию антигена D, а к разным промежуточным состояниям. Например, мутации, приводящие к изменению в тех частях белка, которые находятся в толще мембраны, могут влиять на способность белка держаться на поверхности клетки: то есть и ген RHD на месте, и белок нормально синтезируется, однако он с трудом встраивается в мембрану и потому его может быть настолько мало на поверхностях клеток, что иммунная система человека будет их замечать, а вот биохимические методы анализ на резус-фактор – не будут. В случае такого рода мутаций в гене RDH генотип называется Weak D или DEL вместо Rh-. Также при мутациях, затрагивающих выступающие из мембраны участки, антиген D будет неполноценным, так как площадка для его формирования будет неполная или не совсем верная, что тоже может привести к ложным результатам при биохимическом анализе крови. Такой генотип носит название Partial D.
Почему все это важно? Дело в том, что чаще всего статус резус-фактора определяют биохимически по анализу крови. Это значит, что в лаборатории есть антитела к антигену D, эти антитела капают на специально подготовленный препарат крови и смотрят, насколько сильно будет светиться специфическая метка. Если она светится слабо или сигнала нет совсем – это означает, что антителам не с чем было связываться, то есть антигена D на поверхности клеток в анализируемой крови не было. Для обычной ситуации – присутствие или отсутствие гена RHD – этот способ прекрасно работает, но он не позволяет отличить Rh+ гомо- и гетерозигот, поэтому его используют как скрининговый – простой и недорогой метод для первичного обследования. Однако в случае частичной делеции RHD или различных мутаций он срабатывает неправильно. При проверке работы четырех разных наборов реагентов для биохимического анализа крови на резус на 500 образцах для 2% образцов были получены неоднозначные результаты. После генетического тестирования оказалось, что именно эти образцы имели генотип Partial D или Weak D.
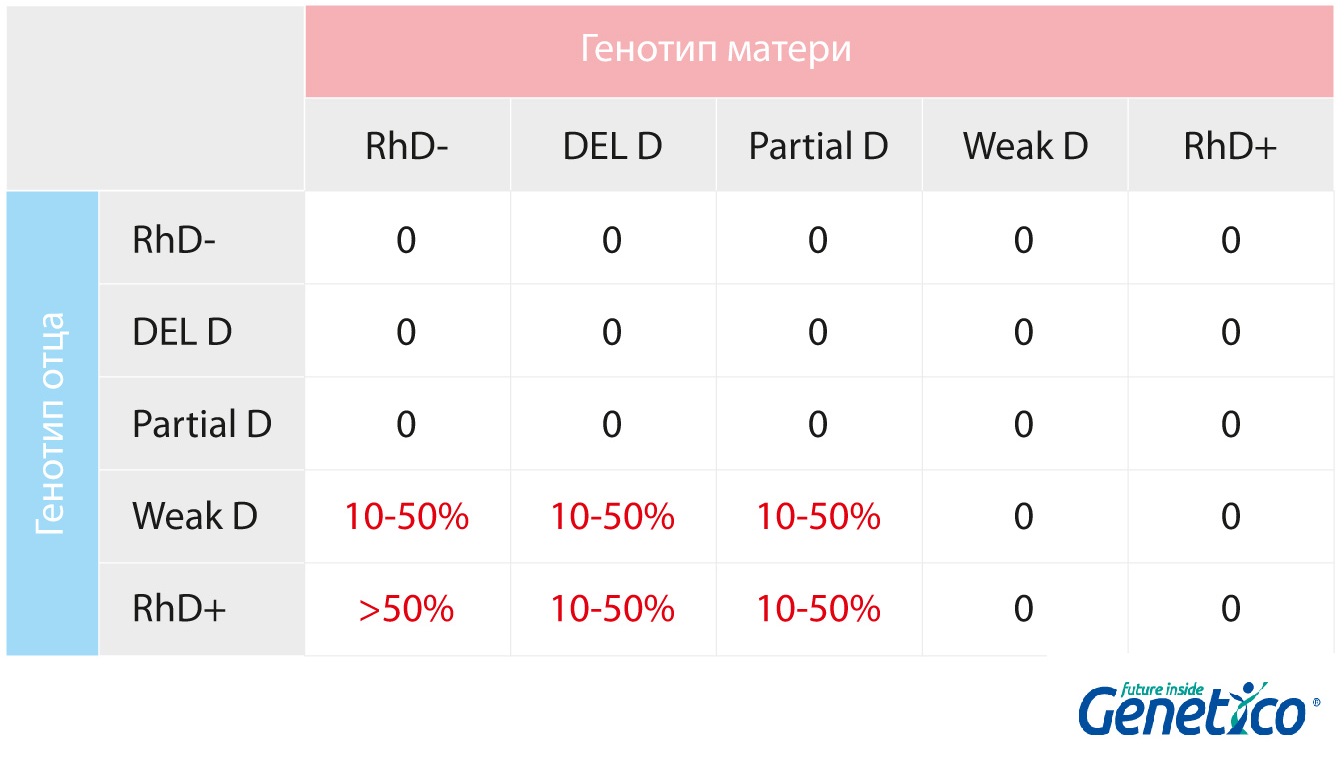
Примерные оценки вероятности развития резус-конфликта при разных сочетаниях генотипов родителей:
Опасность неправильного определения резус-статуса в сложных ситуациях заключается в том, что пара не будет подозревать о рисках, пока не возникнет опасная для жизни и здоровья малыша ситуация. Важно понимать, что главной проблемой при резус-конфликте является то, что организм матери не знаком с антигеном D как с нормальным, «своим», поэтому клетки, отмеченные этим антигеном, начинают отторгаться. При этом иммунная система может познакомиться с этим антигеном как со «своим» даже если этого антигена на поверхности клеток совсем немного, настолько немного, что биохимические методы ставят статус Rh-. В таком случае тревога о возможности развития резус-конфликта у женщины с таким неверным биохимическим анализом будет ложной. С другой стороны, если такой неверный результат будет выдан будущему отцу, то это может привести к развитию резус-конфликта, так как несмотря на биохимически отрицательный резус, ген RHD у отца присутствует и антиген D на поверхности клеток тоже есть. Таким образом, наиболее точный результат получается в результате генетического анализа гена RHD и гена RHCE, методом MLPA. Он позволит идентифицировать наличие/отсутствие гена RHD у будущих родителей, идентифицировать особые состояния этого гена, выявить гомо/гетерозиготность каждого партнера по этим показателям и более эффективно оценить не только вероятность развития резус-конфликта, но и целесообразность различных превентивных или терапевтических мер по устранению этого осложнения при беременности.
Важно помнить, что эти необычные ситуации все же редкость, и в большинстве случаев простой биохимический анализ крови дает верный результат. То есть после него резус-положительные женщины чаще всего спокойно беременеют вне зависимости от генотипа мужа по гену RHD, у резус-отрицательных женщин с резус-отрицательным партнером в большинстве случаев также нет проблем, а резус-отрицательные будущие мамы с резус-положительным отцом отправляются на дополнительные анализы для оценки рисков. Однако, к сожалению, вероятность несовпадения биохимического результата и истинного фенотипа, хоть и мала, но присутствует и может привести к катастрофическим для семьи результатам. Самое безопасное решение – узнать свой генотип по этим генам, который позволит совершенно точно узнать о том, есть ли повод для беспокойства.
Определение группы крови и резус принадлежности
Крайне важное значение для клинической практики имеет определение антигенов эритроцитов – идентификация группы крови и резус-фактора. Группа крови человека определяется наличием на поверхности эритроцита антигенов и является индивидуальным признаком. Эритроцитарные поверхностные антигены эритроцитов определяет фенотип эритроцитов или группу крови человека.
В настоящее время известно более 200 антигенов эритроцитов, поэтому группа крови может отличаться в зависимости от количества используемых антисывороток для идентификации антигенов на поверхности эритроцитов. Эритроцитарные антигены, идентифицированные в популяции в 1% случаев, считаются редкими.
Основной системой идентификации групп крови является система АВО, в которой группа крови характеризуется наличием на поверхности эритроцитов антигенов А, В, АВ или их отсутствием (О), т.е. четыре группы крови. В некоторых руководствах встречается дополнительная маркировка групп крови: О (I); А(II); В (III) и АВ (IV).
Выявление в 1901 г. эритроцитарных антигенов положило начало изучению допустимости смешивания эритроцитов разных групп, т.е. совместимости гемотрансфузий. В крови (сыворотке) каждого индивидуума циркулируют антитела (называемые так же агглютинины), активные в отношении чужеродных антигенов. Взаимодействие антиген-антитело приводит к агглютинации (слипанию) и разрушению эритроцитов. В крови индивидуумов с группой крови А циркулируют антитела против антигенов В. Индивидуумы с группой крови В имеют антитела, против антигенов А. При группе крови О в сыворотке определяются антитела анти-А, анти-В, тогда как при группе крови АВ ни антитела А, ни антитела В в сыворотке не определяются.
Таким образом, индивидуумы с группой крови АВ являются универсальными реципиентами иногрупной крови.
Индивидуумы с группой крови О, эритроциты которых не имеют на поверхности ни А, ни В антигенов, являются универсальными донорами.
Антитела к эритроцитарным антигенам А или В являются генетически детерминированными, в соответствии с группой крови эритроцитов, тогда как антитела к другим поверхностным антигенам эритроцитов являются приобретенными. Пациенты, получающие трансфузии, со временем накапливают антитела, что может осложнять подбор требуемой группы крови. Для таких пациентов важно выполнять типирование группы крови с оценкой возможно большего спектра антител сыворотки.
Группа крови оценка совместимости
Для оценки совместимости групп крови и возможности трансфузий необходимо исследование реакции антител сыворотки донора и эритроцитов реципиента, а также эритроцитов донора и антител сыворотки реципиента.
При совместимости групп крови смешивание эритроцитов и сыворотки не приводит к изменению состава и окраски реакционной капли.
При несовместимости групп смешивание эритроцитов донора и сыворотки пациента вызывает реакцию агглютинации – образование в капле неоднородностей в виде слипшихся эритроцитов, точечно насыщающих поле реакции.
Резус-фактором (Rh) называют антиген D, который может располагаться на поверхности эритроцитов. Наличие или отсутствие этого антигена на поверхности эритроцитов индивидуума определяет такую характеристику группы крови, как резус положительная или резус отрицательная (Rh+ или Rh–). Примерно 85% популяции людей имеют резус-положительную группу крови (Rh+).
В отличие от антител к антигенам АВ, антитела к антигену D не присутствуют в крови. При контакте крови резус-положительной группы с резус-отрицательной, происходит сенсибилизация и синтез анти-резусных антител. Такая реакция развивается, например, при беременности Rh– матери Rh+ плодом. Выход фетальных клеток во время родов в кровоток матери активизирует синтез антирезусных антител. В случае пересечения антирезусными антителами плацентарного барьера и попадания в кровь плода, развивается гемолитическая желтуха новорожденного, обусловленная разрушением эритроцитов.
Определение резус фактора необходимо для каждого индивидуума в дополнение к определению группы крови. Отмечено, что выраженность структуры эритроцитарного антигена различна у здоровых людей и тем более у иммуноскомпроментированных больных, беременных женщин.
В настоящее время определение групп крови, резус фактора, продукции антиэритроцитарных антител выполняется в автоматическом режиме стандартизированными методами, позволяющими одномоментно проводить как типирование групп крови, определение продукции антител, так и совместимости возможных трансфузий. Визуальное отображение полученной карты для каждого пациента может быть востребовано в течение всей жизни пациента, она хранится в базе данных лаборатории.
Показания к исследованию: Любое стационарное лечение, беременность.
Условия взятия и хранения образца
Для исследования используется венозную кровь, взятую с ЭДТА или без консервантов. Взятие крови производится натощак, или не менее чем через 8 ч после последнего приема пищи. Образец крови может храниться при температуре от 4–8 °С не более 24 ч.
Группа крови системы АВО:
При выявлении подтипов (слабых вариантов) групповых антигенов результат выдается с соответствующим комментарием, например, «выявлен ослабленный вариант А2, необходим индивидуальный подбор компонентов крови».
При выявлении слабых и вариантных подтипов антигена D выдается комментарий: «выявлен слабый резус-антиген, рекомендуется при необходимости выполнять трансфузию резус-отрицательных компонентов крови».
Слабоположительный резус-фактор
Резус-фактор — это особый белок, расположенный на мембране эритроцитов человека. Присутствует он примерно у 85% людей. Его строение передаётся по наследству и в течение жизни не меняется. Антигенов, которые кодируют систему резус, существует около шестидесяти. Но важная клиническая значимость отводится только антигену D, вследствие того, что он обладает высокой иммуногенной активностью.
Около 1% людей обладают слабоположительным вариантом антигена D резус-фактора — D weak, он же, «Du»
Еще совсем недавно такой фенотип определялся как отрицательный. При обычных методах определения резус-принадлежности, ранее было сложно идентифицировать «слабый» антиген. Но с применением новых иммуногенетических методов, определить наличие «слабоположительного» Rh не составляет сложности.
Классический антиген D cостоит из 36 составных частей (эпитопов). Это своего рода гигантская белковая молекула, которая состоит из 417 компактно уложенных аминокислот. И, зная молекулярную структуру антигена D, можно объяснить появление его «слабых» и «частичных» вариантов. Вследствие генной мутации в структуре антигена происходит молекулярная перестройка, что приводит к изменению части белковой молекулы и замене нуклеотидных последовательностей в гене.
Среди множества вариантов Rh(D) принято выделять 3 основных:
1)слабый антиген D — “Du” или “D weak” (его количество на мембране эритроцита снижено), 2)парциальный или D-вариантный, у которого отсутствует какой-либо из структурных частей — так называемых эпитопов; 3) DEL (Эритроциты с антигеном DEL обычно идентифицируют как Резус-отрицательные при использовании серологических методов идентификации).
История открытия:
Слабоположительный резус-фактор (Фенотип Du) описан врачом и исследователем Фредериком Страттоном в 1946 году как новый вариант антигена, слабо реагирующий с анти-D идентифицирующими сыворотками.
Он характеризуется именно количественными, а не качественными различиями, в отличие от парциального варианта: при данном типе резус-принадлежности количество антигенов на эритроците снижено. В большинстве случаев это обусловлено генетическими причинами. Выявление weak D как у доноров, так и у реципиентов имеет большое клиническое значение для профилактики посттрансфузионных осложнений (когда иммунная система реципиента распознает антиген Д как чужеродный и запускает выработку антител к нему). При этом наиболее эффективным методом определения слабоположительного варианта антигена D является генотипирование, то есть определения точной последовательности нуклеиновых кислот. Доноры, на эритроцитах которых присутствует слабый D-антиген, должны быть отнесены к резус-положительным, и их кровь не должна переливаться резус-отрицательным пациентам. А реципиенты с таким резусом считаются резус-отрицательными, таким пациентам можно переливать кровь только с отрицательным резус-фактором, во избежание иммунного ответа — разрушения эритроцитов после гемотрансфузии.
Резус-фактор
Основной поверхностный эритроцитарный антиген системы резус, по которому оценивают резус-принадлежность человека.
Антиген Rh — один из эритроцитарных антигенов системы резус, располагается на поверхности эритроцитов. В системе резус различают 5 основных антигенов. Основным (наиболее иммуногенным) является антиген Rh (D), который обычно подразумевают под названием резус-фактор.
Эритроциты примерно 85% людей несут этот белок, поэтому их относят к резус-положительным (позитивным). У 15% людей его нет, они резус-отрицательны (негативны).
Наличие резус-фактора не зависит от групповой принадлежности по системе АВ0, не изменяется в течение жизни, не зависит от внешних причин. Он появляется на ранних стадиях внутриутробного развития, у новорожденного уже обнаруживается в существенном количестве.
Определение резус-принадлежности крови применяется в общей клинической практике при переливании крови и ее компонентов, а также в гинекологии и акушерстве при планировании и ведении беременности.
Несовместимость крови по резус-фактору (резус-конфликт) при переливании крови наблюдается, если эритроциты донора несут Rh-агглютиноген, а реципиент является резус-отрицательным. В этом случае у резус-отрицательного реципиента начинают вырабатываться антитела, направленные против резус-антигена, приводящие к разрушению эритроцитов.
Переливать эритроциты, плазму и особенно цельную кровь от донора к реципиенту нужно строго соблюдая совместимость не только по группе крови, но и по резус-фактору.
Присутствие и титр уже имеющихся в крови антител к резус-фактору и других аллоиммунных антител можно определить, указав тест «анти-Rh (титр)».
Определение группы крови, резус-фактора, а также наличия аллоиммунных антиэритроцитарных антител должно проводиться при планировании или во время беременности для выявления вероятности иммунологического конфликта матери и ребёнка, который может приводить к гемолитической болезни новорождённых.
Возникновение резус-конфликта и развитие гемолитической болезни новорождённых возможно в том случае, если беременная резус-отрицательна, а плод — резус-положителен. В случае, если у матери Rh +, а плод — резус-отрицателен, опасности гемолитической болезни для плода нет.
Гемолитическая болезнь плода и новорожденных — гемолитическая желтуха новорожденных, обусловленная иммунологическим конфликтом между матерью и плодом из-за несовместимости по эритроцитарным антигенам.
Болезнь может быть обусловлена несовместимостью плода и матери по D-резус- или АВО-антигенам, реже имеет место несовместимость по другим резус- (С, Е, с, d, e) или М-, N-, Kell-, Duffy-, Kidd-антигенам (по статистике 98% случаев гемолитической болезни новорожденных связаны с D-резус-антигеном).
Любой из указанных антигенов, проникая в кровь резус-отрицательной матери, вызывает образование в её организме специфических антител. Последние через плаценту поступают в кровь плода, где разрушают соответствующие антигенсодержащие эритроциты.
Предрасполагают к развитию гемолитической болезни новорождённых нарушение проницаемости плаценты, повторные беременности и переливания крови женщине без учёта резус-фактора и др. При раннем проявлении заболевания иммунологический конфликт может быть причиной преждевременных родов или повторных выкидышей.
В настоящее время существует возможность медицинской профилактики развития резус-конфликта и гемолитической болезни новорождённых. Все резус-отрицательные женщины в период беременности должны находиться под наблюдением врача.
Рассмотрим некоторые варианты сочетания генов, определяющих наличие резус-фактора, у родителей и ребёнка:
отец резус-позитивный (гомозигота, генотип DD), у матери резус-отрицательный (генотип dd). В этом случае все дети будут резус-положительными (вероятность 100%);
отец резус-позитивный (гетерозигота, генотип Dd), мать резус-отрицательная (генотип dd). В этом случае вероятность рождения ребёнка с отрицательным или положительным резусом одинакова и равна 50 %;
отец и мать гетерозиготы по данному гену (Dd), оба резус-позитивны. В этом случае возможно (с вероятностью около 25%) рождение ребёнка с отрицательным резусом.
Слабый антиген d что это
Аутоиммунные свойства крови являются одним из важнейших для практической медицины разделов нормальной физиологии. Своевременная трансфузия компонентов крови ежедневно спасает жизни многих людей. К сожалению, не всегда удается избежать грозных осложнений, вызванных переливанием крови. Тем более важным в образовании врачей представляется глубокое проникновение в суть аутоиммунных процессов. Наибольшее число проблем, связанных с переливанием крови, обусловлено высоким полиморфизмом самой иммуногенной из 30 систем групп крови –системы группы крови резус. Представление об иммуногенетической характеристике резус-антигенов необходимо для понимания механизмов несовместимости переливаемой крови и позволит снизить число трансфузионных осложнений.
1. Номенклатура антигенов системы RH
Система группы крови RH (резус) была открыта в 1940 г. Карлом Ландштейнером и Александром Винером [21]. Система RH представлена несколькими десятками антигенов, многие из которых возникли вследствие генных мутаций. В наши дни в научной литературе в основном применяются две номенклатуры антигенов системы резус: Фишера-Рeйса (Fisher-Race) и Винера (Weiner). По Фишеру-Рeйсу [31] наиболее клинически значимые антигены системы Rh обозначаются литерами D, С, Е, си е, по Винеру– Rh0,rh΄,rh΄΄,hr΄и hr΄΄ соответственно [37]. По убыванию иммуногенности резус-антигены располагаются в следующей последовательности:D, c, E, C и e. Антиген D встречается у 85% европейцев, С – у 70%, с– у 85%, Е– у 30%ие– у 97%.
2. Гены. Структура антигенов
Клинически значимые резус-антигены кодируются двумя тесно связанными генами – RHD и RHСЕ. Эти гены располагаются в локусе RH 1-й хромосомы. Ген RHСЕ имеет аллели RHce, RHCe и RHcE [7]. Ген RHD парного аллеля не имеет. Отсутствие рецессивного аллеля гена RHD, связанное чаще всего с делециейэтого гена [32], принято обозначать прописной литерой d. Аллели локуса RH всегда наследуются вместе в различных комбинациях: DCE, DCe, DcE, Dce, dCE, dCe, dcE и dce [16]. Лица, у которых ген RHDприсутствуетна обеих гомологичных хромосомах или на одной из них, являются D-положительными.Люди, у которых ген RHD отсутствуетна обеих гомологичных хромосомах, считаются D-отрицательными. Среди европейцев D-отрицательных людей 15-17%, в Южной Африке – 5%, в Японии, Китае, Монголии и Корее – 3% [13; 33]. Напротив, у басков лишь 34%D-положительных лиц. Отметим, что у европецев основной причиной D-отрицательности является делеция гена RHD, в то время как у африканцев и азиатов часто выявляется неактивный (молчащий) ген RHD [25] или гибридный ген RHD-СЕ-D [16], не экспрессирующий антиген D [11]. 20%D-отрицательных японцев имеют резус-фенотип DEL, характеризующийся очень низким уровнем экспрессии антигена D.
Прорыв в понимании молекулярных основ системы резус произошел в 90-х годах прошлого века, когда были клонированы гены локуса RH – ген RHD и ген RHСЕ [22]. Выяснилось, что эти гены кодируют две белковые молекулы, встраивающиеся в мембрану эритроцитов, –белокRhD и белокRhCE[4]. Частью аминокислотной структуры одного из этих белков – белка RhD– является антиген D. Белок RhCE, в отличие от белка RhD, формирует два резус-антигена –антиген С(или с) и антиген Е (или е), наследуемых в блоке в разных комбинациях: СЕ, Се, сЕ или се. Наличие двух различных антигенных детерминант в одной молекуле белка подтверждается выработкой двух типов антител в ходе иммунного ответа, инициированного белком RhCE, – анти-С (или анти-с) и анти-Е (или анти-е) [5].
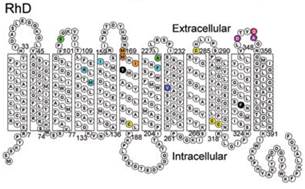
Белки RhD и RhCE на 92% идентичны по структуре (аминокислотному составу и конформации) в связи с высокой гомологичностью кодирующих их генов RHD и RHСЕ, обусловленной, вероятно, генной дупликацией [30]. Оба белка состоят из 416 аминокислот и отличаются лишь 35 аминокислотами. В мембране одного эритроцита содержится от 10 до 30 тысяч молекул ключевых резус-антигенов. Резус-протеины RhD и RhCE– это молекулы, 12 раз пересекающие мембрану эритроцитов в направлении от внутренней поверхности к наружной и затем вновь ко внутренней с С- и N-концами, ориентированными к цитоплазме [9] (рис. 1).
Рис. 1. Структурная организация протеина RhD
(из ConroyM. etal., BritishJournalofHaematology. 2005)
Некоторые участки этих белковых молекул, выступающие шестью петлями над наружной поверхностью мембраны эритроцитов, обладают свойствами эпитопов – детерминантных областей антигена [12]. Применение моноклональных антител, способных взаимодействовать с эпитопами лишь одного типа, позволило выявить в молекуле протеина RhDэпитопы 36 различных типов. Есть основания полагать, что в мембране эритроцитовD-положительных людей два ключевых резус-протеина RhD и RhCE образуют резус-комплекс с двумя молекулами резус-ассоциированного гликопротеина – RhAG. У D-отрицательных лиц резус-комплекс, возможно, содержит две RhCE субъединицы (обычно се) и две RhAG субъединицы [39].
Гликопротеин RhAG на 40% идентичен белкам RhD и RhCE, что указывает на его принадлежность к семейству резус-протеинов, и он, также как белки RhD и RhCE, 12 раз пересекает мембрану эритроцитов. Семейство резус-протеинов составляют ключевые резус-белки эритроцитов – носители антигенов D, С (или с), Е (или е) – и резус-ассоциированный гликопротеин RhAG [27]. С резус-семейством ассоциированы десятки дополнительных (accessory) гликопротеинов [17]. Очевидно, что столь значительное разнообразие антигенных белков системы резус, связанное с выпадением отдельных нуклеотидов, точечными нуклеотидными заменами в цепи ДНК, транслокацией, изменением экспрессии антигенов и пр., делает эту систему самой полиморфной из всех известных на сегодняшний день систем групп крови. Генетические исследования последних лет выявили случаи обменов между генами RHD и RHСЕ. Мутантные гены кодировали гибридные резус-протеины, у которых имелись RhD-специфические области в молекуле Rhсе-протеина и наоборот [8]. Эритроциты, содержащие гибридные резус-протеины Rhсе, могли взаимодействовать с некоторыми моноклональными антителами анти-D.
Показано, что для экспрессии белков RhD и RhCE в мембрану эритроцитов необходим гликопротеин RhAG [29]. В отсутствие протеина RhAG нарушается процесс сборки и переноса из цитоплазмы в мембрану эритроцитов ключевых белков резус-комплекса – белков RhD и RhCE. Это подтверждается одним из фенотипов системы RH – фенотипом резус-ноль (Rhnull). Rhnull может быть следствием мутации одного из генов большого комплекса резус-генов – гена RHAG, блокирующей образование резус-ассоциированного гликопротеина RhAG. Оказалось, что в мембране эритроцитов лиц фенотипа Rhnull отсутствуют не только молекулы протеинаRhAG, но и резус-протеиныRhD и RhСЕ [20]. При этом лица Rhnull могут передавать по наследству антигены семейства Резус своим детям (по аналогии с Бомбейским фенотипом). Имеются сведения о наличии у лиц фенотипа Rhnull естественных антител ко всем ключевым антигенам системы резус.
Важно отметить, что у носителей фенотипа Rhnull были выявлены морфологические и физиологические изменения эритроцитов [18]. В красных клетках крови повышалось осмотическое давление, они приобретали форму сфероцитов, уменьшалась продолжительность их жизни, наступал гемолиз [38]. Эти наблюдения, а также множество специальных исследований убеждают в том, что семейство резус-белков является существенной составляющей цитоскелета эритроцитов и участвует в транспорте воды и аммониячерез его мембрану [6; 19; 24].
Ключевые антигены системы RH начинают синтезироваться примерно с 6-й недели внутриутробного развития плода. Экспрессия белков с резус-антигенами в мембрану пронормобластов отмечается уже на 38-42-й день эмбриогенеза. Неэритроидные гомологи резус-белков обнаружены в печени, почках, головном мозге и коже. Эти белки осуществляют трансмембранный перенос аммония в клетках, составляющих эти органы [26].
3. Некоторые варианты антигена D, образовавшиеся в результате мутаций гена RHD
А. D weak — слабый антиген D
У лиц фенотипа Dweak (от англ. weak – слабый), а они составляют 1,5% среди резус-положительных, вследствие точечной мутации гена RHD снижена экспрессия антигена D на мембране эритроцитов [40]. В связи с этим антиген Dweak не может быть идентифицирован рутинным методом – прямой агглютинацией с использованием сывороток анти-D. Во избежание ошибочного отнесения лиц фенотипа Dweak к числу D-отрицательных, кровь всех D-отрицательных доноров должна быть исследована специальными методами на наличие антигена Dweak[35].
Доноры с антигеном Dweak определяются как резус-положительные(D-положительные), т.к. их эритроциты могут стимулировать образование антител анти-D у D-отрицательных реципиентов. При переливании эритроцитов фенотипа DweakD-положительным реципиентам антитела анти-D не продуцируются. Синтез анти-D в противоположной ситуации – у реципиентов Dweakпри переливании им D-положительных эритроцитов – ранее считался маловероятным. Однако в последние годы появляются сведения о случаях иммунизации Dweakреципиентов D-положительными эритроцитами [14]. В связи с этим реципиентов с антигеном Dweak в трансфузионных процедурах рекомендуют вести как резус-отрицательных (D-отрицательных).
При определении резус-принадлежности лаборатории выдают лицам фенотипа Dweak комментарий: «Выявлен слабый резус-антиген (Dweak), рекомендуется при необходимости переливать резус-отрицательную кровь». Впрочем, вопрос об иммунных свойствах фенотипа Dweak продолжает активно обсуждаться в научных кругах [15].
Б. D partial – частичный антиген D
Частичный(парциальный, вариантный) антиген D–Dpartial– отличается от антигена Dотсутствиемодного или нескольких из известных 36-ти эпитопов[3]. При этом количество RhD-протеинов в мембране эритроцитов остается таким же, как у лиц с нормальным антигеном D. У реципиентов Dpartialвозможно образование антител против недостающих эпитопов антигена D при переливании им D-положительной крови или во время беременности [36]. В связи с этим реципиенты фенотипа Dpartialсчитаются D-отрицательными, а доноры – D-положительными. Некоторые Dpartialявляются результатом точечных мутаций в гене RHD, другие возникают вследствие гибридизации генов RHD и RHСЕ.
В. Фенотип DEL
Фенотип DEL широко распространен у азиатских этносов. В Китае и Японии он составляет до 17% от числа резус-отрицательных лиц, выявленных серологически. У европейцев встечается очень редко. Характеризуется исключительно низкой экспрессией антигена D. Несмотря на это обстоятельство, эритроциты фенотипа DEL могут вызывать иммунную реакцию у D-отрицательных реципиентов [41]. До сих пор нет серологических реагентов, которые определяли бы этот фенотип. Идентификация доноров DEL производится лишь генетическим скринингом [34]. Поскольку DEL принадлежит к числу слабых D-фенотипов, на представителей этого фенотипа распространяются те же рекомендации по поводу гемотрансфузии, что и на лиц Dweak: доноры считаются резус-положительными (D-положительными), а реципиенты – резус-отрицательными (D-отрицательными).
4. Антирезус антитела
Антитела антирезус являются иммунными антителами [23]. В отличие от естественных антител системы АВ0, антитела к антигенам системы резус вырабатываются в процессе иммунных реакций (изосенсибилизации).
Антитела к антигенам системы резус, образующиеся при первичном иммунном ответе, в основном принадлежат к иммуноглобулинам М, серологически определяются через несколько недель после встречи с антигеном (чаще всего), достигают максимальной концентрации через 1-2 месяца. Антитела, синтезированные при вторичном иммунном ответе, в значительной степени принадлежат к иммуноглобулинам G, появляются в крови через несколько дней после внедрения антигена и сразу в высокой концентрации.
IgM и IgG, связавшись с соответствующими антигенами эритроцитов, активируют комплемент по классическому пути и фагоцитирующие клетки крови.
5. Определение резус-совместимости при переливании крови
Резус-антигены могут быть выявлены рядом методов:
— реакцией агглютинации с моноклональными антителами анти-D, анти-С, анти-с, анти-E, анти-е;
— реакцией агглютинации с универсальным реагентом антирезусD;
— другими высокоэффективными и надежными методиками [1].
Длядоноров в наши дни чаще всего применяется следующий алгоритм определения резус-принадлежности. Универсальным реагентом антирезусD, содержащим антитела анти-D, в эритроцитах донора выявляется антиген D: агглютинация эритроцитов антителами анти-D указывает на наличие антигена D на поверхности эритроцитов, отсутствие агглютинации – на отсутствие антигена D. Если антиген D не обнаружен, эритроциты донора обследуются моноклональными антителами анти-С и анти-E на наличие антигенов C и E [1].
Доноры, в эритроцитах которых обнаружен хотя бы один из ключевых резус-антигенов, обозначаемых заглавными буквами (D, и/или C, и/или E), cчитаются резус-положительными. Лица, у которых отсутствуют антигены D, C и E (фенотип dce), являются резус-отрицательными донорами. У реципиентов определяется антиген D универсальным реагентом антирезусD.
В том случае, если все ключевые резус-антигены выявляются моноклональными антителами, важно иметь в виду, что МАО синтезируются invitro одним штаммом плазматических клеток [2]. Эти антитела комплементарны лишь к одному типу эпитопа антигена. Если, к примеру, в исследуемых D-положительных эритроцитах данная детерминанта отсутствует (как у Dpartial), кровь будет считаться D-отрицательной со всеми вытекающими отсюда последствиями. Во избежание подобных ошибок эритроциты, идентифицированные МКА как D-отрицательные, должны дополнительно типироватьсяполиклональными анти-D антителами, содержащимися в универсальном реагенте антирезусD. Это связано с тем, что один антиген может содержать несколько разных или/и одинаковых эпитопов, при этом всеэпитопы одного антигена способны связываться с антителами, синтезированными в организме (invivo) всеми штаммами плазмоцитов в ответ на внедрение данного антигена–поликлональными антителами.
Универсальный реагент антирезусD является сывороткой крови D-отрицательных лиц группы крови АВ (IV), сенсибилизированных к антигену D предыдущими беременностями и/или трансфузиями крови, а также искусственно иммунизированных доноров-добровольцев. В этой сыворотке содержатся антитела анти-D. Универсальной сыворотку делает отсутствие в ней естественных антител анти-А и анти-В, которые могут агглютинацией по системе АВ0 замаскировать специфическое взаимодействие антител анти-Dс антигеном D.
В особых случаях (пока еще) для определения резус-совместимости пар «донор – реципиент» на cтанциях переливания крови производится фенотипирование крови по резус-антигенам. Фенотипирование– это серологическое типирование эритроцитов по всем главным антигенам системы резус –D, C, c, Eи e. При необходимости также определяются некоторые слабые резус-антигены и парциальные антигены D. В трансфузиологическом сообществе России обсуждается вопрос о необходимости введения в нашей стране обязательного фенотипирования доноров по 9 трансфузионно значимым антигенам – А, В, D, с, Е, С, е, Кеllи Cw, – шесть из которых представляют самую иммуногенную из 30-ти систем групп крови – систему резус [10]. Только индивидуальный подбор пар «донор-реципиент», основанный на совместимости их резус-фенотипов, может обеспечить безопасность переливания крови.
6. Природа резус-несовместимости при гемотрансфузии
Резус-несовместимость может быть вызвана двумя причинами – иммунизацией реципиента отсутствующим в его эритроцитах резус-антигеном (антигенами) донора или введением эритроцитов аллоиммунизированному реципиенту [28]. Рассмотрим на нескольких примерах механизм иммунизации реципиентов в процессе трансфузии резус-несовместимых эритроцитов.
1. Предположим, по причине недостаточной оснащенности серологической лаборатории у донора не выявленсодержащийся в его эритроцитахслабый антиген D–Dweak. Констатация отсутствия антигена D позволяет ответственному лицу станции переливания крови сделать заключение о D-отрицательности исследуемой крови (в процессе фенотипирования в эритроцитах донора идентифицированы также антигены с и е).Таким образом, фенотип донора ошибочноопределен как dce. Эритроциты фенотипированного донора используются для трансфузии резус-отрицательному (D-отрицательному) реципиенту с «аналогичным» фенотипом. D-положительные эритроциты донора (Dweak), поступая в кровоток D-отрицательного реципиента, распознаются В-лимфоцитами как чужеродные. Активированные В-лимфоциты трансформируются в плазматические клетки, которые начинают синтезировать и секретировать в кровь антитела, комплементарные антигену Dweak эритроцитов донора – анти-Dweak. В крови реципиента анти-Dweakсвязываютсяс антигенами Dweakмембраны эритроцитов донора. Образование комплекса«антиген-антитело» на поверхности эритроцитов резус-несовместимого донора активирует комплемент по классическому пути, в результате чего мембраноатакующий комплекс разрушает мембрану эритроцитов донора.
2. Другой случай. Допустим, производится трансфузия D-положительных эритроцитов донора D-положительному реципиенту с не идентифицированным фенотипом Dpartial. В состав антигена D донора входят все детерминантные группы антигена –множество различных эпитопов, Dpartial реципиента лишен некоторых из них. Детерминанты D-антигена донора, отсутствующие в структуре Dpartial реципиента, запускают иммунную реакцию, направленную на разрушение и элиминацию эритроцитов донора.
Заметим, что далеко не каждая резус-несовместимая, по идее, ситуация разрешается образованием антирезус антител. Около 30%D-отрицательных людей не подвергаются аллоиммунизации даже при переливании им больших объемов D-положительной крови. Это связано с индивидуальными особенностями иммунных реакций, возможностью возникновения толерантности к определенным антигенам.
Рецензенты:
Лебедева А.Ю., д.м.н., профессор кафедры госпитальной терапии №1 ГБОУ ВПО «Российский национальный исследовательский университет им. Н.И. Пирогова» МЗ РФ, г.Москва;
Автандилов А.Г., д.м.н., профессор, заведующий кафедрой терапии и подростковой медицины Российской медицинской академии последипломного образования (ГБОУ ДПО «РМАПО»), г. Москва.
[1]Реакцией конглютинации с 10%-ным желатином, непрямым антиглобулиновым тестом, гелевым тестом.