синдромы плацентарной трансфузии что это
Синдромы плацентарной трансфузии что это
Частота сопутствующих ВПС в этой группе детей значительно превышает среднюю в популяции, составляя около 7%. Особенно высока выявляемость пороков среди близнецов-реципиентов (12%); наиболее частым из них является легочный стеноз (4,8—9,6%).
Естественное течение синдрома фето-фетальной трансфузии.
До 90% беременностей заканчиваются преждевременными родами. В 25% случаев один из близнецов (чаще донор) погибает внутриутробно. Еще 10% умирают вскоре после рождения. Более половины родившихся детей нуждаются в искусственной вентиляции легких. У 13% имеются внутрижелудочковые кровоизлияния III—IV степени или перивентрикулярная лейкомаляция. У близнецов-доноров в 10% случаев развивается почечная недостаточность, приводящая к смерти около 60% из них.
Среди выживших детей высок процент поражений центральной нервной системы (задержка речи и умственного развития, детский церебральный паралич).
Выраженная гипертрофия миокарда в выводном отделе правого желудочка может приводить к снижению потока крови через желудочек и легкие, что сопровождается нарушением их развития и прогрессированием легочного стеноза вплоть до атрезии клапана.
Клиническая симптоматика синдрома фето-фетальной трансфузии.
У новорожденного, перенесшего синдром фето-фетальной трансфузии в качестве донора, можно отметить бледность, тахикардию, нарушения периферической циркуляции. Тяжесть состояния близнеца-реципиента в большинстве случаев бывает обусловлена полицитемией, гипербилирубинемией, сердечной недостаточностью. Разница в массе тела между новорожденными превышает 15%. При внутриутробной гибели одного из близнецов у выжившего ребенка высока опасность развития ДВС-синдрома и почечной недостаточности.
У новорожденных с синдромом фето-фетальной трансфузии нередко выявляется артериальная гипертензия. Причиной этого у бывших доноров может быть активация ренин-ангиотензиновой системы в ответ на хроническую гипово-лемию. Причиной гипертензии у реципиентов может быть повышение в плазме уровня эндотелина-1 — потенциального сосудосуживающего вещества. Так как увеличенный уровень ренина может передаваться от донора к реципиенту, это вносит дополнительный вклад в дисфункцию сердечно-сосудистой системы у последнего.
Лечение синдрома фето-фетальной трансфузии.
Основная терапия проводится во внутриутробном периоде. В качестве вариантов лечения используют периодический декомпрессионный амниоцентез, создание сообщения между оболочками, лазерную фотокоагуляцию плацентарных анастомозов, перевод беременности в моноплодную. Это позволяет повысить выживаемость для отдельных плодов до 65—90%.
При лечении близнецов-доноров используют 10% раствор глюкозы, эритроцитарную массу и препараты железа. Близнецам-реципиентам показаны заменные переливания свежезамороженной плазмы для снижения гематокрита.
Артериальная гипертензия новорожденных и легочный стеноз лечатся по соответствующим принципам.
— Вернуться в оглавление раздела «Кардиология.»
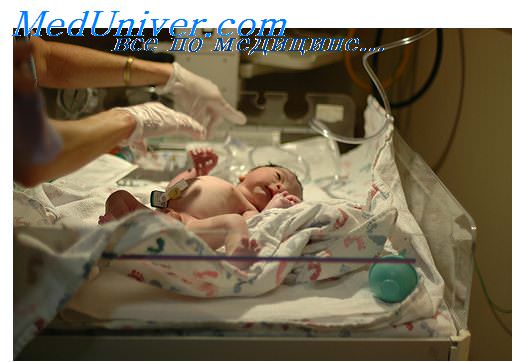
Случай диагностики фето-фетального трансфузионного синдрома. Клиническое наблюдение
УЗИ аппарат HM70A
Экспертный класс по доступной цене. Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
Введение
По данным литературы, частота ФФТС составляет 10-15% от всех монохориальных двоен. Перинатальная смертность при ФФТС достигает 60-100% [2, 3].
Ультразвуковая диагностика ФФТС становится возможной в 16-24 нед беременности и основана на установлении монохориальности плодов, выявлении дискордантности размеров и количества амниотической жидкости плода «донора » и «реципиента», исследовании плодово-плацентарной гемодинамики, а обнаружение повышения постнагрузки и преднагрузки свидетельствует о тяжести ФФТС [1, 2, 6, 7].
Наиболее неблагоприятный прогноз течения беременности при развитии синдрома до 25 нед.
Отсутствие какого-либо вмешательства приводит к гибели (около 80%) или тяжелой заболеваемости плодов. На сегодняшний день наиболее эффективной процедурой является фетоскопическая лазерная коагуляция плацентарных анастомозов при ФФТС. Неонатальные исходы зависят от стадии течения заболевания, на которой произведено вмешательство. Чем раньше произведена операция, тем лучше ожидаемые результаты [1, 8].
Клиническое наблюдение
Беременная И., 27 лет. Данная беременность вторая, первые роды в 2006 году, не осложненные, в срок. Данная беременность наступила самопроизвольно и протекала с угрозой прерывания. Диагноз многоплодной беременности установлен при первом скрининговом исследовании.
В 23-24 нед гестации при УЗИ впервые поставлен диагноз ФФТС. Пациентка получала лечение утрожестаном, курантилом, гинипралом, актовегином, кокарбоксилазой амбулаторно.
При контрольном ультразвуковом исследовании, проведенном в научно-консультативном отделе института в 29 нед беременности выявлено: в полости матки находятся 2 живых плода: I плод в головном предлежании 1 позиции переднем виде, женского пола, II плод в головном предлежании 1 позиции переднем виде женского пола. Данные фетометрии представлены в таблице.
Синдромы плацентарной трансфузии что это
Фетофетальный трансфузионный синдром является крайне тяжелым осложнением монохориальной многоплодной беременности и встречается примерно в 10–15 % случаев. Причины его возникновения до конца не изучены, предполагают, что ФФТС связан с нарушением формирования плаценты, поздним разделением плодов, негативным влиянием внешних повреждающих факторов и дефицитом кровотока в матке беременной. ФФТС вызывает отклонения в развитии сердечно-сосудистой системы как во внутриутробном, так и в постнатальном периоде. Патологии, возникающие при этом, оказывают влияние на организм в целом и без своевременной диагностики и правильно подобранного метода лечения оказываются летальными до 100 % случаев.
Цель работы: анализ литературы, посвященной современным представлениям о влияния ФФТС на развитие сердечно-сосудистой системы монохориальной двойни во внутриутробном периоде. Раскрытие роли кардиоваскулярных нарушений в возникновении патологий организма в целом в постнатальном периоде.
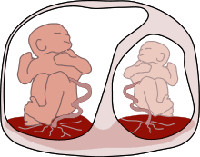
Начиная со второй половины прошлого века в сфере научного исследования акушерства и гинекологии особое внимание уделялось закономерности повышенного риска развития сердечно-сосудистых патологий у монохориальных двоен в пре- и постнатальном периоде. Постепенно изучение данной проблемы привело ученых к выводу о существовании определенных процессов во внутриутробном периоде, которые нарушают поступление необходимых для развития сердечно-сосудистой системы веществ у близнецов. Такие процессы названы фетофетальным трансфузионным синдромом (ФФТС), который был впервые описан в конце XIX в. немецким гинекологом Фридрихом Шацом [1]. ФФТС является следствием развития глубоких анастомозов в сосудистой сети плаценты, в результате чего кровотоки плодов могут соединяться, вызывая диспропорцию в объёмах [2]. Таким образом, возникает нарушение в системе кровообращения двойни так, что один плод – «донор» испытывает недостаток пластических веществ и кислорода, а другой плод – «реципиент» подвержен действию избыточно поступающего объема крови. Этот процесс происходит из-за соединения сосудов плода и образования артериовенозного шунта. Выделяют два вида таких шунтов: поверхностные, которые находятся на основании стенки хориона – артерио-артериальные (АА) и вено-венозные (ВВ), и глубокие, расположенные в толще плаценты. Глубокие анастомозы обеспечивают поступление артериальной крови одного плода в венозную систему другого, образуя артериовенозные шунты (АВ) [2]. Существуют 5 степеней тяжести ФФТС, основанных на диаметре, количестве, направлении тока крови анастомозов и выраженности компенсаторных реакций двойни. Несмотря на то, что анастомозы между плодами имеются при всех монохориальных двойнях, ФФТС обычно формируется при диамниотических двойнях. Это связано с тем, что при моноамниотических беременностях больше двунаправленных поверхностных анастомозов, чем при диамниотических.
Основные особенности влияния ФФТС на организм человека могут быть изучены в результате сравнения протекания гестационного периода и родов беременных одним плодом и двойней, а также частоты постнатальных нарушений у детей. Согласно статистическим данным, частота преждевременных родов при одноплодной беременности составляет около 7 %, а при двуплодной – 49 %. Также масса тела при рождении, независимо от гестационного срока, будет 20 секунд. При этом существует вероятность перехода данного состояния в синдром внезапной детской смерти в постнатальном периоде [19].
Также у ребенка, который испытывал снижение ОЦК, после рождения возникают церебральные нарушения, связанные с рядом причин. Во-первых, с образованием кист белого вещества, формирующихся в результате длительной гипоксии и осложненной беременности, которыми могут стать арахноидальные кисты. Эти новообразования начинают оказывать давление на мозговые оболочки, что приводит к увеличению ликворопродукции. Следствием является увеличение внутричерепного давления и гидроцефалия, которые проявляются головной болью, срыгиванием, рвотой, потерей аппетита, вялостью, беспокойным сном, судорогами, гипотонусом и гипертонусом конечностей, неспособностью координировать движения, также возможны нарушения зрения и слуха. Во-вторых, церебральные патологии связаны с нарушением выделительной функции почек, что ведет к накоплению остаточных продуктов белкового обмена, оказывающих токсическое действие на головной мозг. Самые тяжелые поражения нервной системы могут проявляться такими аномалиями строения мозга, как агенезия борозд, агирия, недоразвитие серого вещества в больших полушариях головного мозга, полимикрогирия, гетеротопия [24]. По данным различных научных деятелей неврологические и нервно-психические расстройства встречаются среди 18–26 % выживших при ФФТС [25]. Таким образом, ФФТС оказывает значительное воздействие на организмы близнецов и в постнатальном периоде.
Заключение
ФФТС действительно вызывает отклонения сердечно-сосудистой системы как во внутриутробном, так и в постнатальном периоде. Патологии, возникающие при этом, оказывают влияние на организм в целом [26]. Поэтому необходимо проводить раннюю диагностику беременных с монохориальной двойней для выявления признаков нарушений и своевременного контроля над развитием ФФТС. В качестве рекомендаций для диагностики можно выделить следующие критерии УЗИ: наличие монохориальности (может быть определена с 4-й недели при использовании трансвагинального датчика) и максимального свободного кармана околоплодных вод одного плода менее 2,0 см и более 8,0 см второго плода [7]. С помощью классификации стадий ФФТС по Quintero и данных критериев возможно сравнивать различные способы лечения и прогнозировать выживаемость после врачебных вмешательств. При этом до установления типа хориальности все двуплодные беременности следует относить к группе риска ФФТС. Выбор тактики лечения ФФТС зависит от гестационного срока, анатомических особенностей матери, места прикрепления плаценты, возможности проведения фетоскопии, технического обеспечения. Консервативная терапия признана неэффективной, используются только хирургические методы: фетоскопическая коагуляция анастомозов плаценты, фетоскопическая лазерная коагуляция пуповины, амниоредукция или серийный амниодренаж, септостомия или прерывание беременности [2, 18, 27].
Фето-фетальный трансфузионный синдром ( Синдром фето-фетальной трансфузии )
Фето-фетальный трансфузионный синдром (ФФТС) – это тяжелое осложнение многоплодной монохориальной беременности, при которой из-за анастомозов в сосудистой сети плаценты возникает дисбаланс кровотока у плодов. Проявлениями служит диспропорциональность развития близнецов, многоводие в пузыре «рецепиента» при маловодии у «донора», ряд серьезных пороков развития обоих плодов, их внутриутробная гибель. Диагностика производится на основании картины ультразвуковых исследований, эхокардиографии и допплерографии, выполняемых обычно во второй половине беременности. Для сохранения беременности осуществляют лазеркоагуляцию плацентарных анастомозов, периодическое амниодренирование, окклюзию пуповины более пострадавшего плода для сохранения другого.
МКБ-10
Общие сведения
Причины
Морфологической предпосылкой для развития фето-фетального трансфузионного синдрома является наличие в хорионе анастомозов между сосудистыми сетями обоих плодов. При монохориальной беременности они выявляются в 60-90% и могут быть поверхностными и глубокими. Поверхностные вено-венозные и артерио-артериальные анастомозы способны транспортировать кровь в обоих направлениях (в зависимости от давления) и выравнивают объемы крови между близнецами. Строение глубоких анастомозов таково, что артериальная кровь, поступающая в котиледон плаценты из системы одного ребенка, переходит в венозную сеть другого. Предполагается, что превалирование количества глубоких сосудистых соединений в хорионе над числом поверхностных и становится причиной появления синдрома.
Факторы, приводящие к возникновению большего количества глубоких анастомозов, на сегодняшний момент неизвестны. Предполагается, что они возникают из-за патологии формирования плаценты «донора», в результате чего сосудистое сопротивление в ней растет, и формируются шунты, связывающие его с сосудами «реципиента». Обсуждается возможность влияния позднего разделения близнецов, тератогенных факторов, недостаточного кровоснабжения матки женщины. Выяснение точных причин ФФТС осложняется поздней диагностикой этого состояния и непредсказуемостью его появления.
Патогенез
Считается, что возникновение фето-фетального трансфузионного синдрома может произойти на разных сроках вынашивания, причем позднее возникновение осложнения благоприятней в прогностическом отношении. Иная точка зрения заключается в том, что предпосылки для ФФТС возникают еще на этапе разделения плодов (4-12 дни гестации), а выраженность и срок появления дальнейших нарушений зависит от количества глубоких анастомозов и степени дисбаланса кровообращения близнецов. Первоначально возникает простой переток крови от «донора» к «реципиенту», который не отражается на скорости развития и других характеристиках обоих плодов.
Уменьшение объема циркулирующей крови у близнеца-донора постепенно приводит к явлениям плацентарной недостаточности – внутриутробной гипоксии, задержке развития. Нарушается работа почек и снижается выделение мочи, что становится причиной уменьшения объемов мочевого пузыря и появления маловодия. Последний фактор оказывает влияние на скорость развития тканей легких, замедляя формирование дыхательной системы. При отсутствии лечения происходит внутриутробная гибель плода по причине гипоксии и тяжелого недоразвития основных органов и систем.
Классификация
Выделяют несколько степеней развития фето-фетального трансфузионного синдрома, основываясь на тяжести состояния плодов и разнице их основных показателей (КТР, объем околоплодных вод). По мере прогрессирования ФФТС нарушения беременности нарастают таким образом, что каждая стадия включает в себя патологии всех предыдущих этапов заболевания. Современная классификация выделяет пять стадий развития синдрома:
Стадийность ФФТС не имеет четкой привязки к сроку беременности – при неблагоприятном и раннем развитии осложнения признаки 1-й стадии могут выявлять на 14-17 неделе. В акушерстве при синдроме считается важной границей срок в 25 недель гестации, так как появление нарушений ранее часто приводит к прерыванию беременности даже при лечении. Нередко принимается решение о сохранении только одного (более жизнеспособного) ребенка, тогда врачебное вмешательство может производиться в ущерб его близнецу.
Симптомы
Субъективных проявлений ФФТС не имеет, его обнаруживают при скрининговых ультразвуковых исследованиях. Беременные с такой патологией чаще, чем в норме, имеют гипертонус матки и другие состояния, угрожающие прерыванием вынашивания ребенка. Ряд исследователей допускает, что значительная часть самопроизвольных абортов при многоплодной беременности обусловлена ФФТС до его обнаружения. Осложнения патологии (внутриутробная смерть) могут проявляться болью в животе и груди, профузным маточным кровотечением либо появлением кровянистых выделений из влагалища. На поздних сроках признаком гибели близнецов является прекращение их движений (замирание).
Осложнения
Диагностика
Обнаружение ФФТС происходит при плановом УЗИ беременной, уже при выявлении монохориальной многоплодной беременности женщина вносится в группу риска. УЗИ-признаки заболевания обнаруживаются после 16-й недели (крайне редко – после 11-12-й), затем для подтверждения диагноза и мониторинга состояния плодов назначают дополнительные методы исследования. С их помощью определяют прогностические перспективы фето-фетального трансфузионного синдрома и собираются данные для возможного лечения.
Лечение ФФТС
Консервативное лечение ангиопротективными средствами и препаратами для коррекции микроциркуляции признано неэффективным и может использоваться только в качестве вспомогательной терапии. Аналогичной позиции специалисты придерживаются и в отношении гормональных (препараты прогестерона) и других лекарств, использующихся в акушерстве для сохранения беременности. Увеличивают выживаемость как минимум одного близнеца только методы фетальной хирургии:
Прогноз
Фето-фетальный трансфузионный синдром характеризуется неблагоприятным прогнозом – при отсутствии лечения и регулярного наблюдения у акушера-гинеколога это состояние практически всегда приводит к гибели плодов и самопроизвольному прерыванию беременности. Результативность хирургического вмешательства зависит от многих факторов: стадии развития ФФТС, срока беременности, наличия или отсутствия сопутствующих патологий у женщины. Довольно часто лечебные меры приходится производить в ущерб более пострадавшему ребенку для сохранения другого. Профилактика развития синдрома не разработана, так как неизвестны причины его возникновения.
Синдромы плацентарной трансфузии что это
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
Синдром фето-фетальной трансфузии. Анализ исходов после проведения фетоскопической лазерной коагуляции плацентарных анастомозов
Журнал: Российский вестник акушера-гинеколога. 2019;19(4): 22-28
Поспелова Я. Ю., Косовцова Н. В., Павличенко М. В., Маркова Т. В., Куклин Е. С. Синдром фето-фетальной трансфузии. Анализ исходов после проведения фетоскопической лазерной коагуляции плацентарных анастомозов. Российский вестник акушера-гинеколога. 2019;19(4):22-28.
Pospelova Ya Yu, Kosovtsova N V, Pavlichenko M V, Markova T V, Kuklin E S. Twin-to-twin transfusion syndrome. Analysis of outcomes after fetoscopic laser photocoagulationof placental anastomoses. Russian Bulletin of Obstetrician-Gynecologist. 2019;19(4):22-28.
https://doi.org/10.17116/rosakush20191904122
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
Цель обзора литературы — анализ исходов после проведения фетоскопической лазерной коагуляции плацентарных анастомозов, проведенный при различного рода исследованиях, опубликованных за последние годы в зарубежных и отечественных медицинских изданиях. В результате анализа были определены основные ультразвуковые и фетоскопические маркеры, влияющие на исходы оперативного лечения: расположение плаценты по передней и задней стенке, место прикрепления пуповины, количество плацентарных анастомозов, аномальные кривые скоростей кровотока в артериях пуповины, расстояние между местами прикрепления пуповин, диссоциированный рост плодов, срок беременности и стадия тяжести синдрома фето-фетальной трансфузии по R. Quintero на момент проведения операции, опыт оперирующих хирургов и продолжительность операции. Анализ данных литературы показал, что перечисленные маркеры имеют крайне противоречивую значимость для определения прогноза выживаемости одного или обоих плодов. Дальнейшее изучение ультразвуковых и фетоскопических предикторов неблагоприятного исхода лазерной коагуляции плацентарных анастомозов позволит более взвешенно подходить к выбору оперативной тактики и персонифицированному консультированию пациенток.
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
Монохориальное многоплодие представляет собой одну из самых неоднозначных клинических ситуаций в акушерстве и фетальной хирургии. Применение вспомогательных репродуктивных технологий (ВРТ), в особенности интрацитоплазматической инъекции сперматозоида (ИКСИ) и отсроченного переноса эмбриона, увеличивает риск развития монохориальной плацентации и соответственно осложнений монохориального многоплодия в 3—4 раза [1].
При монохориальном многоплодии наблюдаются более высокие, чем при дихориальном многоплодии или одноплодной беременности, перинатальная заболеваемость и смертность [2]. Чаще всего формируются такие специфические осложнения, как синдром фето-фетальной трансфузии (СФФТ), селективная задержка роста одного из плодов (СЗРП), синдром обратной артериальной перфузии или внутриутробная гибель одного плода из двойни [3]. Фетоскопическая лазерная коагуляция плацентарных анастомозов (ЛКПА) зарекомендовала себя как лучшая методика для коррекции СФФТ с наименьшими перинатальными потерями и послеоперационными осложнениями для матери и плода [4, 5].
В настоящем обзоре литературы будет уделено внимание исходам коагуляции плацентарных анастомозов, ультразвуковым и фетоскопическим предикторам неблагоприятных исходов после данного вида хирургической коррекции СФФТ.
Впервые фетоскопическая лазерная коагуляция как метод непосредственного воздействия на причину развития СФФТ была предложена J. De Lia и соавт. [6] в 1990 г.
Операция выполняется с помощью фетоскопов диаметром 3,3 мм и менее, которые используются для прямой визуализации сосудов на поверхности плаценты. После выявления коммуникативных анастомозов выполняется их коагуляция с использованием лазерной энергии, которая проводится в амниотическую полость с помощью кварцевого волокна через операционный канал фетоскопа. Изначально коагулировали все сосуды (неселективная лазерная коагуляция), пересекающие амниотическую мембрану [7, 8]. Впоследствии R. Quintero и соавт. [9, 10] разработали методику селективной лазерной коагуляции. Подобная методика позволила предотвратить коагуляцию сосудов, ветви которых не имеют анастомозов с системой циркуляции второго плода, и сократить число выключенных из фетоплацентарной циркуляции котиледонов, что обеспечило увеличение выживаемости плодов до 62—77% [11—16].
Позже была представлена «методика Соломона», суть которой заключалась в непрерывной коагуляции поверхности плаценты на отрезках, соединяющих соседние коагуляционные зоны, образовавшиеся после первого этапа, от одного до другого края плаценты. Такая техника операции позволяет коагулировать мелкие анастомозы и осуществить полную «дихорионизацию» плаценты и тем самым значительно снизить вероятность рецидива СФФТ и улучшить исходы беременности [17].
В последние годы научная группа [18] предложила третью модификацию фетоскопической лазерной коагуляции. Эта техника предполагает пересечение артериовенозных анастомозов от донора к реципиенту в первую очередь, затем артериовенозных анастомозов от реципиента к донору с последующей коагуляцией оставшихся артериоартериальных и веновенозных анастомозов (последовательная селективная лазерная коагуляция анастомозов). Выполнение лазерной аблации в такой последовательности позволяет предотвратить сброс крови донора в систему гемоциркуляции реципиента во время операции. Последовательная селективная лазерная коагуляция анастомозов характеризуется повышением выживаемости обоих плодов по сравнению с селективной лазерной коагуляцией (74 и 57%; p=0,005). Выживаемость хотя бы одного плода из двойни также соответственно выше (91 и 88%; p=0,005).
В каждом отдельном исследовании, проведенном отечественными и зарубежными авторами, приведены результаты выживаемости одного или обоих плодов. В источниках литературы приведены статистические данные по выживаемости донора и реципиента при использовании той или иной модификации ЛКПА. Но крайне скудно освещен вопрос причин таких исходов, что является довольно ценной информацией для выбора метода хирургического лечения СФФТ.
С января 1995 г. по сентябрь 1999 г. K. Hecher и соавт. [19] провели исследование 200 беременных с СФФТ между 16-й и 25-й неделями беременности. Показатель выживаемости по крайней мере одного плода составила 81%. По мнению авторов статьи, основная причина благоприятного исхода оперативного лечения напрямую связана с растущим опытом хирургов при использовании данной технологии, а именно с более избирательной идентификацией и эффективностью коагуляции плацентарных анастомозов.
M. Barbosa и соавт. [20] в свою очередь проанализировали 24 монохориальные диамниотические беременности с диагнозом СФФТ на 18—26-й неделе беременности, где была проведена неселективная ЛКПА. Выживаемость обоих плодов составила 45,8%, одного — 87,5%. В результате отмечена прямая взаимосвязь между результатом хирургической коррекции синдрома и его стадией по R. Quintero [20]: чем ниже стадия синдрома — тем лучше прогноз. По данным этих же авторов, расположение плаценты (по передней или задней стенке) на исход операции не влияло.
В период с 2002 по 2008 г. группой ученых под руководством R. Cincotta [21] проанализированы наблюдения использования селективной ЛКПА при II—IV стадиях по R. Quintero. Были получены данные, что общая выживаемость при IV стадии синдрома значительно выше, чем при СФФТ III стадии, что противоречило выводам других исследователей [22].
В 2010 г. N. Meriki и соавт. [24] в ходе наблюдений выявили отсутствие корреляции между исходами ЛКПА и расположением плаценты. Выживаемость одного плода в их исследовании составила 90,7% (88,9% для передней и 92,1% для задней плаценты), а обоих плодов — 60%.
В 2015 г. S. Snowise и соавт. [25] провели проспективное когортное исследование с участием 166 пациенток, которым была проведена селективная ЛКПА, в результате которого получили следующие данные: послеоперационная смертность доноров составила 13%, а реципиентов — 2,6%. Авторами выделены основные причины, влияющие на неблагоприятный исход для плода донора: задержка развития 30% и более, отсутствие конечного диастолического кровотока в артериях пуповины, аномалия прикрепления пуповины к плаценте (краевое, оболочечное), большое количество плацентарных анастомозов. Знание этих факторов риска, по мнению авторов статьи, в дальнейшем должно помочь в выборе наиболее подходящего метода лечения при СФФТ [25].
Одновременно с предыдущим исследованием в 2015 г. S. Müllers и соавт. [26] проведен анализ 105 наблюдений ЛКПА при СФФТ. Выживаемость одного и двух плодов установлена в 75 и 47% наблюдений соответственно. Не обнаружено корреляции исхода оперативного лечения и гестационного возраста при постановке диагноза, исхода и расположения плаценты, ультразвуковых маркеров СФФТ, хотя отмечено, что выживаемость обоих плодов значительно снижается с увеличением стадии СФФТ по R. Quintero [26—28].
Модификация селективной ЛКПА, называемая «методикой Соломона», по данным многих исследователей, значительно улучшила перинатальные исходы, а также снизила частоту рецидивов СФФТ [29—31]. H. Sago и соавт. [32] в 2018 г. опубликовали показатели выживаемости при использовании данной методики: выживаемость обоих близнецов — 70% и одного близнеца — 90,6%. Единственным определяющим фактором успеха ЛКПА по «методике Соломона», по мнению авторов, является проведение манипуляции в сроках беременности 16—26 нед.
J. Stirnemann (цит. по [33]) отмечает улучшение перинатальных исходов ЛКПА за период с 2000 по 2016 г. Выживаемость обоих близнецов выросла с 42 до 66%, а одного плода с 44 до 58%. Кроме того, неблагоприятным условием для прогноза выживаемости автор исследования считает гестационный возраст менее 17 нед беременности. С противоположным мнением выступает группа ученых L. Lecointre и соавт. [34], D. Baud и соавт. [35], D. Valsky и соавт. [36], которые не отмечают значительной разницы в выживаемости одного либо двух плодов при проведении ЛКПА в сроках менее 17 нед и более 26 нед беременности.
По итогам анализа применения «методики Соломона» исследователями S. Murata и соавт. [37], выживаемость обоих плодов составила 74% и одного плода — 94%. Авторы отмечают, что аномальные кривые скорости кровотока в артериях пуповины в предоперационном периоде связаны с высоким риском летального исхода для плода-донора после применения ЛКПА [38].
Y. Chang и соавт. [39] в период с 2005 по 2014 г. выявили, что более высокая стадия СФФТ по R. Quintero обусловливает меньший процент выживаемоcти плодов, аналогичные статистические данные были получены X. Liu и соавт. [40] в 2012 г.
Немаловажным фактором для благоприятного исхода после ЛКПА является расстояние между пуповинами. Данное исследование было проведено D. Zhao и соавт. [41] с 2002 по 2013 г. Клинически значимым расстоянием между местами прикрепления пуповин считается 5 см и менее. Это связано в первую очередь с ухудшением визуализации сосудистого экватора и затруднением коагуляции плацентарных анастомозов.
M. Finneran и соавт. [42] отмечают немаловажную роль степени диссоциации роста плодов. Наиболее частый летальный исход для плода-донора в исследовании отмечался при сочетании таких факторов, как диссоциированный рост плодов и аномальные показатели кровотока в артерии пуповины у плода-донора, выявленные в предоперационном периоде.
После проведения анализа 86 беременностей, осложнившихся СФФТ, E. Gil Guevara и соавт. [43] выяснили, что основными причинами неблагоприятного исхода для плода-реципиента были аномальные кривые скоростей кровотока в венозном протоке и диссоциированное развитие плодов. Кроме того, на исход влияло наличие признаков истмико-цервикальной недостаточности.
Проведение процедуры под местной анестезией по сравнению с общей не дало весомых различий в исходах. Явлений дискомфорта у беременной, а также неудовлетворительной визуализации плацентарных анастомозов при применении местного обезболивания отмечено не было [44—46]. Использование миллиметровой оптики, а также уменьшение диаметра троакара с 3,8 до 2,3 мм привело к значительному улучшению исходов для новорожденных и снижению числа рецидивов СФФТ. Выживаемость одного близнеца составила 98%, обоих близнецов — 83,3% [47, 48].
J. Akkermans и соавт. [49] выявили, что мощность лазерного излучения (50 W) и величина апертурного угла оптики (90°) играют несомненную роль при проведении ЛКПА, улучшая визуализацию плацентарных анастомозов и тем самым снижая риск развития такого осложнения, как кровотечение, а также сокращают время проведения оперативного лечения.
Немаловажную роль играет оценка остаточных анастомозов с использованием современных неинвазивных технологий, таких как компьютерная томография с созданием трехмерной виртуальной плацентоскопии постнатально [50].
В таблице 
С развитием пренатальной диагностики и медицинской техники доступ к фетоплацентарной системе с помощью минимально инвазивных манипуляций позволяет оказывать помощь еще неродившемуся пациенту. Анализируя данные как зарубежных авторов, так и отечественных коллег, можно сделать вывод, что большинство наблюдаемых детей из монохориальных двоен, подвергнутых оперативному лечению, в результате которого остались в живых оба плода, родились недоношенными. Средний гестационный возраст у этих детей составил 33,5±2,7 нед [51]. Было отмечено, что лучшие перинатальные исходы были в группах, в которых остался в живых один плод. Гестационный возраст детей этой группы при рождении составил 38,4±0,7 нед. Новорожденные имели более высокие антропометрические показатели физического развития, что является немаловажным фактором для дальнейшего течения раннего и позднего неонатального периодов [51].
Заключение
Несмотря на колоссальный опыт, накопленный с момента внедрения малоинвазивных хирургических способов коррекции СФФТ, решение вопроса о применении альтернативных методик в каждом конкретном случае может сопровождаться определенными трудностями [52]. Мы полагаем, что дальнейшее изучение ультразвуковых и фетоскопических факторов прогноза благоприятного исхода лазерной коагуляция плацентарных анастомозов позволит более взвешенно подходить к выбору оперативной тактики и персонифицированному консультированию пациенток.