синдром липких тромбоцитов что это
Гормональная контрацепция и тромбофилические состояния.
| В последние годы в связи с открытием ряда ранее неизвестных генетически обусловленных дефектов гемостаза, предрасполагающих к тромбозу (мутация фактора V Leiden, мутация протромбина и пр.), стало возможным объяснение ранее необъяснимых случаев тромботических осложнений при приеме оральных контрацептивов (ОК). Это, несомненно, должно способствовать правильному отбору пациенток для гормональной контрацепции. Учитывая дороговизну генетических исследований в качестве скрининга перед назначением гормональной контрацепции, следует внимательно изучать семейный и личный тромботический анамнез, наличие дополнительных факторов риска (курение, ожирение и пр.). Однако хотя таким образом можно снизить риск тромботических осложнений, избежать их полностью не удается. К сожалению, тот или иной генетический дефект, предрасполагающий к тромбозу, чаще всего диагностируется уже после эпизода тромбоза [6-8, 11]. |
Целью исследования явилось изучение роли генетических форм тромбофилии в структуре тромботических осложнений при приеме ОК второго и третьего поколений.
Для генетических исследований отобраны 39 женщин в возрасте 18-32 лет из 474 получавших комбинированные ОК второго и третьего поколений (мерсилон, силест, три-регол) в течение 3-18 мес.
Таблица 1. Наследственные тромбофилические состояния у 39 обследованных пациенток
 |
Таблица 2. Результаты специальных генетических исследований скрытой тромбофилии у пациенток с клиническими (15) и лабораторными (24) проявлениями тромбофилии (39)
 |
Примечание. +/- гетерозиготная форма; +/+ гомозиготная форма.
Таблица 3. Прямые методы диагностики тромбофилии у 39 женщин с клиническими и/или лабораторными признаками тромбофилии на фоне приема ОК второго и третьего поколений
 |
У 9 пациенток причина появления маркеров тромбофилии на фоне приема КОК осталась невыясненной.
При исследовании маркеров тромбофилии их уровень был повышен у всех женщин (табл. 3).
Анализ агрегации тромбоцитов позволил выявить повышение активности тромбоцитов у 20 женщин. Отмечалось преобладание «высоких» агрегационных кривых, с отсутствием второй волны. При этом стимуляция слабыми агонистами (АДФ 1·10, АДФ 1·10) не сопровождалось характерной дезагрегацией.
У 1 женщины отмечалось изолированное повышение агрегации тромбоцитов при стимуляции исключительно АДФ и адреналином в концентрации 1·10, 1·10; 1·10 и 1·10 соответственно. Остальные индукторы агрегации (ристомицин, коллаген, арахидоновая кислота) не вызывали повышенной агрегации тромбоцитов. Учитывая вышесказанное, а также клинические проявления в форме тяжелой мигрени, нами были обследованы мать, отец и брат пациентки. Только у матери были обнаружены подобные изменения агрегационной активности тромбоцитов. При более детальном сборе анамнеза выяснилось, что у матери пациентки во время последней беременности были эпизоды транзиторных ишемических атак. На основе данных агрегационной активности тромбоцитов, клинических проявлений и анамнестических данных нами был поставлен диагноз синдрома липких тромбоцитов.
Рутинные методы исследования гемостаза (АЧТВ, АВР и пр.) не обнаружили каких-либо изменений, что подтверждает нецелесообразность применения этих методов в качестве скринирующих методов для выявления тромбофилии.
В табл. 4 представлены параметры гемостаза у обследованных женщин.
1. Пациентка Л., 18 лет, на 2-м месяце приема ОК третьего поколения развился илеофеморальный тромбоз. Половая жизнь с 17 лет, беременностей в анамнезе не было. До назначения ОК пациентке были проведены скринирующие исследования на предмет тромбофилии (ТАТ, D-Dimer). Функции тромбоцитов в пределах нормальных величин. Проба на ВА отрицательная в трех скринирующих исследованиях. Семейный анамнез не отягощен, у пациентки также не было тромбозов в анамнезе. Поэтому тромботическое проявление на фоне приема ОК было неожиданным и послужило причиной для более подробного анализа семейного анамнеза и проведения исследований, направленных на выявление генетической формы тромбофилии.
Таблица 4. Параметры системы гемостаза на фоне приема ОК второго и третьего поколений
Уровень АТ-III и протеина С был в пределах нормы. Однако при проведении ДНК-диагностики выявлено наличие гетерозиготной мутации гена MTHFR С677Т и гетерозиготной мутации гена фактора V Leiden. Таким образом, имел место мультифакториальный генез тромбофилии. Уровень маркеров тромбофилии был значительно повышен: комплексы ТАТ 5,5·10г/л, D-Dimer > 3 мкг/мл.
При более тщательном анализе семейного анамнеза выяснилось, что у матери пациентки был отягощенный акушерский анамнез (привычное невынашивание, преждевременная отслойка нормально расположенной плаценты). У деда по отцовской линии — рак толстой кишки. Родителям пациентки также был проведен ДНК-анализ. При этом у матери была выявлена гетерозиготная мутация фактора V Leiden, у отца — гомозиготная мутация MTHFR С677Т.
Пациентка переведена на антикоагулянтную терапию. Рекомендованы альтернативные методы контрацепции.
Анализируя приведенный клинический случай, следует отметить, что молодой возраст пациентки, когда тромботического анамнеза может еще нет (беременности, оперативных вмешательств и пр.), должен особо настораживать при назначении комбинированных ОК. В таких случаях необходимо выяснять не только тромботический семейный анамнез, но и акушерский и общесоматический анамнез родителей, учитывая роль генетических дефектов гемостаза, предрасполагающих к тромбозу, в патогенезе акушерских осложнений, онкологических и других заболеваний.
Идеально при назначении комбинированных ОК юным пациенткам проводить генетические исследования на предмет генетических дефектов гемостаза, предрасполагающих к тромбозу, хотя следует признать, что эти исследования не всегда и не везде возможно осуществить не только из-за их дороговизны, но и, в первую очередь, из-за отсутствия возможности диагностики в широкой практике [10, 11, 15].
2. Пациентка К., 30 лет. В анамнезе 1 искусствен
ный аборт на ранних сроках беременности без осложнений. Соматический анамнез не отягощен. Ранее от беременности предохранялась барьерными методами. После искусственного аборта стала предохраняться от беременности КОК третьего поколения три-реголом. На 3-м месяце приема комбинированного ОК стала отмечать боли в икроножных мышцах, мигрень. При первичном скрининге у пациентки маркеры тромбофилии (TAT, D-Dimer) в пределах верхней границы нормы (2,5·10г/л, 0,5 мкг/мл соответственно), проба на ВА отрицательная, функция тромбоцитов также в пределах верхней границы нормы (Т = 48±2,5 с различными агонистами).
При допплерометрии обнаружен тромбоз глубоких вен левой голени. Пациентке начата терапия антикоагулянтами, фолиевой кислотой и витаминами группы В. Рекомендованы альтернативные методы контрацепции.
Таким образом, гипергомоцистеинемия и АФА (ВА) были причиной мультифакториальной тромбофилии, которая на фоне гормональной контрацепции дополнительного тригера реализовалась в форме тромбоза глубоких вен голени. Здесь же следует отметить, что наличие приступов стенокардии у отца в довольно молодом возрасте должно было насторожить врача в отношении гипергомоцистеинемии, которая, как известно, является причиной ранней заболеваемости коронаров и тромбозов.
Обсуждение и выводы
Подводя итог, следует еще раз отметить, что современная гормональная контрацепция является значительным достижением клинической медицины, поскольку способствует утверждению современной концепции планирования семьи, повышению качества жизни женщины. Гормональная контрацепция существенно снижает число нежелательных беременностей, играет доминирующую роль в профилактике абортов и послеабортных осложнений, угрожающих жизни женщины, и является одним из интегральных факторов, снижающих материнскую смертность [3, 5, 6, 8].
Тем не менее, несмотря на значительное улучшение качества ОК за последние 10-15 лет, полностью избежать ятрогенных тромбофилических осложнений не удалось. Во многом пониманию этих явлений способствовало открытие за последние 7 лет ряда ранее неизвестных скрытых генетически обусловленных дефектов гемостаза, предрасполагающих к тромбозу (мутация фактора V Leiden, мутация протромбина G20210А, синдром липких тромбоцитов, дефект Wein—Penzing, гипергомоцистеинемия и пр.). Другим важнейшим фактором, объясняющим возникновение сосудистых и внутрисосудистых расстройств при применении современных контрацептивов, явилось установление роли циркуляции АФА и антифосфолипидного синдрома при ряде состояний организма, среди которых важнейшее значение для обсуждаемой проблемы имеет бактерио- и вирусоносительство, наличие стертых форм системных заболеваний, прием ряда лекарственных препаратов [5, 12, 14, 15].
Сочетание скрытых форм генетической и приобретенной тромбофилии является крайне неблагоприятным фоном для применения даже современных низкодозированных комбинированных ОК. Проблема осложняется еще и тем, что наиболее часто современные контрацептивы используют молодые женщины, еще не имеющие тромботического анамнеза, что не исключает наличие у них генетической предрасположенности к тромбозам [4, 13].
В связи с этим мы считаем оправданной при рекомендации гормональной контрацепции оценку семейного тромботического анамнеза. При этом следует обратить внимание на наличие не только тромбозов и тромбоэмболий у отца, матери, братьев, сестер, но и инфарктов, привычного невынашивания, тяжелых гестозов, преждевременной отслойки нормально расположенной плаценты и пр. При подозрительном анамнезе крайне желательно проведение скринирующих и специальных исследований системы гемостаза [9].
Диагностически важным критерием является уровень гомоцистеина в крови, высокие концентрации которого диктуют необходимость выявления генетического дефекта и/или соответственно приобретенных факторов гипергомоцистеинемии [15].
К сожалению, весьма часто диагностика генетической формы тромбофилии осуществляется уже после тромботического эпизода. Возможно, в будущем генетические исследования тромбофилии будут и в нашей стране общедоступны, что позволит при необходимости резко повысить уровень скрининга.
Следует также отметить, что в свете полученных за последние годы данных о роли генетических форм тромбофилии в патогенезе осложненного течения беременности своевременное их выявление приобретает огромное прогностическое значение.
А.Д. Макацария, М.А. Джангидзе, В.О. Бицадзе, А.Л. Мищенко, Н. Шахаратова, Н.В. Сусарева
Кафедра акушерства и гинекологии медико-профилактического факультета Московской медицинской академии им. И.М. Сеченова
1. Савельева И.С. Молочные железы и гормональная контрацепция. Гинекология 1999; 1: 1: 2, 3.
2. Габуния М.С., Лобова Т.А., Чепелевская Э.Н. Состояние молочных желез при гормональной контрацепции. Акуш и гин 1999; 6: 26-30.
3. Нерсесян Р.А. Современные тенденции в развитии методов контрацепции. Пробл репрод 1998; 5: 5-11.
4. Прилепская В.Н., Тагиева А.В. Гормональная внутриматочная рилизинг-система «Мирена». Контрацепция и здоровье женщины 2000; 1 (5): 11-19.
5. Серов В.Н., Прилепская В.Н., Кожин А.А. Гормональная контрацепция. Контрацепция и здоровье женщины 2000; 1 (5): 36-45.
6. Саидова Р.А. Современные контрацептивы. Рус мед журн 2000; 8: 11: 453-460.
7. Саидова Р.А., Макацария А.Д. Климактерический период: возможности заместительной гормональной терапии. Рус мед журн 1999; 7: 18: 870-874.
8. Саидова Р.А., Макацария А.Д., Джангидзе М.А. Гормональные контрацептивы оптимальный выбор. Рус мед журн 1999; 7: 18: 878-882.
9. Lane D.A., Mannucci P.M., Bauer K.A. et al. Interited thrombophilia: part 2. Thromb Haemost 1996; 76: 824.
10. Bertina R.M. Molecular risk factors for thrombosis. Thromb Haemost 1999; 82: 601.
11. Van Boven H.H., Reistma P.H., Rosendaal F.R. et al. Factor V Leiden (FVR 506Q) in families with inherited antithrombin deficiency. Thromb Haemost 1996; 75: 417.
12. Quenherberger P., Loner U., Kapiotis S. et al. Increased levels of anticulating trombomodulin during use of oral contraceptives. Thromb Haemost 1996; 76: 729.
13. Corand J., Hovellou M.H., Van Dreden P., Lecompte Т., Samama M. Thrombosis and pregnancy in congenital deficiencies in antithrombin III, protein С or protein S: study of 78 women. Thromb Haemost 1990; 63: 319.
14. Ginsberg J.S., Kearon C., Douketis K. et al. D-dimer and impedance plethysmography in patients with suspected deep vein thrombosis: results of a management trial. Arch Int Med 1997; 157: 1077.
15. Hemostasis and Thrombosis: Basis Principles and Clinical Practice. Ed. Robert W. Colman et al. Fourth Edition, 2001.
Врач:
— Сколько Вам лет, мадам Мулен?
— Я недавно подошла к 30-ти….
— И что же вас так задержало в пути?
Повышенные и сниженные тромбоциты в крови
Тромбоциты — основа нашей свёртывающей системы. Чем грозит избыток и недостаток «кровяных пластинок»?
Мы продолжаем серию публикаций о лабораторных исследованиях крови. На нашем портале вы можете найти полезные сведения о том, как самостоятельно расшифровать показатели в общем и биохимическом анализах, а также в липидном профиле. В этот раз доктор Федоров отвечает на вопросы об уровне тромбоцитов в крови:
Способность крови свёртываться – одна из основ жизни. Ведь если бы этот механизм не был заложен, любая, самая незначительная рана, становилась смертельно опасной. За свёртывающую систему отвечает целый ряд биохимических соединений, который принято называть факторами, но основу процесса составляют самые маленькие форменные элементы крови – тромбоциты. К сожалению, нарушение в работе этой системы может привести к последствиям, не менее серьезным, чем кровотечение.
Избыток тромбоцитов грозит повышением риска внутрисосудистого тромбообразования, низкие тромбоциты в крови – причина внутренних кровоизлияний.
О чём говорит снижение уровня тромбоцитов в крови?
Нижняя граница нормы содержания тромбоцитов крови составляет 150 тыс/мкл. Причиной снижения PLT (обозначение тромбоцитов в анализе крови) могут оказаться многочисленные, но редко встречающиеся врождённые тромбоцитопении (синдром Фанкони, Вискотта-Олдрича и т. д. ), а также тромбоцитопении приобретённые. Самая частая причина приобретённых – постоянный приём препаратов антиагрегантов, особенно при двухкомпонентной терапии (ацетилсалициловая кислота + клопидогрель), к счастью, число тромбоцитов в этом случае обычно снижено не сильно. Среди других причин низких тромбоцитов в крови – бактериальные и вирусные инфекции, анемии, спленомегалия, застойная сердечная недостаточность и т. д.
Клинические признаки тромбоцитарной недостаточности (кровоточивость дёсен, появление синяков, частые кровоизлияния в склеру и т. д. ) появляется при снижении уровня тромбоцитов ниже 50 тыс/мкл – это тот показатель, когда к врачу-гематологу нужно идти незамедлительно.
О чём говорит повышение уровня тромбоцитов в крови?
Верхняя граница нормы тромбоцитов в анализе крови — 400 тыс/мкл. Повышение уровня тромбоцитов гораздо чаще происходит по физиологическим причинам. Это так называемые реактивные тромбоцитозы. Их причиной может оказаться недавнее физическое перенапряжение, перенесённый стресс, обезвоживание, то есть физиологическое сгущение крови. К патологическим факторам чаще всего относятся те из них, которые тоже сгущают кровь – анемия из-за хронической кровопотери или острая кровопотеря, обезвоживание в результате интоксикации. К причинам абсолютного повышения уровня тромбоцитов относят воспалительные заболевания, туберкулёз, злокачественные новообразования вообще и системы кроветворения в частности.
Как образуется тромб? Зачем назначают анализ на индуцированную агрегацию тромбоцитов?
В норме тромбоциты в крови находятся в неактивном состоянии, клетки имеют дискоидную, немного вытянутую форму, поэтому в старых учебниках их называют «кровяные пластинки». Когда начинается кровотечение, тромбоциты активируются: приобретают сферическую форму и образуют специальные выросты – псевдоподии. С их помощью они могут соединяться друг с другом (агрегировать) и прилипать к месту повреждения сосудистой стенки (адгезировать). Два этих процесса обеспечивают основу тромбообразования.
Чтобы оценить качество агрегации тромбоцитов и выяснить, не снижена ли она, или, наоборот, не происходит слишком интенсивно, назначают анализ на индуцированную агрегацию тромбоцитов. Для этого берут кровь из вены, добавляют к ней специальные вещества (индукторы активации) и оценивают процесс.
При подготовке к исследованию важно соблюдать некоторые условия – в течение 3 дней соблюдать специальную диету, составленную врачом, за 24 часа исключить прием стимуляторов (кофе, алкоголь, никотин, чеснок) и препаратов иммуностимуляторов, за 8 часов отказаться от приема лекарств и жирных продуктов.
Низкая активность тромбоцитов встречается при заболеваниях системы кроветворения, постоянном приеме препаратов антиагрегантов, в этом случае продолжительность кровотечения увеличивается. Повышенная агрегация, наоборот, увеличивает риск тромбообразования: венозных тромбозов, инфаркта, инсульта. Вы спросите – зачем назначать анализ на индуцированную активацию, если риск кровотечения/тромбообразования можно оценить по общему количеству тромбоцитов? Увы. Даже при нормальном их количестве большая часть клеток может оказаться «неполноценными», таким образом речь идёт о выраженной тромбоцитарной недостаточности при их нормальной концентрации в крови.
Почему важно назначать анализ крови на резистентность тромбоцитов к аспирину и клопидогрелю?
Согласно данным исследований, 35% людей имеют сниженный антиагрегационный эффект на применение аспирина, а у 19% он практически не влияет на агрегацию. Это значит, что у каждого пятого пациента аспирин не помогает избежать осложнения атеросклероза. Меньшее распространение, но не меньшую клиническую важность играет резистентность к клопидогрелю – препарату, приём которого жизненно важен после стентирования артерий. Поэтому, считается оправданным назначать анализ на аспирино- и клопидогрелерезистентность перед назначением этих препаратов, особенно, когда запланировано стентирование коронарных артерий. Для диагностики резистентности к аспирину сегодня применяются 2 теста: оптическая аггрегометрия, считающийся «золотым стандартом», а также несколько разновидностей портативных тест-систем. Похожий подход применяется и для диагностики резистентности к клопидогрелю, которая, по данным исследований регистрируется у 11% больных, получающих препарат. В случае выявления резистентности у врачей остаётся пространство для маневра – назначить препарат из другой группы и избежать опасных осложнений.
Уровень тромбоцитов позволяет оценить как риск тромбообразования, так и наоборот, вероятность недостаточной свертываемости крови, грозящей развитием внутренних кровоизлияний и кровотечений. Исследование функции тромбоцитов даёт врачу возможность правильно подобрать антиагрегантную терапию – важнейший компонент профилактики и лечения сердечно-сосудистых заболеваний.
Если у вас остались свои вопросы, вы можете задать их, воспользовавшись сервисом Доктис.
Тромбоцитопения
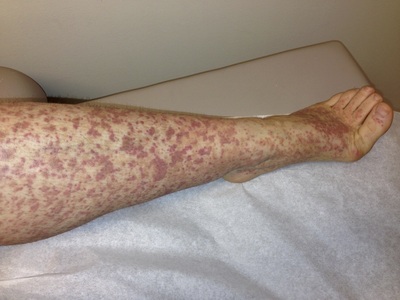
Тромбоцитопения может являться как самостоятельным заболеванием, так и симптомом патологий других органов. Данный вид заболевания получил название «вторичная тромбоцитопения». Это заболевание встречается как у детей, так и у взрослых, однако наиболее характерно оно для школьников и людей среднего возраста.
Классификация болезни
По продолжительности и тяжести симптомов болезнь можно классифицировать как:
Формы болезни
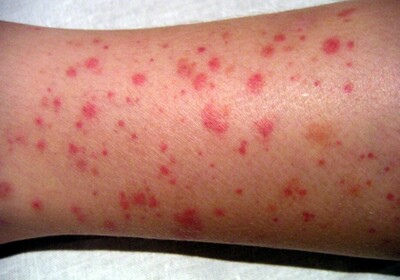
Мегакариоциты – это относительно большие клетки, имеющие длинные, заполненные цитоплазмой отростки, которые в ходе созревания, отделяясь от материнской клетки, попадают в кровоток. Эти отростки собственно и являются тромбоцитами. Стоит заметить, что из одной донорской клеточки может образоваться до 8000 тромбоцитов.
За образование мегакариоцитов отвечает гормон – тромбопоэтин, образующийся в печени, почках и мышечной ткани. Стоит отметить, что между количеством красных клеточек и тромбопоэтина существует прямая зависимость: чем больше образуется тромбоцитов, тем сильнее тормозится синтез тромбопоэтина. Эта закономерность позволяет поддерживать количество вышеуказанных элементов на стабильном уровне.
В случае, если на любом из указанных выше этапов происходит сбой, количество тромбоцитов в сыворотке крови снижается, вызывая тромбоцитопению.
С учетом причин и механизмов развития заболевание может принимать следующие формы:
Наследственная форма
В большинстве случаев данный вид патологии проявляется при наличии прочих сопутствующих врожденных аномалий. А основными ее причинами являются различного рода генетические нарушения (мутации):
Продуктивная форма
К данной группе относят патологии, связанные с нарушением процесса образования тромбоцитов в красном костном мозге. К причинам ее возникновения можно отнести:
Форма разрушения
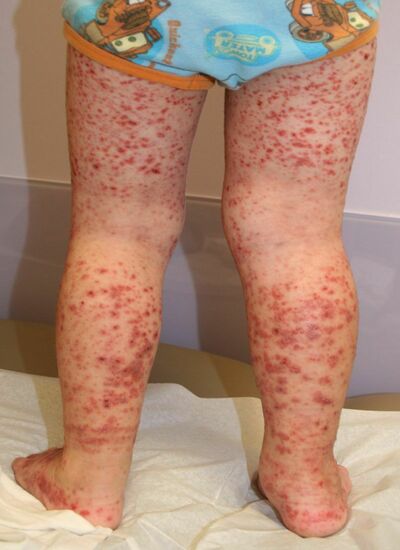
Форма болезни у новорожденных
Возникает в случае несоответствия антигенов, расположенных на поверхности тромбоцитов ребенка, антигенам, расположенным на поверхности красных клеточек матери. Иммунные клетки материнского организма, поступая в кровеносную систему ребенка через плаценту, разрушают его собственные тромбоциты. Описанный выше процесс происходит до 20 недели беременности.
Синдром Эванса-Фишера
Синдром возникает, как следствие развития системных аутоиммунных заболеваний –поражение печени и суставов, системная красная волчанка.
Вирусная форма
В процессе размножения вирусных клеток происходит образование специфических антител, провоцирующих разрушение красных клеточек в селезенке. Вирусами способными спровоцировать болезнь являются: корь, краснуха и грипп.
Посттрансфузионная форма
Патология является следствием реакции организма на чужеродные донорские тромбоцитарные клеточки.
Лекарственная форма
Некоторые лекарственные средства способны после приема связываться с антителами на поверхности клеток, вызывая в организме пациента защитную иммунную реакцию из-за которой происходит разрушение тромбоцитов в селезенке. К препаратам с подобными свойствами относят: «Хинидин», «Мепромбамат», «Хлорихин», «Гепарин» и некоторые виды антибиотиков.
Идиопатическая пурпура
Этот вид патологии характеризуется резким снижением количества красных клеточек в периферической крови при неизменном уровне остальных элементов.
Причины возникновения пурпуры
Современная наука не может выявить точную причину возникновения заболевания. Наиболее популярной теорией является комплексное воздействие внешних негативных факторов и наследственной предрасположенности. Негативные факторы, способные спровоцировать появление болезни:
Механизм возникновения болезни можно объяснить нахождением на поверхности тромбоцитарных клеток – антигенов, которые в случае наличия каких-либо мутаций провоцируют выработку специфических антител, способных взаимодействовать с антигенами и разрушать клетку-носитель.
В случае наличия эссенциальной формы болезни селезенка вырабатывает антитела к антигенам собственных тромбоцитов, которые, закрепляясь на мембранах красных клеточек, помечают их. Помеченные клеточки, проходя с кровотоком через селезенку, отсеиваются и разрушатся.
Благодаря снижению количества красных клеточек в крови начинается их усиленная выработка клетками печени. Скорость вызревания мегакариоцитов и образования тромбоцитов в костном мозге значительно увеличивается. Однако, с течением времени компенсационные возможности костного мозга ослабляются, провоцируя появление первых признаков болезни.
Форма потребления
Активация клеток происходит в сосудистом русле, запуская механизм свертываемости крови. Благодаря усиленной выработке тромбоцитов костный мозг исчерпывает возможности по их созданию, что собственно является причиной возникновения патологии. В случае, если вовремя не начать терапию, уменьшение уровня тромбоцитов в крови может стать фатальным.
К активации форменных элементов может привести:
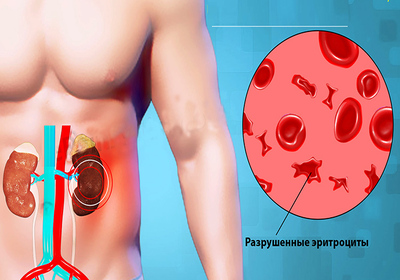
Гемолитико-уремический синдром
Форма перераспределения
В нормальном состоянии в клеточках селезенки откладывается треть от образуемых тромбоцитов. Как следствие у некоторых видов хронических заболеваний происходит увеличение селезенки в размере. Также увеличивается и способность селезенки депонировать тромбоциты (в некоторых случаях до 100% от общего количества красных клеточек). Увеличение селезенки может быть спровоцировано циррозом, системной волчанкой, онкологией, употреблением алкоголя и некоторыми видами инфекций.
Форма разведения
Развивается у людей, перенесших процедуру переливания большого количества донорской крови, плазмы или иных видов физиологических жидкостей. В итоге концентрация собственных тромбоцитарных клеток снижается до уровня, на котором поддержание нормальной свертываемости крови становится невозможным.
Симптомы
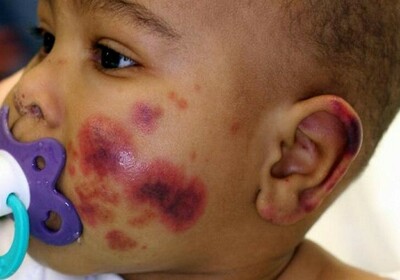
К наиболее часто встречающимся симптомам патологии относят:
Диагностика

Лечение
Терапию патологии проводит квалифицированный врач-гематолог. Определяющий состав терапии назначается только после проведения всесторонней диагностики и оценки состояния здоровья пациента:
Медикаментозная терапия

Наиболее часто для лечения тромбоцитопении используются следующие лекарственные средства:
Немедикаментозная терапия
Лечение заболевания может осуществляться при помощи оперативных и терапевтических методов и мероприятий. Чаще всего врачи-гематологи используют:
Терапия при беременности
Лечение патологии у беременных требует аккуратного и грамотного подхода. Зачастую будущим мамам назначают непродолжительные курсы стероидных противовоспалительных препаратов для того, чтобы ускорить рост и формирование плода и спровоцировать досрочное родоразрешение.
В случае неэффективности этого метода применяют внутривенные инъекции иммуноглобулина. За весь период вынашивания плода производят четыре инъекции, и одну сразу после родов. В ситуации, в которой возникает опасность для жизни матери или ребенка прибегают к прямому переливанию донорской крови.
Если вышеуказанные меры не принесли результата, проводится операция по резекции селезенки. Стоит отметить, что операция может быть проведена только в третьем триместре беременности. Наиболее предпочтительным является применение малоинвазивной хирургии.
Вопрос родоразрешения решается индивидуально, исходя из тяжести заболевания и сопутствующих рисков. Наиболее безопасным считается кесарево сечение.
Народные методы лечения
Наиболее эффективным является употребление отвара листьев крапивы, тысячелистника и земляники. Употребляются травы в виде отваров (стакан кипятка, на полстакана листьев).
Также эффективным является употребление кунжутного масла (столовая ложка трижды в день после еды).
Диетическое питание

Опасность
Тромбоцитопения несет существенную опасность для здоровья и жизни больного. Болезнь способна привести к возникновению кровоизлияний в мозг (крайне опасно, может привести к летальному исходу), в сетчатку глаза (при неблагоприятном исходе способно привести к потере зрения) или же привести к возникновению анемии.
Профилактика
Профилактика заболевания сводится к постоянному контролю уровня тромбоцитов в крови, а также к выяснению и предотвращению заболеваний, способных спровоцировать ее появление.