синдром канавана что это такое
Болезнь Канавана
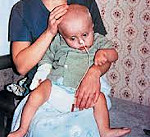
Проявляющееся в раннем детстве неврологическое заболевание, сопровождающееся нарушением моторики, гипотонией мышц, приступами эпилепсии, слепотой и макроцефалией, характеризующееся дефицитом фермента аспартоацилазы, называется спонгиозной дегенерацией, или болезнью Канавана.
По какой причине развивается болезнь Канавана?
Развитие патологии ведёт к демиелинизации нервных волокон головного мозга. Заболевание имеет генномутационную природу развития. Необходимо отметить, что данная патология относится к разряду редко встречаемых неврологических заболеваний. В подавляющем большинстве случаев заболевание развивается на первом году жизни ребёнка. К сожалению, приходится констатировать неутешительные результаты современных методов терапии. Неврологи относят патологию к разряду лейкодистрофии. Причиной развития патологии является мутация гена ASPA, который находится на семнадцатой хромосоме, отвечающего за выработку фермента аспартоацилазы, расщепляющего отдельные молекулы аспарагиновый кислоты, формирующейся в тканях нервной системы. Дефицит фермента неизбежно ведёт к переизбытку аспарагиновой кислоты, в следствие чего происходит разрушение миелиновой оболочки. Данный патологический процесс оставляет нервные клетки незащищенными и значительно ухудшает передачу нейронных импульсов. Болезнь Канавана относят к группе дегенеративных неврологических заболеваний.
В качестве основных симптомов болезни Канавана выделяют:
Как правило, к двухлетнему возрасту атрофируется зрительный нерв, что приводит к полной потере зрения.
Высокую концентрацию аспарагиновой кислоты позволяет установить общий анализ мочи. Для точной диагностики необходимо провести биохимический анализ крови, диагностику ДНК, магнитно-резонансную томографию. После подтверждения диагноза болезни Канавана невролог назначает симптоматическую терапию.
Как мы уже говорили выше, прогноз неутешительный. В большинстве случаев летальный исход наступает до достижения ребёнком десятилетнего возраста. Сегодня в специализированных клиниках проводят искусственную замену матированного гена на здоровый. Это позволяет значительно продлить жизнь больному, однако летальный исход неизбежен. Все, чего пока удалось добиться врачам в области лечения болезни Канавана — это увеличить продолжительность жизни больного до двадцати лет. На сегодняшний день отсутствует также специфическая профилактика данной патологии.
Новости
Болезнь Канавана – грозный враг детей
Рождение ребенка – большая радость для отца и матери. Но иной раз, к сожалению, это событие оборачивается горем, когда становится ясно, что малыш поражен тяжелым и неизлечимым заболеванием. Одно из таких заболеваний – болезнь Канавана (или, точнее, «болезнь Канавана – ван Богерта»). Этот грозный недуг представляет собой наследственно-дегенеративное поражение нервной системы, приводящее к дистрофии белого вещества головного мозга. Как следствие – резкое ухудшение общего состояния и развития ребенка, нарушение моторики, трудности при глотании пищи, мышечная дистрофия. По мере прогрессирования болезни, возникают судороги, эпилептические припадки, ухудшается зрение (вплоть до слепоты). Заболевание довольно быстро приводит к смерти, способов излечения пока не найдено.
Вряд ли нужно объяснять, какая это беда не только для ребенка, но и для его родителей. Поэтому очень важно знать, из-за чего возникает такое заболевание, можно ли его предотвратить и что следует делать, если оно, к несчастью, диагностировано.
В чем причина возникновения болезни Канавана и как она диагностируется
Все вышеуказанные расстройства происходят вследствие генетической мутации, возникающей в 17-й хромосоме человека. Эта мутация приводит к хроническому недостатку в организме ребенка фермента аспартоацилазы, «отвечающей» за расщепление N-ацетил-аспарагиновой кислоты. Указанная кислота возникает естественным путем в процессе жизнедеятельности клеток центральной нервной системы. До тех пор, пока ее концентрация не превышает предельно допустимых величин, она не опасна, но патологически высокий уровень ее содержания в организме приводит к нарушению метаболизма липидов. А это, в свою очередь, вызывает разрушение оболочки нервных клеток (в значительной степени, состоящей из липидов). Нейроны, лишенные оболочки, теряют способность к нормальному функционированию и быстро погибают, со всеми вытекающими последствиями для организма.
Диагноз «болезнь Канавана» ставится ребенку неврологом по результатам анализа мочи на концентрацию N-ацетил-аспарагиновой кислоты. У больного наблюдается неестественно высокое содержание этого вещества (нередко до 20-кратного превышения нормы!) Анализ мочи проводится в большинстве случаев хроматографическим или масс-спектрометрическим методом.
Другие методы исследования, вплоть до МРТ и электроэнцефалографии, затруднительно производить, и к тому же они не дают должной эффективности ввиду малого возраста пациента.
Общие сведения об этом заболевании
Начиная с 19-го века, многие медики фиксировали факт неестественно высокого процента психических расстройств и младенческой смертности среди евреев ашкенази. Изучение этого факта по мере развития науки вообще и медицины в частности позволило Миртелю Канавану в 1931 году описать основные симптомы этого заболевания, получившего его имя. Разумеется, тогда еще не было известно о генетической мутации в 17-й хромосоме, поскольку генетика только начала развиваться и до открытия знаменитой «двойной спирали» было далеко.
А в 1987 году врач Рубен Маталон добился от семьи своих пациентов (где были две девочки с болезнью Канавана) согласия на предоставление их биологических материалов для исследований. Получив образцы тканей девочек, Маталон начал эксперименты с целью обнаружения гена, «ответственного» за развитие болезни, и через несколько лет его усилия увенчались блестящим успехом. (В источниках встречаются упоминания различных дат: 1991 или 1993 год). Впоследствии Маталон разработал тест, позволяющий определить риск развития болезни Канавана у плода во время беременности, что привело к конфликту с Фондом Канавана, который сам, в свою очередь, разработал аналогичный тест и бесплатно распространял его среди беременных. Споры и судебные тяжбы завершились подписанием компромиссного мирового соглашения.
Возникнуть это заболевание может у ребенка любой национальности, но до сих пор в особой «группе риска» находятся евреи ашкенази, поскольку среди них наибольшее число носителей больного гена: порядка одного человека из сорока (т.е. около 2,5%).
Синдром канавана что это такое
а) Терминология:
1. Сокращения:
• Болезнь Канавана (БК)
2. Синонимы:
• Спонгиоформная лейкодистрофия, спонгиозная дегенерация ЦНС, болезнь Канавана-ван-Богарта-Бертрана, недостаточность аспартазилазы, недостаточность ASPA, недостаточность ASP, недостаточность аминоацилазаы 2, недостаточность ACY2
3. Определение:
• Прогрессирующая аутосомно-рецессивная спонгиоформная лейкодистрофия
1. Общие характеристики болезни Канавана:
• Лучший диагностический критерий
о Мегалэнцефалия с диффузным ↑ сигнала от белого вещества на Т2-ВИ и ДВИ, а также ↑ пика NAA
• Локализация:
о Белое вещество (БВ): вовлечение в процесс субкортикальных U-волокон, сохранность внутренних капсул и мозолистого тела
о Таламусы, бледные шары (БШ), ± зубчатые ядра, сохранность хвостатых ядер и скорлупы
2. КТ признаки болезни Канавана:
• Бесконтрастная КТ:
о Диффузное ↓ плотности пораженных зон
3. МРТ признаки болезни Канавана:
• Т1-ВИ:
о Гипоинтенсивный сигнал от пораженных зон
• Т2-ВИ:
о Гиперинтенсивный сигнал от пораженных зон
• ДВИ:
о Гиперинтенсивный сигнал, ИКД от нормального до ↓ в пораженных зонах
• Постконтрастные Т1-ВИ:
о Контрастное усиление отсутствует
• МР-спектроскопия:
о ↑ NAA/Cr, ↓ Cho/Cr
4. Рекомендации по визуализации:
• Лучший инструмент визуализации:
о МРТ
• Совет по протоколу исследования:
о Т2-ВИ, ДВИ и МР-спектроскопия
в) Дифференциальная диагностика болезни Канавана:
1. Болезнь «кленового сиропа»:
• ↑ аминокислот с разветвленной цепью + кетокислот
2. Болезнь Пелицеуса-Мерцбахера:
• ↑ ИКД, сохранность БШ и таламусов
3. Мерозиндефицитная врожденная мышечная дистрофия:
• ↑ ИКД, сохранность БШ и таламусов
4. Болезнь Александера:
• Характерно вовлечение БВ лобных долей, накопление контраста
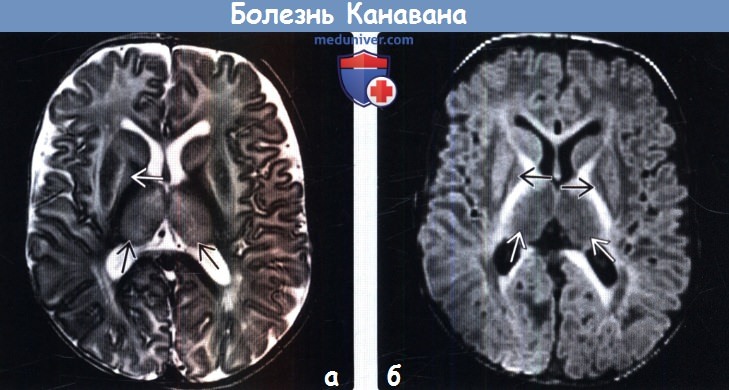
(б) МРТ, Т1-ВИ, аксиальный срез: у этого же шестимесячного ребенка отмечается диффузное снижение интенсивности сигнала от белого вещества, таламусов и бледных шаров. Внутренние капсулы, мозолистое тело, хвостатые ядра, а также скорлупа имеют нормальную интенсивность сигнала.
1. Общие характеристики болезни Канавана:
• Этиология:
о Недостаточность аспартоацилазы (которая метаболизирует N-a-цетиласпартат [NAA]) → ↑ ↑ NAA в головном мозге и моче
• Генетика:
о Аутосомно-рецессивный тип наследования → ген ASPA = длинное плечо 17-й хромосомы
2. Стадирование и классификация:
• Раннее начало → более быстрое прогрессирование
3. Макроскопические и хирургические особенности:
• Отек-набухание головного мозга
4. Микроскопия:
• Спонгиоформная дегенерация белого вещества; набухание астроцитов в БШ и таламусах
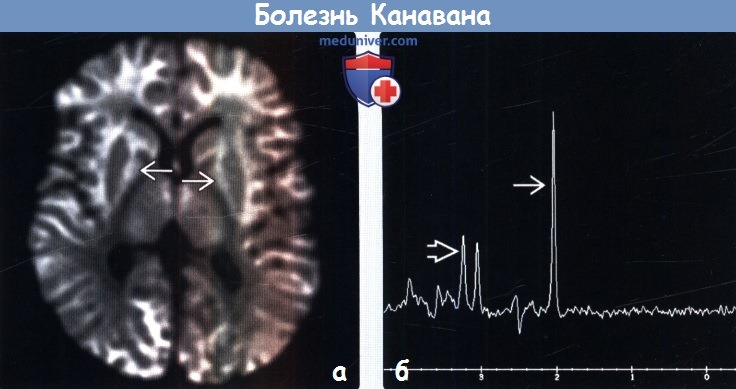
(б) Протонная МР-спектроскопия на томографе 1,5Т в аксиальной плоскости, длинное время эхо (ТЕ = 144 мс), область интереса в полуовальном центре: определяется выраженное относительное увеличение пика NAA и снижение пика холина по отношению к Cr для этого возраста.
г) Клиническая картина:
1. Проявления болезни Канавана:
• Наиболее частые признаки/симптомы:
о Три варианта клинического течения (в зависимости от возраста при постановке диагноза):
— Врожденный (первые несколько дней жизни):
Гипотония, быстрое наступление летального исхода
— Инфантильный (3-6 месяцев)
Наиболее частый вариант
Гипотония, запрокидывание головы, макроцефалия → судороги, мышечная спастичность, потеря зрения
— Ювенильный
о Дебют в возрасте 4-5 лет; наиболее медленно прогрессирующий вариант БК
• Клинический профиль:
о Раннее развитие тяжелой гипотонии и макроцефалия
2. Демография:
• Этническая принадлежность
о ↑ риск у евреев-ашкеназов (носительство в одном из 40 случаев)
3. Течение и прогноз:
• Неумолимо прогрессирующее нейродегенеративное заболевание: хроническое вегетативное состояние с вегетативными кризами → летальный исход к концу первой декады
4. Лечение:
• Методов лечения с доказанной эффективностью не существует (угнетение синтеза NAA путем нарушения работы гена Nat8l у мышиной модели)
д) Диагностическая памятка. Советы по интерпретации изображений:
• Отек-набухание головного мозга с ↑ интенсивности сигнала от белого вещества на Т2-ВИ и ДВИ, вовлечение БШ и таламусов
е) Список литературы:
1. Guo F et al: Ablating N-acetylaspartate prevents leukdystrophy in a Canavan disease model. Ann Neurol. 77(5):884-8, 2015
2. Baslow MH et al: Canavan disease, a rare early-onset human spongiform leukodystrophy: insights into its genesis and possible clinical interventions. Biochimie. 95(4):946-56, 2013
3. van der Knaap MS et al: Defining and categorizing leukoencephalopathies of unknown origin: MR imaging approach. Radiology. 213(1):121-33, 1999
— Вернуться в оглавление раздела «Лучевая медицина»
Редактор: Искандер Милевски. Дата публикации: 24.4.2019
Болезнь Канавана (спонгиозная младенческая дегенерация) — генетическое нейродегенеративное заболевание, в основе которого лежит недостаток фермента аспартоацилазы, приводящий к демиелинизации нервных волокон головного мозга. Болезнь Канавана проявляется в раннем детском возрасте нарушениями моторики и развития ребенка, затруднениями при приеме пищи, мышечной гипотонией, макроцефалией, эпилептическими припадками, слепотой. Диагностируется болезнь Канавана по анализу мочи на N-ацетил-аспарагиновую кислоту. Эффективная терапия заболевания пока не найдена. Производятся попытки лечить болезнь Канавана при помощи метаболической терапии и путем применения генных технологий, способных заменить патологическую аберрацию на здоровый ген.
МКБ-10
Общие сведения
Болезнь Канавана была описана Миртелем Канаваном в 1931 году. А в 1991 году Рубеном Маталоном был выделен ген, отвечающий за это заболевание. Спустя несколько лет стал применяться тест, позволяющий диагностировать болезнь Канавана еще в период ведения беременности. Болезнь Канавана встречается у людей любой национальности. Однако чаще всего ею болеют евреи ашкенази. Среди них носителем генной аберрации, кодирующей болезнь Канавана, является 1 из 40 человек.
Современная неврология относит болезнь Канавана к так называемым лейкодистрофиям — генетически обусловленным дегенеративным заболеваниям нервной системы, в основе которых лежит нарушение метаболизма липидов. Чаще всего нарушения касаются миелина, который на 70-75% состоит из липидов. Распад миелина приводит к разрушению миелиновой оболочки нервных стволов и вторичной гибели нейронов. Лежащая в основе заболевания прогрессирующая демиелинизация делает болезнь Канавана и другие лейкодистрофии схожими с демиелинизирующими заболеваниями головного мозга, которые имеют приобретенный характер (рассеянным склерозом, рассеянным энцефаломиелитом, полирадикулоневропатией Гийена-Барре, болезнью Девика).
Причины возникновения болезни Канавана
Болезнь Канавана связана с генетическим нарушением в геноме ASРА, расположенном в 17-й хромосоме. Вследствие этой генетической аберрации снижен синтез фермента аспартоацилазы, расщепляющего N-ацетил-аспарагиновую кислоту, образующуюся в процессе жизнедеятельности клеток центральной нервной системы. Патологически высокий уровень этой кислоты приводит к повреждению миелиновой оболочки нервных волокон головного мозга. Миелиновая оболочка выполняет роль своеобразного изолятора, не позволяющего нервному импульсу переходить с одного нервного волокна на другое. Таким образом, миелиновая оболочка способствует точному и быстрому проведению нервных импульсов. При ее разрушении этот процесс нарушается, что и является непосредственной причиной клинических проявлений болезни Канавана.
Болезнь Канавана передается по аутосомно-рецессивному типу наследования. Это означает, что в ситуации, когда оба родителя являются носителями патологического гена, вероятность рождения у них ребенка, имеющего болезнь Канавана, равна 25%.
Симптомы болезни Канавана
При рождении ребенок, имеющий болезнь Канавана, ничем не отличается от здоровых новорожденных. Симптомы заболевания начинают проявляться спустя месяц, а чаще в период от 3 месяцев до полугода. Отмечается задержка в развитии, замедленность движений, потеря уже приобретенных двигательных навыков, снижение мышечного тонуса. Возникающие затруднения при глотании обуславливают существенные трудности при кормлении ребенка. Примерно к 4-ому месяцу жизни становиться заметно увеличение головы (макроцефалия). Прогрессирование болезни Канавана сопровождается возникновением эпилептических припадков. Демиелинизация и атрофия зрительного нерва приводит к развитию слепоты.
Диагностика болезни Канавана
Болезнь Канавана представляет для невролога определенные сложности в диагностике, поскольку демиелинизирующий процесс наблюдается при целом ряде как врожденных, так и приобретенных заболеваний. Стандартные методы первичного неврологического обследования, такие как электроэнцефалография и ультрасонография не выявляют специфических изменений. Проведение МРТ головного мозга затруднено из-за слишком раннего возраста пациентов. Наиболее достоверным методом, позволяющим диагностировать болезнь Канавана, является анализ мочи на N-ацетил-аспарагиновую кислоту.
Генетики рекомендуют всем лицам еврейской национальности при планировании беременности проходить скрининг на наличие генной мутации, определяющей болезнь Канавана. Скрининг следует проходить также тем людям, в семье которых наблюдался случай этого заболевания. Разработаны методы пренатальной диагностики, позволяющие установить болезнь Канавана еще до рождения ребенка. Показанием к проведению подобного исследования является установленное носительство патологического гена у обоих родителей. Материалом для исследования на болезнь Канавана служат амниотическая жидкость, полученная в результате амниоцентеза, или ворсины хориона, взятые в ходе трансабдоминальной или трансцервикальной биопсии хориона.
Лечение болезни Канавана
В настоящее время не существует методики, при помощи которой можно было бы эффективно лечить болезнь Канавана. Замедлить развитие заболевания можно при применении метаболической терапии. Она заключается в приеме внутрь целого комплекса лекарственных препаратов: цитрата лития, ацетата кальция, сукцината натрия.
Наиболее оптимистичными среди современных экспериментальных разработок в области лечения болезни Канавана является генная терапия. Разработка метода генной терапии, способного значительно продлить жизнь имеющим болезнь Канавана пациентам, проводится в Нью Джерси (США). Ее идея заключается в клонировании и внедрении в организм здорового гена, способного заменить патологический ген. Носителями нового искусственно синтезированного гена являются непатогенные аденоассоциированные вирусы, которые в растворе водятся в головной мозг через 6 катетеров, установленных в различных его областях. Экспериментальное лечение прошли 13 детей. Их последующее обследование показало, что в результате генной терапии болезнь Канавана замедлила свое прогрессирование, произошло снижение токсичной N-ацетил-аспарагиновой кислоты и увеличение содержание миелина.
Прогноз болезни Канавана
К сожалению, болезнь Канавана приводит к летальному исходу еще в младенческом возрасте. В редких случаях больные доживают до возраста 10 лет.
Случай из практики: болезнь Канавана
Невмержицкая К.С., Никитина Н.В., Сулимов А.В.
ГОУ ВПО Уральская государственная медицинская академия Росздрава, г. Екатеринбург
Резюме.
Болезнь Канавана — это редкое аутосомно-рецессивное заболевание, связанное с мутацией гена аспартоацилазы. Результатом дефицита этого фермента является накопление в центральной нервной системе (ЦНС) N-ацетил-L-аспарагиновой кислоты (NAA) и дефицит ацетата, что приводит к формированию губчатой дегенерации белого и серого вещества головного и спинного мозга. Клинически заболевание проявляется макроцефалией, атрофией зрительных нервов, мышечной гипотонией, сменяющейся спастичностью, судорогами и грубой задержкой развития. Приводится клинический случай ранней диагностики болезни Канавана с типичным развитием заболевания.
Ключевые слова:
болезнь Канавана, N-ацетиласпартат
Развитие большинства лейкодистрофий связано с гипо— или дисмиелинопатиями, возникающими в результате первичного генетического дефекта синтеза миелина или вследствие вторичного влияния на изначально нормально протекающую миелинизацию нервных волокон [8]. В любом случае указанные нарушения влекут за собой тяжелую аксональную дисфункцию, клинические признаки которой проявляются уже в раннем детском возрасте. В этой статье мы представляем современные взгляды на этиологию, механизмы развития и коррекции одной из форм лейкодистрофий — болезни Канавана, так же известной как болезнь Канавана-Ван Богарта-Бертрана или спонгиозная дегенерация центральной нервной системы. Кроме того, мы приводим клиническое наблюдение подтвержденного случая болезни Канавана с типичным развитием заболевания.
Первое описание болезни было представлено в 1931 году Myrtelle Canavan, именем которого и стали называть заболевание [10]. В настоящее время известно, что болезнь Канавана — это редкое генетически детерминированное заболевание с аутосомно-рецессивным типом наследования. Оно встречается повсеместно с увеличением распространенности в популяции евреев-ашкенази, где частота его гетерозиготного носительства составляет 1:40-1:60 [12].
Развитие заболевания связано с дефектом структурного гена ASPA, ответственного за синтез фермента аспартоацилазы (аминоацилазы-2) и экспрессирующегося в олигодендроцитах, печени, скелетных мышцах, фибробластах кожи. В 1994 году в Майами было выяснено, что ген аспартоацилазы включает в себя 6 экзонов и локализован на 17 хромосоме. Позднее с помощью метода флюоресцентной гибридизации in situ было уточнено место расположения гена — 17pter-p13 [7]. К настоящему моменту известно не менее 12 мутаций в гене ASPA, встречающихся в популяции с различной частотой. Более всего распространены точковые мутации по типу нуклеотидных замен. При этом показано, что в еврейской популяции Ашкенази подавляющее большинство случаев (85-98%) болезни Канавана связано с мутациями p.Glu285Ala и p.Tyr231X. Среди европейцев повсеместно встречается мутация p.Ala305Glu в 6 экзоне гена ASPA (40-60% аллелей), которая, по мнению некоторых исследователей, является наиболее древней [12]. Значительно реже по сравнению с точковыми заменами в рассматриваемом гене описаны сплайсинговые мутации, делеции нуклеотидов и целых экзонов. В 2006 году было идентифицировано наличие компаунд-гетерозиготности при болезни Канавана, когда у пациентов на гомологичных хромосомах присутствовали 2 разных аллеля мутантного гена. Авторы описывали более «мягкую» или атипичную клиническую картину у носителей такой мутации: увеличение продолжительности жизни, отсутствие грубого двигательного дефекта и тяжелой задержки развития [5].
В 1988 году Matalon et al., обследуя семьи с болезнью Канавана, вывили значительное повышение концентрации N-ацетил-L-аспарагиновой кислоты в моче больных, чего не бывает при других лейкодистрофиях [10]. Таким образом, было сделано предположение о механизме развития заболевания — формирование метаболического блока на пути расщепления N-ацетиласпартата (NАА). Мутация гена ASPA приводит к снижению активности его продукта — фермента аспартоацилазы, в норме гидролизующей N-ацетил-L-аспарагиновую кислоту на L-аспартат и ацетат. В результате имеют место 2 патофизиологических эффекта — неконтролируемое накопление NАА в ЦНС с одной стороны и дефицит ацетата и аспарагиново й кислоты — с другой.
NАА и в норме выявляется в больших количествах в ЦНС (10 ммоль/г) и, по мнению ряда исследователей, является важным показателем нейрональной жизнеспособности [13]. Однако физиологическая роль NАА до конца не ясна. По одному из предположений, NАА активно вовлекается в нейрональную осморегулцию, и увеличение ее концентрации влечет за собой повреждение миелиновых оболочек и развитие хронического отека [11]. Предполагается так же токсическое действие N-ацетил-L-аспарагиновой кислоты на ткань мозга [1].
В развивающемся мозге NАА — источник ацетата для синтеза в олигодендроцитах ацетил-КоА, жирных кислот и в последующем — липидов мозга. В эксперименте показано, что снижение уровня ацетата в результате блокирования расщепления NАА приводит к снижению количества галактоцереброзидов в ЦНС [2]. Еще одна физиологическая роль ацетата состоит в ацетилировании гистоновых белков хроматина в ядрах олигодендроцитов [2]. Ацетилирование гистонов имеет ведущее значение в эпигенетическом контроле созревания олигодендроцитов, что в случае его нарушения из-за дефицита аспартоацилазы препятствует нормальной дифференцировке этих клеток, дисмиелинизации и сопровождается вакуолизацией серого и субкортикального белого вещества головного и спинного мозга.
Таким образом, вышеуказанные патофизиологические механизмы неуклонно приводят к отеку и губчатой дегенерации белого и серого вещества. При электронной микроскопии выявляют набухшие астроциты с вакуолизированной цитоплазмой и измененными митохондриями [1].
Для болезни Канавана характерно существование возрастного континуума, то есть дебют заболевания приходится на различные возрастные периоды, что позволяет выделить неонатальную, инфантильную и позднюю форму болезни. Наиболее распространена форма с дебютом в 3-5 месяцев после короткого промежутка относительно нормального развития. В первые месяцы дети могут демонстрировать элементы социального поведения — улыбаться, кратковременно гулить, реагировать на контакт. Однако в дальнейшем эти навыки постепенно утрачиваются. Довольно рано возникает атрофия зрительных нервов, что приводит к слабовидению. Типичным проявлением является макроцефалия. Важной особенностью в двигательной сфере следует считать диффузную мышечную гипотонию, которая постепенно трансформируется в спастичность. В первые несколько месяцев еще сохраняются произвольные движения, однако с течением заболевания снижается контроль положения головы, прогрессирует спастический тетрапарез, гиперрефлексия, патологические установки конечностей. С возрастом утяжеляются псевдобульбарные нарушении с тяжелой дисфагией, нередко требующей перехода на зондовое кормление. Нередко развитие заболевания сопровождается нарушением сна, возбудимостью, снижением порога действия раздражителей («стартл-рефлексы»); появляются судороги. Течение заболевания прогрессирующее, резкие ухудшения состояния провоцируются интрекуррентными инфекциями, переохлаждением. Продолжительность жизни от 3 до 10 лет [1, 8, 10].
Среди дополнительных методов диагностики ведущее значение приобретает магнитно-резонансная томография (МРТ), с помощью которой визуализируется довольно характерная картина диффузных симметричных очагов демиелинизации в Т2-режиме в подкорковых областях и в коре. Вовлечение мозжечка и ствола наблюдается реже [6]. На ранних этапах развития заболевания изменения могут не иметь столь выраженного характера, что требует очень тонкой дифференцировки с лейкоэнцефалопатией перинатального, инфекционного или иного генеза. Довольно информативным исследованием является протонная магнитно-резонансная спектроскопия головного мозга, выявляющая повышенную концентрацию NАА в центральной нервной системе [6, 13].
Уточняющими методами диагностики болезни Канавана являются биохимическая и генодиагностика. Наиболее распространенным подходом биохимической диагностики является выявление повышенного содержания N-ацетил-L-аспарагиновой кислоты в моче хроматографическими или масс-спектрометрическими методами. В норме ее содержание не превышает 700 мМ/М креатинина. При болезни Канавана концентрация NАА в моче увеличивается в 20 и более раз. В некоторых случаях прибегают к измерению активности фермента аспартоацилазы в фибробластах кожи [1].
К настоящему времени не накоплено достаточно данных, подтверждающих наличие эффективного метода лечения болезни Канавана. Однако это первое заболевание из всех лейкодистрофий, при котором была предпринята попытка генотерапии [8]. Двадцати одному пациенту с болезнью Канавана нейрохирургическим методом осуществили перенос нормального гена ASPA с помощью вирусного вектора в центральную нервную систему. Результаты проведенных исследований оказались противоречивыми. Наряду с выраженным увеличением активности аспартоацилазы и снижением уровня NАА двигательные улучшения не были столь значимыми, а при проведении нейровизуализации сохранялись явления губчатой дегенерации [4, 9]
Вполне перспективными считаются методы патогенетической терапии. В эксперименте показано, что препараты лития при болезни Канавана, снижают уровень NАА в ЦНС [3]. Шести пациентам в течение 6 месяцев вводили цитрат лития. По данным анкетирования родителей, больные стали более эмоциональными, а на МР-томограммах было отмечено появление миелинизации в белом веществе лобных долей. Двигательные нарушения оставались без изменений.
На основании утверждения, что явления дисмиелинопатии при болезни Канавана связаны с дефицитом ацетата, возникающим в результате блока гидролиза NАА, группой ученых был предложен метод заместительной терапии глицерилацетатом [2]. Показателями эффективности такой терапии стали расширение моторных навыков, увеличение содержания галактоцереброзидов и незначительное уменьшение спонгиформной вакуолизации белого вещества ЦНС. Исследования в области применении глицерилацетата продолжаются и направлены на поиск адекватной дозировки, способа и времени введения препарата, а так же на оценку его переносимости и безопасности.
Приводим собственное клиническое наблюдение случая болезни Канавана. Пациент М. мужского пола родился 5.07.2008 г. в семье русских родителей, не являющихся родственниками. Анте— и интранатальный периоды протекали без особенностей. С 1 месяца мать стала обращать внимание, что ребенок слабо фиксирует взор, не следит за предметами. На плановом осмотре офтальмологом глазного дна обнаружились признаки частичной атрофии зрительных нервов, что явилось поводом для дальнейшего обследования больного.
На осмотре обращали внимание беспокойство ребенка, оживление всех врожденных рефлексов. Определялась макроцефалия (динамика прироста окружности головы — 8 см за три месяца), отсутствие контроля положения головы и фиксации взора, мелкоразмашистый горизонтальный с ротаторным компонентом нистагм, псевдобульбарный синдром, пирамидный гипертонус в конечностях. Ребенок не улыбался, не гулил. При проведении магнитно-резонансной томографии головного мозга выявились зоны полного отсутствия миелинизации, в том числе в стволе и мозжечке, и признаки неполной миелинизации в зрительных нервах, перекресте, трактах и в наружном подкорковом белом веществе (рис.). Подобное распределение зон наличия и отсутствия миелинизации позволило предположить особый вид губчатой дегенерации белого вещества головного мозга — болезнь Канавана. Для подтверждения диагноза помимо клинических и нейровизуализационных признаков требовалось исследование биохимического фенотипа и проведение ДНК-диагностики. При исследовании концентрации N-ацетиласпарагиновой кислоты в моче методом тонкослойной хроматографии определялся ее повышенный уровень — 1463 мМ/М креатинина. Проведение ДНК-диагностики позволило выявить довольно частую мутацию в гене аспартоацилазы (ASPA) p.Ala305Glu в гомозиготном состоянии.
Дальнейшее течение заболевания представляло собой утяжеление нейродегенеративного регресса. Ребенок оставался малоэмоциональным и беспокойным. С 4-5 месяцев появился тремор и вздрагивания конечностей, провоцируемые минимальными раздражителями, как проявления стартл-реакций. В 6 месяцев дебютировали тонические короткие пароксизмы, сопровождающиеся эпилептиформной активностью на электроэнцефалограмме. Регулярное исследование неврологического статуса в динамике констатировало нарастание спастичности в конечностях со снижением объема активных движений, прогрессирующее нарушение глотания, опережение прироста окружности головы.
При осмотре в 1 год 3 месяца состояние тяжелое за счет неврологической симптоматики. Соматически компенсирован. На осмотр реагирует негативно в виде небольшого усиления двигательной активности. При тактильной стимуляции усиливается нистагм, рефлексы орального автоматизма, появляются множественные синкинезии. Окружность головы 55 см (более 97 центили). Со стороны черепной иннервации: взгляд не фиксирует, зрачки равны, фотореакции резко снижены, имеется преходящая установка на расходщееся косоглазие с двух сторон, грубый горизонтальный нистагм, асимметрия лица за счет сглаженности носогубной складки и опущения угла рта справа, псевдобульбарный синдром, девиация языка вправо. Спонтанная двигательная активность резко снижена, периодически отмечается дистоническая установка стоп. Мышечный тонус повышен по преимущественно пирамидному типу, существенно больше справа. Сухожильные рефлексы высокие, с расширением рефлексогенных зон; поверхностные кожные рефлексы снижены. Обращают внимание во время осмотра патологические синкинезии с рук и ног, обилие атипичных рефлексов. Ребенок самостоятельно не удерживает голову, не переворачивается, навыки вертикализации отсутствуют. Узнает голос матери, прислушивается, успокаивается на ее руках, не гулит.
Наследственные нейродегенеративные заболевания в практике невролога встречаются редко. Вот почему так важно определить диагностическую тактику в нужном направлении. Данный клинический случай демонстрирует довольно «простой» диагностический путь, когда однозначное толкование картины МРТ в совокупности с особенностями клинических проявлений являются решающими в назначении дальнейшей уточняющей диагностики. Это особенно важно для заболеваний с разработанными методами патогенетической терапии, когда во время поставленный диагноз определяет раннее начало эффективного лечения. В представленном же случае идентификация мутации в гене ASPA дает возможность проведения пренатальной диагностики последующих беременностей в этой семье.
Литература
1. Краснопольская К.Д. Наследственные болезни обмена веществ [Текст]. М.: Изд-во ГУ НИИ общей патологии и патофизиологии РАМН, 2005. — С.172-173.
2. Arun P., Madhavarao C.N., Moffett J.R. et al. Metabolic acetate therapy improves phenotype in the tremor rat model of Canavan disease. J Inherit Metab Dis. 2010 June; 33(3): 195—210.
3. Assadi M., Janson C., Wang D.J. et al. Lithium citrate reduces excessive intra-cerebral N-acetyl aspartate in Canavan disease. Eur J Paediatr Neurol. 2010 Jul;14(4):354-9.
4. Janson C, McPhee S, Bilaniuk L et al. Clinical protocol. Gene therapy of Canavan disease: AAV-2 vector for neurosurgical delivery of aspartoacylase gene (ASPA) to the human brain. Hum Gene Ther. 2002 Jul 20;13(11):1391-412.
5. Janson C.G., Kolodny E.H., Zeng B.-J. et al. Mild-onset presentation of Canavan‘s disease associated with novel G212A point mutation in aspartoacylase gene. Ann. Neurol. 2006; 59: 428-431.
6. Janson C.G., McPhee S.W., Francis J. et al. Natural history of Canavan disease revealed by proton magnetic resonance spectroscopy (1H-MRS) and diffusion-weighted MRI. Neuropediatrics. 2006 Aug;37(4):209-21.
7. Kaul R., Balamurugan K., Gao G. P., Matalon R. Canavan disease: genomic organization and localization of human ASPA to 17p13-ter and conservation of the ASPA gene during evolution. Genomics 1994; 21: 364-370.
8. Kumar S., Mattan N.S., de Vellis J. Canavan disease: a white matter disorder. Ment Retard Dev Disabil Res Rev. 2006;12(2):157-65.
9. Leone P., Janson C.G., Bilaniuk L. et al. Aspartoacylase gene transfer to the mammalian central nervous system with therapeutic implications for Canavan disease. Ann Neurol. 2000 Jul; 48(1): 27-38.
10. Matalon R., Michals K., Sebesta D. et al. Aspartoacylase deficiency and N-acetylaspartic aciduria in patients with Canavan disease. Am. J. Med. Genet. 1988; 29: 463-471.
11. Moffett J.R., Ross B., Arun P., Madhavarao C.N., Namboodiri A.M. N-Acetylaspartate in the CNS: from neurodiagnostics to neurobiology. Prog Neurobiol 2007; Feb; 81(2):89-131.
12. Sistermans E.A., de Coo R.F.M., van Beerendonk H.M., Poll-The B.T., Kleijer W.J., van Oost B.A. Mutation detection in the aspartoacylase gene in 17 patients with Canavan disease: four new mutations in the non-Jewish population. Europ. J. Hum. Genet. 2000; 8: 557-560.
13. Xu Su, Yang J., Shen J. Measuring N-acetyl aspartate synthesis in vivo using proton magnetic resonance spectroscopy. J Neurosci Methods. 2008 July 15; 172(1): 8—12.
Невмержицкая Кристина Сергеевна
ГОУ ВПО Уралская государственная медицинская академия Росздрава
Россия, 620013, г. Екатеринбург, ул. Репина, д.3
Никитина Наталья Викторовна
СОГУЗ Центр планирования семьи и репродукции человека, г. Екатеринбург
Россия, 620000, г. Екатеринбург, ул. Флотская, д.52
Сулимов Алексей Валентинович
МУ Детская городская клиническая больница № 9