синдром чардж стросса что это
Аллергический (эозинофильный) гранулематозный ангиит (синдром Черджа-Штрауса)
1. Общие сведения
Заболевание, о котором речь пойдет ниже, является не только редким, но и сложным во всех смыслах, начиная с названия. Так, фамилии исследователей, впервые описавших этот синдром – Jacob Churg и Lotte Strauss, – в русскоязычной литературе транслитерируются различным образом: синдром Чарджа-Стросс, Чарга-Страусса и т.п.
Интересно отметить, что ученые работали и сотрудничали в США, причем первый из них имел российско-польские корни (и уже в Америке взял фамилию, сокращенно-производную от фамилии жившего там дяди, врача-дерматолога Луиса Чаргина), а второй – немецкие. В западной медицине, таким образом, их имена произносят как «Чарг и Страусс», однако в заголовке данной статьи мы пользуемся написанием, наиболее распространенным в отечественной литературе. Дж.Чарг эмигрировал в США в 1936 году, а Л.Страусс в 1938; наиболее известная их совместная работа, после которой впервые описанный синдром стали называть по именам авторов, была опубликована в «The American Journal of Pathology» в 1951 году.
Однако истинная сложность этого заболевания связана, конечно, не с названием. Клиническая картина синдрома Чарга-Страусса включает сразу несколько принципиально разных видов патологии: некротизирующий васкулит (воспаление сосудов, в данном случае средних и мелких, с тенденцией к массовому отмиранию клеток), аллергическая гиперчувствительность и/или бронхиальная астма, узелковый гранулематоз, полипоз носовой полости. Точных эпидемиологических данных на сегодняшний день нет, – заболевание встречается очень редко, – однако установлено, что эозинофильной гранулематозной ангиопатией вдвое чаще (по другим источникам, втрое) заболевают мужчины. Клиника обычно манифестирует в зрелые годы (35-45 лет), хотя известные случаи охватывают возрастной интервал от 15 до 70 лет.
2. Причины
Считается, что началу заболевания предшествуют перенесенные бактериальные или вирусные инфекции (под этот фактор риска, впрочем, подпадает любой человек вообще), специфические иммунно-аллергические реакции (в других источниках роль данного фактора отрицается). Изучается также роль наследственной предрасположенности, однако и она на сегодняшний день не получила достоверного подтверждения и обоснования. В целом, этиопатогенез синдрома Чарга-Страусса остается неясным и требует дальнейших исследований.
3. Симптомы и диагностика
Заболевание протекает в три основные фазы (стадии). Первая, продромальная фаза может длиться несколько лет и характеризуется клиникой аллергического ринита, поллиноза (сенной лихорадки) и бронхиальной астмы (гиперреактивности бронхов).
Диагностически значимая атипичность такого состояния заключается в том, что оно развивается обычно у взрослых лиц без известных случаев аллергии в семейном анамнезе. Астма (как новое заболевание или обострение уже имеющейся тенденции к бронхиальной обструкции) встречается более чем у 90% больных и, в среднем, развивается за 3-9 лет до появления прочих симптомов. На этом этапе отмечается насморк, затруднения носового дыхания, синуситы, образование полипов носа, требующих хирургического удаления (иногда неоднократного).
На втором этапе отмечается аномально высокий уровень одной из разновидностей белых кровяных телец, – эозинофилов, – в крови и тканях. В этой фазе симптоматика зависит от того, какие конкретно органы поражены в наибольшей степени. Чаще всего это легкие и желудочно-кишечный тракт. Как правило, наблюдается утрата массы тела, ночная потливость, абдоминальные боли, желудочные и кишечные кровотечения, лихорадка. Такие симптомы могут сохраняться в течение месяцев или лет, спонтанно редуцироваться и затем рецидивировать, иногда уже на фоне клинической картины третьей фазы.
Третья и последняя фаза характеризуется системным васкулитом – воспалением кровеносных сосудов, что приводит к нарушениям кровоснабжения различных органов и тканей. Прочие симптомы приобретают более распространенный и выраженный характер, сочетаясь с симптоматикой собственно васкулита. Образуются гранулематозные узелки с некротическим ядром, – в легких, структурах миокарда, на коже, в кишечнике и пр. Нередко на этой стадии отмечаются инфаркты кишечника, обусловленные поражением абдоминальных артерий, перитониты, изъязвления различных участков ЖКТ, а также серьезная сердечная недостаточность, которая оказывается непосредственной причиной смерти около половины больных синдромом Чарга-Страусса. Относительно реже встречаются осложнения со стороны почек.
Согласно этим данным, при отсутствии всех перечисленных факторов смертность в течение пяти лет составляет 11,9%; при наличии одного любого фактора этот показатель возрастает до 26%, и в присутствии любых двух и более факторов достигает 46%.
4. Лечение
Ведущая роль в терапии синдрома Чарга-Страусса отводится глюкокортикостероидным препаратам и другим иммуносупрессивным средствам. Во многих случаях удается добиться медикаментозной ремиссии, однако заболевание остается хроническим и пожизненным.
В 2015 году Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (US FDA) был сертифицирован к широкому клиническому применению первый препарат для лечения эозинофильного гранулематозного ангиита, получивший название меполизумаб. Пациенты, принимающие этот препарат, отмечают значительное облегчение симптоматики.
Что такое синдром Черджа — Стросса? Причины возникновения, диагностику и методы лечения разберем в статье доктора Клочковой К. С., терапевта со стажем в 9 лет.
Определение болезни. Причины заболевания
Синдром Чёрджа — Стросса относится у группе системных васкулитов. Это группа патологий, при которых ишемия (снижение кровоснабжения) и некроз (омертвение) тканей возникают из-за воспаления кровеносных сосудов.
Симптомы синдрома Черджа — Стросса
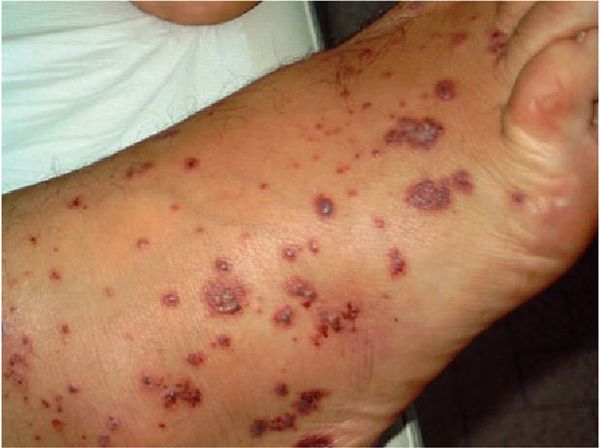
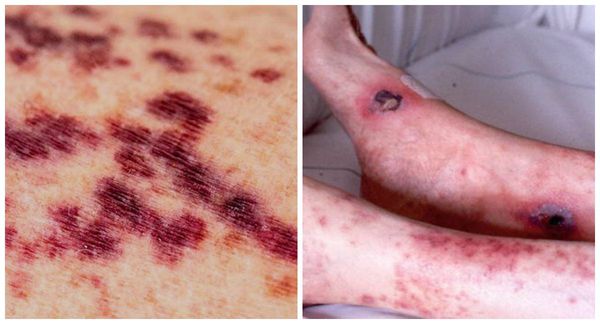
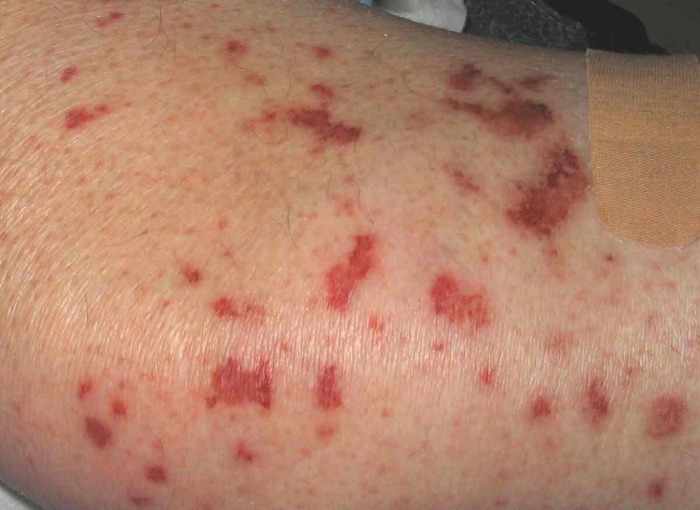
Очень часто при синдроме Чёрджа — Стросса поражается кожа. Причём кожные симптомы могут быть самыми разнообразными: от болезненной пурпуры (скопления крови в тканях, под кожей и слизистыми оболочками) и зуда на нижних конечностях до инфарктов и язв на коже. Но всё же самые частые изменения — это кровоизлияния типа пурпуры и подкожные узелки. С появлением васкулита (воспаления стенок кровеносных сосудов), как правило, приступы бронхиальной астмы уменьшаются или даже купируются, но причины этого неизвестны.
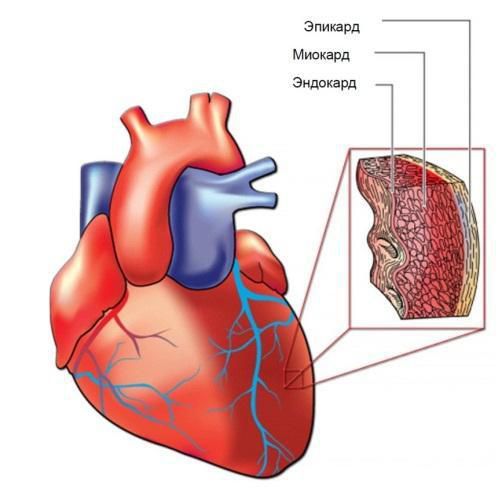
Синдром Чёрджа — Стросса может поражать и сердце, что приводит к нарушению его сократительной способности, нарушению ритма и проводимости. Эозинофилы инфильтрируют (просачиваются) во внутреннюю и среднюю оболочку сердца — эндокард и миокард. Это вызывает эндокардит ( воспаление эндокарда) и рестриктивную кардиомиопатию, которые проявляются нарастающей одышкой и отёками на ногах. Воспаление коронарных сосудов может привести к инфаркту миокарда, а поражение сосочковых мышц — к недостаточности митрального, а иногда и трикуспидального клапанов сердца (также проявляется одышкой и отёками нижних конечностей).
Данный васкулит может поражать и желудочно-кишечный тракт. Пациент при этом почувствует боли в животе, возможно появление диареи. В тяжёлых случаях может развиться перфорация ( образование сквозного отверстия) желудка и кишечника с развитием кровотечения.
Патогенез синдрома Черджа — Стросса
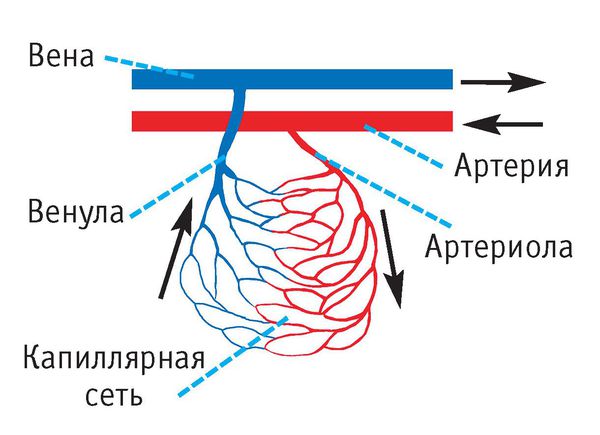
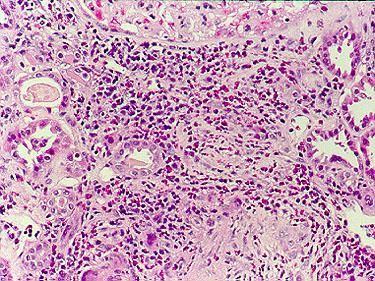
Ведущим в патогенезе эозинофильного гранулематоза является воспаление мелких и средних кровеносных сосудов — артериол, венул, капилляров. Стенки сосудов инфильтрируются нейтрофилами и эозинофилами, в сосудах появляются тромбы и участки кровоизлияний.
У ряда больных (50-70 %) определённую роль в развитии заболевания оказывают антинейтрофильные цитоплазматические антитела (антитела к цитоплазме нейтрофилов — АНЦА, ANCA). Существует две основных гипотезы, которые объясняют роль АНЦА в механизме развития васкулитов.
Первая гипотеза. Из гранул нейтрофилов или из лизосом моноцитов высвобождаются антигенные вещества, которые иммунная система воспринимает как чужеродные. Эти антигены связываются с сосудистой стенкой и образуют иммунные комплексы (комплекс антиген-антитело). Этот комплекс запускает работу системы комплемента — защитных белков, которые участвуют в реализации иммунного ответа организма. Если иммунный комплекс попадает на клетку, белки комплемента разрушают её мембрану. Когда комплексов антитело-антиген в организме становится слишком много, они скапливаются в мелких сосудах (например в коже) и вызывают локальные очаги воспаления.
Классификация и стадии развития синдрома Черджа — Стросса
В зависимости от наличия антител к цитоплазме нейтрофилов (АНЦА) выделяют два варианта васкулита:
Заболевание, как правило, протекает с последовательной сменой трёх фаз.
Осложнения синдрома Черджа — Стросса
При отсутствии своевременного лечения синдром Чёрджа — Стросса прогрессирует, вызывая осложнения со стороны многих систем организма. Часто присоединяется вторичная инфекция (например, инфекционный эндокардит или инфицированные язвы кожи), что усложняет лечение и ухудшает прогноз для пациента.
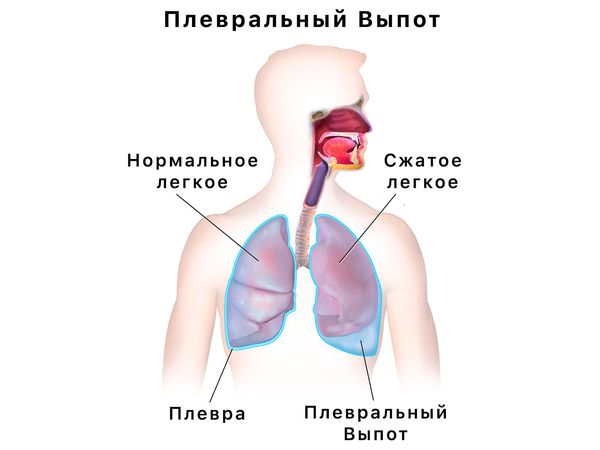
При распространении процесса на плевру (серозную оболочку, покрывающую лёгкие) появляется плевральный выпот (свободная жидкость в плевральной полости с повышенным содержанием эозинофилов) и нарастает дыхательная недостаточность. Редко встречается распад инфильтратов в лёгких с образованием полостей, сопровождающийся кровохарканьем.
Со стороны нервной системы — это инсульты и ишемия зрительного нерва (слепота).
Кровоточащая язва желудочно-кишечного тракта может привести к перфорации желудка или кишечника. Эти осложнения могут быть непосредственной причиной смерти больного.
Диагностика синдрома Черджа — Стросса
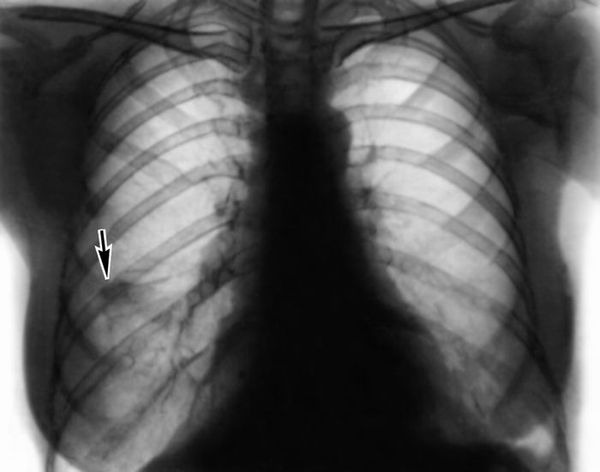
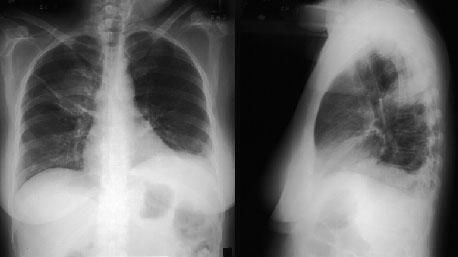
Кроме этого диагностика синдрома Чёрджа — Стросса основывается на клинико-лабораторных данных и результатах инструментальных исследований. При обследовании пациента прицельное внимание направлено на респираторный тракт. Так как клинические проявления могут быть весьма скудными, необходимо выполнение риноскопии (инструментального исследования носовой полости), ларингоскопии (исследования гортани), компьютерной томографии (КТ) придаточных пазух и лёгких. Рентгенография в данной ситуации не всегда достаточно информативна.
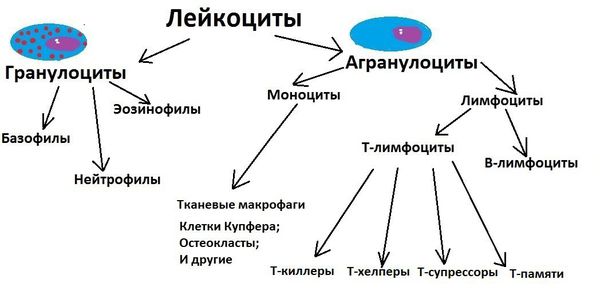
Кроме того, в начале заболевания или при рецидиве часто повышается общий уровень лейкоцитов крови, ускоряется СОЭ, повышается уровень С-реактивного белка (СРБ), уровень общего иммуноглобулина Е (IgE).
Особое внимание в лабораторной диагностике отводят обнаружению АНЦА, так как наличие этих антител позволяет не только выяснить форму васкулита, но и помочь в выборе терапии. При анализе кала выявляют кристаллы Шарко — Лейдена.
Лечение синдрома Черджа — Стросса
Чем быстрее удаётся поставить диагноз и начать лечение, тем больше шансов избежать тяжёлого течения заболевания. Лечением системных васкулитов занимается врач ревматолог в специализированном центре или ревматологическом отделении, при необходимости привлекаются другие специалисты.
Существует две фазы лечения :
При наличии у пациента поражения сердца, полинейропатии, гломерулонефрита, высокой активности заболевания лечение начинают с пульс-терапии. Это активная гормональная (глюкокортикоидная) и цитостатическая терапия циклофосфаном в условиях стационара. Циклофосфан является эффективным иммуносупрессором — средством, подавляющим иммунитет.
При достижении ремиссии дозу глюкокортикоидов постепенно снижают, а цитостатические препараты продолжают принимать от полугода до двух лет, но циклофосфан заменяют на менее токсичные препараты. К ним относят азатиоприн, микофенолата мофетил, лефлуномид.
В случае рецидива заболевания дальнейшее активное лечение проводится по той же схеме. О возможном начале обострения заболевания будет свидетельствовать нарастание уровня эозинофилов крови.
Прогноз. Профилактика
Факторы, которые ухудшают прогноз заболевания:
Так как причина этого васкулита неизвестна, то и профилактика заболевания не проводится. Однако следует избегать факторов, провоцирующих обострение болезни при установленном диагнозе Чёрджа — Стросса: стресс, инсоляция, немотивированный приём медикаментов, курение (в том числе и пассивное), избыточная масса тела.
Синдром Черджа-Стросса
Причина этого заболевания неизвестна. Патогенез также не ясен, однако характерные для заболевания гипергаммаглобулинемия, повышение уровня иммуноглобулина E (IgE), ревматоидного фактора и антинейтрофильных цитоплазматических антител (ANCA) указывают на аутоиммунные механизмы развития этого васкулита.
Клиническая картина
В течении заболевания можно выделить три основные стадии:
Дифференциальная диагностика проводится со следующими основными заболеваниями: гломерулонефрит, острый нефрит, аллергический аспергиллез, астма, лекарственно-индуцированная эозинофилия, эозинофильная пневмония, а также с другими васкулитами.
Европейские руководства рекомендуют следующий план обследования пациентов с подозрением на синдром Черджа-Стросса:
Основными методами лучевой диагностики являются рентгенография и компьютерная томография органов грудной клетки, другие исследования могут быть показаны в зависимости от симптомов и пораженных систем.
При проведении рентгенологического исследования легких может не обнаруживаться никаких изменений (примерно у 25% пациентов); характерно обнаружение легочных инфильтратов, которые могут быть преходящими. Кавитация встречается редко. В некоторых случаях отмечается наличие плеврального выпота.
По возможности следует провести биопсию наиболее доступной пораженной ткани (кожи, легкого, почки, нерва или мышцы). Если невозможно локализовать поражение. рекомендована биопсия мышцы или нерва (наиболее часто выполняется биопсия икроножного нерва)
Лечение и прогноз
Лечение синдрома Черджа-Стросса включает в себя в первую очередь назначение системных глюкокортикоидов. Некоторым пациентам (менее 20%) могут потребоваться также цитотоксические препараты. В случае резистентности заболевания к кортикостероидам применяются также моноклональные антитела (ритуксимаб, омализумаб, меполизумаб). При тяжелом жизнеугрожающем поражении внутренних органов может быть необходима пульс-терапия внутривенными глюкокортикоидами и другими цитотоксическими препаратами. Например, может быть назначен циклофосфамид в виде внутривенных инфузий на 3 месяца с дальнейшим переводом на пероральные цитостатики в качестве поддерживающей терапии. Плазмаферез не показал эффективности в исследованиях у пациентов с синдромом Черджа-Стросса.
Пациенты с этим заболеванием должны постоянно наблюдаться у ревматолога. Следует регулярно оценивать клинический статус, а также контролировать анализ крови (СОЭ, количество эозинофилов). Контроль уровня ANCA не целесообразен, поскольку их уровень не коррелирует с активностью заболевания.
Таким образом, несмотря на то, что синдром Черджа-Стросса является редким заболеванием, клиницисты должны рассматривать его в рамках дифференциального диагноза у пациентов с астмой и полинейропатией, поскольку качество и продолжительность жизни пациентов зависят от своевременности начала иммуносупрессивной терапии.
Синдром Чарга-Стросс
Диагноз считается установленным при наличии четырех признаков из шести. Консенсусная конференция 1994 года в Chappel Hill (Северная Каролина, США) по классификации системных васкулитов не изменила критерии ACR.
Этиология
Причины развития СЧС неизвестны. Возможно, это аллергическая или аутоиммунная реакция организма на факторы окружающей среды или лекарственные средства. Известны несколько случаев развития синдрома индуцированного лекарствами. Описан случай месалазин-индуцированного СЧС у пациента с болезнью Крона и склерозирующим холангитом. В публикациях рассматривается связь между пропилтиоурацилом, метиломазолом и васкулитами, в т.ч. и СЧС. Также есть предположение, что прием антагонистов лейкотриеновых рецепторов и уменьшение дозы или отмена системных глюкокортикоидов ведет к ухудшению течения бронхиальной астмы и приводит к развитию СЧС.
Эпидемиология и патофизиология
Патофизиология синдрома до конца не изучена. Особенностью заболевания является значительная эозинофилия в крови и тканях, ассоциирующаяся с активностью заболевания. Установлено, что у пациентов с СЧС в активной фазе заболевания эозинофилы экспрессируют поверхностные маркеры активации и секретируют биологически активные белки, приводящих к тканевому повреждению. Несомненно, в патогенезе СЧС участвуют цитокины. Показано, что увеличение содержания ИЛ-6 в сыворотке крови предшествует росту ревматоидных факторов в сыворотке крови и определяется в начале обострения СЧС. Таким образом, ИЛ-6 может быть важным пусковым фактором. Установлено, что у пациентов с СЧС отмечается существенный рост уровня интерферона-α и ИЛ-2, а также умеренное повышение ФНО-α и ИЛ-1β, подобно наблюдаемому при узелковом периартериите.
Результаты биопсии пораженных периферических нервных волокон свидетельствуют о том, что при эпиневральном некротизирующем васкулите начинают численно преобладать активированные цитотоксические Т-лимфоциты (CD8+ цитотоксические Т-клетки и CD4+ Т-хелперы) над эозинофилами, включая и воспалительный экссудат. Иногда в воспалительном экссудате обнаруживаются CD20+ (В-лимфоциты), возможно, также определение иммуноглобулина Е (IgE) и антител к C3d.
Предполагается, что АНЦА к миелопероксидазе играют важную роль в патогенезе повреждения сосудистой стенки посредством активации нейтрофилов, адгезии полиморфноядерных клеток к эндотелиальным клеткам сосудов, с последующим литическим повреждением эндотелия.
Клиническая картина
За исключением неспецифических симптомов, которые также наблюдаются при узелковом периартериите (слабость, повышение температуры тела, снижение аппетита и массы тела), на первый план при синдроме Чарга-Стросс выходит поражение органов дыхания.
У большинства больных одним из первых проявлений является бронхиальная астма, особенностью течения которой является появление легочных инфильтратов (у 2/3 больных). Описаны также случаи кровохарканья и альвеолярного кровотечения.
Более чем у 70% больных с СЧС клиническая картина болезни начинается с проявлений аллергического ринита, который часто дает осложнения в виде полипозных разрастаний слизистой носа, рецидивирующих после удаления, и присоединением синуситов.
Изменения кожи, наблюдаемые у 60 % пациентов с СЧС, включают в себя:
Вовлечение в процесс органов ЖКТ — относительно частая клиническая проблема при СЧС. Васкулит и эозинофильный инфильтрат могут привести к ишемии, а в последующем явиться причиной перфорации стенки желудка или кишечника. У пациентов с СЧС выявляются эозинофильный гастроэнтерит, желудочно-кишечное кровотечение, васкулит кишечника.
Поражение нервной системы включает в себя множественный мононеврит или симметричную сенсорно-моторную периферическую полинейропатию. Часто фиксируют изменения со стороны черепно-мозговых нервов, в частности ишемию зрительного нерва. Поражение ЦНС включает развитие гиперкинетического состояния, энцефалопатии, инсультов и психических расстройств.
Лабораторная диагностика
Лабораторным маркером синдрома Чарга-Стросс является эозинофилия (5000-9000 эозинофилов/ мкл), которая наблюдается у 90 % больных. Имеет место нормоцитарная нормохромная анемия, ускорение СОЭ, повышение С-реактивного белка. Антинейтрофильные цитоплазматические антитела выявляются приблизительно у 40 % пациентов с СЧС.У большинства АНЦА-положительных пациентов с CЧС (от 70 до 75%) определяются антитела к миелопероксидазе с перинуклеарным окрашиванием (так называемый MPO-АНЦА или пAНЦA). Показано, что у лиц с СЧС титры пАНЦА коррелируют с тяжестью заболевания; снижение титров этих антител отражало эффективность проводимой иммуносупрессивной терапии и, наоборот, рост титров пАНЦА рассматривался как признак обострения заболевания. Также маркером СЧС является определение эотаксина-3 в сыворотке крови. Отмечено повышение этого показателя при активности процесса у пациентов с СЧС.
Другие методы исследования
Рентгенография органов грудной клетки позволяет обнаружить затемнения или узелки в легких (в 75% случаев),узловатые и билатерально расположенные инфильтраты, которые крайне редко осложняются формированием асептической полости, затемнения симметрично расположены по периферии, признаки плеврального выпота.
Компьютерная томография высокого разрешения проводится с диагностической целью при необъяснимой одышке, выявлении рентгенологических изменений и снижении сатурации кислорода. С помощью этого метода можно визуализировать:
Результаты иммунологического исследования могут показать повышенный уровень IgE в сыворотке крови, гипергаммаглобулинемию, обнаружение ревматоидного фактора в низких титрах, повышенный уровень эозинофильного катионного белка (ECP), растворимого рецептора интерлейкина-2 (sIL-2R) и тромбомодулина (sTM). которые являются маркерами повреждения эндотелия; Повышенный уровень эозинофильного катионного белка и растворимого рецептора интерлейкина указывают на иммунорегуляторный дефект, связанный с васкулитом и эозинофилией.
На бронхоальвеолярном лаваже эозинофилия проявляется в 33 % случаев.
При постановке диагноза нужно исключить другие возможные заболевания, прежде всего узелковый полиартериит, гранулематоз Вегенера, хроническую эозинофильную пневмонию, идиопатический гиперэозинофильный синдром и микроскопический полиангиит. Окончательный диагноз устанавливается по результатам биопсии пораженной ткани.
Лечение
Лечение СЧС проводят комбинацией глюкокортикоидов и метотрексата или микофенолат мофетила. При наличии поражений сердечно-сосудистой, дыхательной и нервной систем возможно применение пульс-терапии метилпреднизолоном.В качестве поддерживающей терапии рекомендуется прием комбинации низких доз глюкокортикоидов и азатиоприна, ритуксимаба, метотрексата или микофенолат мофетила. Необходимо помнить об индивидуальной чувствительности к применяемой терапии, при наличии которой стоит задуматься об отмене препаратов. Пациентам с уровнем сывороточного креатинина ≥500 ммоль/л (5,7 мг/дл) в связи с быстро прогрессирующим гломерулонефритом при установлении нового или рецидивирующего заболевания и для лечения тяжелых форм диффузного альвеолярного кровотечения назначается плазмаферез.