синдром байлера что это
Синдром байлера что это
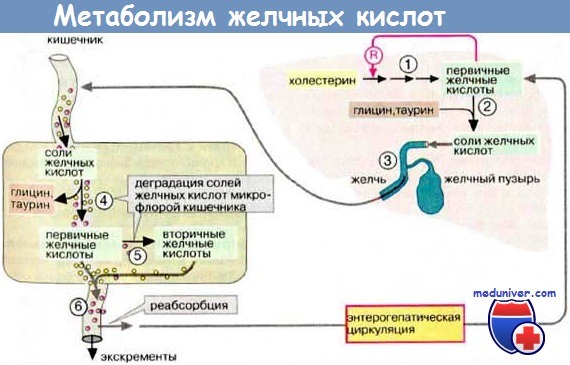
Желчные кислоты активно транспортируются через канальцевую мембрану гепатоцита. Этот процесс является определяющим для секреции желчи. Переход через канальцевую мембрану происходит благодаря специфическим белкам (например, АТФазам Р-типа), насосу экспорта желчных солей и протеину 3, обладающему мультирезистентностью к лекарственным препаратам.
Прогрессирующий семейный внутрипеченочный холестаз (ПСВХ-1) (болезнь Байлера) является редкой сложной патологией, причиной которой служит мутация гена FIC1, кодирующего АТФазу Р-типа. Точная функция этого протеина неизвестна, но похоже, она связана с АТФ-зависимым транспортом фосфолипидов.
Патология заключается в снижении канальцевого транспорта желчной кислоты, которое приводит к образованию аномальной желчи и постепенному разрушению канальцевой мембраны, что обусловливает возникновение холестаза. К гистологическим признакам относят расширение просвета канальцев, вздутие канальцевой мембраны и потерю микроворсин.
Как правило, холестаз сочетается с нормальным уровнем гамма-глютамилтрансферазы сыворотки, что позволяет предположить наличие незначительного повреждения желчных протоков или полную их сохранность.
Прогрессирующий семейный внутрипеченочный холестаз (ПСВХ-2) обусловлен наличием мутации в насосе экспорта желчных солей, что приводит к почти полному отсутствию конъюгированных желчных кислот в желчи. Холестаз возникает в результате цитотоксического действия желчных кислот, которые накапливаются в гепатоцитах.
У младенцев с этим аутосомно-рецессивным заболеванием отмечают прогрессирующий холестаз, но, как и при болезни Байлера, отсутствие убедительных признаков повреждения желчных протоков при нормальном уровне гамма-глютамилтрансферазы сыворотки.
Прогрессирующий семейный внутрипеченочный холестаз (ПСВХ-3) представляет собой еще один редко встречающийся синдром, вызванный мутацией протеина 3, обладающего мультирезистентностью к лекарственным препаратам, и характеризующийся почти полным отсутствием фосфатидилхолина в желчи. При гистологическом исследовании печени выявляются пролиферация желчных протоков и воспалительные инфильтраты в портальных трактах.
У младенцев развивается ранняя желтуха, а также отмечается аномальное повышение уровня гамма-глютамилтрансферазы сыворотки, что свидетельствует о более выраженном повреждении желчных протоков. Несмотря на отсутствие длительных наблюдений, при всех перечисленных дефектах каникулярного транспорта желчи используют эмпирическую терапию урсодиоксихолевой кислотой.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Cемейные формы функциональных гипербилирубинемий в работе практического врача
Ребенок с синдромом Криглера — Найяра I типа Пациенты с функциональными гипербилирубинемическими состояниями длительное время (по нашим данным, от 6 месяцев до 3 лет и более) наблюдаются с первоначально ошибочными диагнозами. Таблица
 |
| Ребенок с синдромом Криглера — Найяра I типа |
Пациенты с функциональными гипербилирубинемическими состояниями длительное время (по нашим данным, от 6 месяцев до 3 лет и более) наблюдаются с первоначально ошибочными диагнозами.
Известно, что синдром желтух у детей представлен массой состояний. И если гемолитические, гепатитные и, реже встречающие в детском возрасте, механические (хирургические = подпеченочные) желтухи хорошо известны педиатрам и учитываются в дифференциальной диагностике, то так называемые семейные формы (функциональные гипербилирубинемические синдромы) чаще описываются в разделе казуистики [3, 4]. Но по мере изменения структуры заболеваемости на первый план выдвигаются наследственные синдромы. Пациенты с функциональными гипербилирубинемическими состояниями, прежде всего дети, длительное время (по нашим данным, от 6 мес. до 3 лет и более) наблюдаются с первоначально ошибочными диагнозами (гепатиты и т. п.). Между тем вспомнить о заболевании — это значит на 50% его диагностировать.
В связи с этим мы решили обобщить данные литературы и результаты собственных наблюдений.
По времени манифестации и тяжести проявлений одно из первых мест занимает синдром Криглера — Найяра [1].
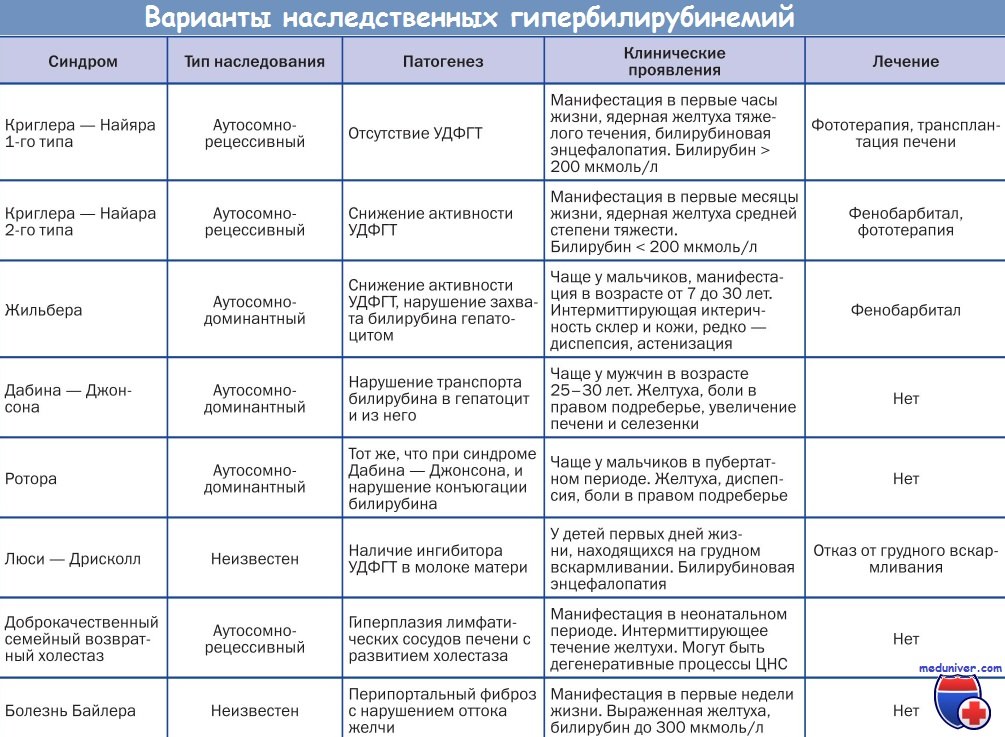
Синдром Криглера — Найяра тип I — врожденная семейная негемолитическая желтуха с ядерной желтухой в результате полного отсутствия уридин-дифосфат-глюкоронилтрансферазы (УДФГТ) при нормальных функциях печени и отсутствии признаков гемолиза или резус-конфликта.
Патогенез заболевания заключается в отсутствии или резком снижении активности УДФГТ [6], в результате чего значительно повышается сывороточный уровень неконъюгированного жирорастворимого билирубина. Он связывается с альбумином, диффундирует через плацентарный и гематоэнцефалический барьеры (последнее — только у новорожденных). Связывающая (своеобразная буферная, компенсаторная емкость) альбумина уменьшается и соответственно клиническое течение синдрома ухудшается при гипоальбуминемии, ацидозе, увеличении концентрации органических ионов, назначении гепарина, салицилатов, сульфаниламидов, употреблении свободных жирных кислот. Проникновение несвязанного, неконъюгированного билирубина в клетки и митохондрии ведет к блокаде окислительно-фосфорилирующих реакций, особенно в гипоталамусе, хвостатом ядре, подкорковых ядрах, мозжечке.
| По частоте среди врожденных функциональных билирубинемий на первом месте стоит синдром Жильбера. Наш опыт работы в многопрофильных педиатрической и терапевтической клиниках показал, что в каждой из них за год выявляется порядка 10—20 случаев синдрома. |
Дифференциальная диагностика (ДД) проводится с синдромами Жильбера — Мойленграхта, Дабина — Джонса, Ротора, Люси — Дрисколла, ядерной желтухой новорожденных любой другой этиологии, врожденными циррозами печени и гепатитами, атрезией желчных ходов или тонкого кишечника (см. табл.).
Значительно благоприятней протекает синдром Криглера — Найяра типа II. Определение его [7] почти в точности повторяет синдром Криглера — Найяра типа I (врожденная семейная негемолитическая желтуха с ядерной желтухой при нормальных функциях печени), с той лишь разницей, что УДФГТ присутствует, хотя активность фермента значительно снижена. Уровень неконъюгированного билирубина может колебаться в пределах 60— 250 мг/л, фекального уробилиногена — 200—800 мг/л. Эффект от применения фототерапии и индукторов микросомальных ферментов хороший. Желтуха редко достигает степени ядерной, больные доживают до 50 и более лет, но в отделенном периоде, особенно при запоздалом лечении, нередки случаи глухоты, хореоатетоза, нейромышечных и личностых отклонений, гипоплазии зубов.
По частоте среди врожденных семейных функциональных билирубинемий на 1-м месте стоит синдром Жильбера. Наш опыт работы в многопрофильных — педиатрической и терапевтической — клиниках показал, что в каждой из них за год выявляется порядка 10 — 20 случаев синдрома. Но истинная частота, видимо, выше, поскольку диагностика заболевания строится главным образом на данных клиники и функциональной пробы с голоданием, а «клиническая мягкость» не привлекает внимание врача. Так, С. Д. Подымова [5] считает, что синдром Жильбера имеют не менее 1— 5% населения. Наблюдая таких больных, мы пришли к заключению, что синдром ассоциируется с генерализованной дисплазией соединительной ткани (особенно часто по типу синдромов Марфана и Элерса — Данлоса).
Патогенез синдрома неоднозначный. Обнаруживается небольшое снижение активности УДФГТ (на 10 — 30% по сравнению с нормой), однако основное значение придается нарушению захвата билирубина гепатоцитами. Последнее связывают с аномалией проницаемости мембран и с дефектом белка внутриклеточного транспорта. Эта гетерогенность клиренса билирубина проявляется также вариабельностью таких тест-субстратов, как бромсульфталеин и индоцианин зеленый.
Клинически для синдрома характерна субиктеричность различной степени выраженности. Чаще это выражается в иктеричности склер, матовой желтушности кожи, особенно лица, иногда частичном пожелтении стоп и ладоней, подмышечных впадин и носогубного треугольника. Нередко больные жалуются на общую слабость, подавленность, плохой сон, трудность концентрации внимания. Влияние голода на повышение содержания билирубина в сыворотке известно и для здоровых, но значительно выражено при синдроме Жильбера. С целью его выявления проводят пробу с голоданием. В течении 48 часов больной получает питание энергетической ценностью 400 ккал/сутки. В день начала пробы утром натощак и спустя 2 суток определяют билирубин сыворотки крови. При подъеме его на 50 — 100% проба считается положительной.
В последнее время многие специалисты полностью идентифицируют его с синдромом Мойленграхта, рассматривая их как одно состояние — синдром Жильбера — Мойленграхта — и определяют его как доброкачественную семейную конституциональную гибербилирубинемию в результате аномалии ферментов печени [7]. Большое значение для диагноза имеет семейный анамнез (легкая желтушность у членов семьи больного). Клиническая картина проявляется интермиттирующей мало выраженной желтухой, никогда не сопровождающейся ядерной. Желтуха усиливается при голодании, о чем говорилось выше, физических перегрузках, оперативных вмешательствах, употреблении алкоголя, инфекционных заболеваниях. Больных беспокоят тошнота, чувство переполнения желудка, тяжесть в эпигастрии, боли в правом подреберье, запоры или диспепсии. Почти у половины больных обнаруживается скрытый гемолиз (группа риска по холелитиазу!). Наряду с уже упомянутыми неврологическими расстройствами в рамках общей дисплазии соединительной ткани, свойственной этим больным, описывают и такие проявления, как пылающие и пигментные невусы, пигментация век, брадикардия и артериальная гипотония. Применение индукторов микросомальных ферментов очень эффективно. Прогноз хороший. Диагноз строится на клиническом исследовании и лабораторно-функциональных пробах. Гистологические находки (см. табл.) неспецифичны и обнаруживаются далеко не всегда. Поэтому ввиду общего нетяжелого состояния пациентов пункционная биопсия печени вряд ли оправданна (напомним, что риск обследования не должен превышать риска неустановленного диагноза и что прежде больные погибали от болезни, позже от лечения, а сейчас — от обследования).
ДД проводится со всеми типами неконъюгированной билирубинемии, синдромом Криглера — Найяра типа II, гемолитическими анемиями, шунтовыми гипербилирубинемиями (неэффективный гемопоэз с интрамедуллярным образованием значительного количества билирубина = талассемия, пернициозная анемия), постгепатической персистирующей гипербилирубинемией.
Синдром Дабина — Джонса — семейное нарушение выведения конъюгированного билирубина в желчные ходы, сочетающееся с отложением пигмента в печеночных клетках и умеренным увеличением печени («шоколадная печень»). При нем отсутствует нарушение глюкоронирования. Патогенез заключается в недостаточности транспорта конъюгированного билирубина внутрь и из гепатоцита. Билирубин попадает в кровь, его уровень в крови повышается, затем он усиленно выводится через почки. Заболевание может дебютировать в любом возрасте (разная пенетрантность гена?), но нередко проявляется после приема гормональных противозачаточных препаратов или при беременности.
| Влияние голода на повышение содержания билирубина в сыворотке известно и для здоровых людей, но значительно выражено при синдроме Жильбера. С целью его выявления проводят пробу с голоданием. В течение 48 часов больной получает питание энергетической ценностью 400 ккал/сутки. В первый день пробы натощак и спустя двое суток определяют билирубин сыворотки крови. При подъеме его на 50 — 100% проба считается положительной. |
Клинически ВВ проявляется в рецидивирующих периодах желтухи разной степени выраженности, но, как правило, не сопровождается зудом; увеличение размеров печени, а затем и селезенки умеренное. Функциональные печеночные пробы не изменены или изменены незначительно, однако наблюдается замедленное выведение контраста в желчный пузырь, повышение уровня копропорфирина I и снижение уровня копропорфирина III в моче. Гистологически в рибосомах печени откладывается меланиноподобный пигмент от желто-коричневого до черного цвета. Купферовские клетки остаются свободными, а соединительная ткань не разрастается.
ДД проводится со всеми формами конъюгированной и неконъюгированной гипербилирубинемии с желтухой: синдромы Жильбера — Мойленграхта, Ротора, Кароли (кистозное расширение внутрипеченочных желчных ходов), гепатиты, первичный билиарный цирроз, холестаз, синдром (симптомокомплекс) Циве. Синдром Циве — симптомокомплекс с гемолитической анемией, гиперлипидемией и желтухой, развивающийся у пациентов с неумеренным потреблением алкоголя. Он обусловлен увеличенным содержанием С16- и С18-жирных кислот в оболочке эритроцитов при уменьшении содержания длинноцепочечных ненасыщенных кислот. Провоцирующим фактором разрушения эритроцитов чаще является употребление алкоголя, после чего развиваются гемолиз и гиперлипидемия. Клинически синдром проявляется в основном после алкогольных эксцессов и сопровождается усиливающимися болями в правом подреберье и/или эпигастрии, лихорадкой, тошнотой, рвотой, потерей аппетита, увеличением размеров печени, а нередко и селезенки. При лабораторных исследованиях — повышение активности трансаминаз, щелочной фосфатазы, гамма-глютамилтрансферазы, анемия с манифестным или скрытым гемолизом, гиперхолестеринемия и/или гипертриглицеридемия. Гистологически — алкогольная жировая дистрофия печени с циррозом или без.
Формой синдрома Дабина — Джонса (или самостоятельной нозологической единицей?) является синдром Бюрка. При этом также обнаруживается липохромный гепатоз, но БЕЗ желтухи, хотя и СО ЗНАЧИТЕЛЬНОЙ гепатоспленомегалией.
Синдром Ротора — идиопатическая семейная доброкачественная гипербилирубинемия с адекватным повышением конъюгированного и неконъюгированного билирубина.
Патогенез заключается в нарушенном захвате неконъюгированного билирубина гепатоцитами, изменении его глюкоронирования и выведении с последующим рефлюксом билирубина в кровь.
Клинически синдром проявляется хронической желтухой (или субиктеричностью) кожи и слизистых. При этом ее интенсивность флюктуирует, увеличения размеров печени и селезенки не наблюдается. Гистологическая картина печени при световой микроскопии не изменена, при электронной микроскопии — митохондрии различных размеров, в фаголизосомах — пигментные тельца в виде решетчатообразных включений [8].
Диагнозы постгепатической доброкачественной гипербилирубинемии и физиологической желтухи новорожденных, постпрандиальных желтух (длительное употребление большого количества тугоплавких жиров), как прогностически благоприятные, строятся на принципе исключения более тяжелых вариантов гипербилирубинемий. Можно предположить, что подобные состояния связаны с маломанифестными ферментными аномалиями или аномалиями развития желчного пузыря (перетяжки, перегибы, особенно — в области сифона, сужения холедоха, приводящие к повышению давления в желчных ходах и избыточной нагрузке на гепатоцит).
| Синдром Дабина — Джонса может дебютировать в любом возрасте (разная пенетрантность гена?), но нередко проявляется после приема гормональных противозачаточных препаратов и при беременности. |
Семейный доброкачественный возвратный холестаз = синдром Аагенеса = Саммерскилла-Тигструппа = норвежский холестаз = холестаз с лимфедемами. Само обилие синонимов говорит о редкости синдрома: каждый вновь описываемый случай представляется авторам как открытие. Поскольку он редко встречается в литературе, определить истинную его распространенность весьма сложно. В основном он известен из описаний скандинавских авторов. Вероятно, патогенез заключается в гипоплазии лимфатических сосудов печени и других органов.
Клинически синдром проявляется как холестаз (наиболее чувствительный и специфический фермент холестаза — лейцин-аминопептидаза) уже в неонатальном периоде. Затем холестаз самостоятельно уменьшается, рецидивируя у взрослых. Медленно развиваются лимфатические отеки. Типичны гепатомегалия и нарушение функций печени. Гистологически он выражен внутрипеченочным холестазом с гигантоклеточной трансформацией.
Хронический холестаз сопровождается дефицитом жирорастворимых витаминов. Дефицит витамина Е приводит к прогрессирующей мозжечково-спинальной дегенерации (синдром Пермуттера).
ДД синдрома Аагенеса проводится со всеми синдромами холестаза и врожденных лимфатических отеков (синдромы Милроя, Вевера — Смита).
Злокачественный семейный холестаз (болезнь Байлера = синдром Клейтон — Юберга). В подавляющем большинстве случаев проявляется на 1-м году жизни [1]. Вначале холестаз (желтуха) самостоятельно разрешается через несколько недель или месяцев. Затем интенсивность желтухи нарастает, присоединяется мучительный зуд. Печень и селезенка существенно увеличиваются. В результате поражения паренхимы печени возникает геморрагический синдром. Эхографически печень выглядит плотной, напоминает цирротическую, в просвете желчного пузыря наблюдается густой застой. Прогноз плохой.
ДД проводят со всеми синдромами холестаза и синдромом Алажиль.
Синдром Люси — Дрисколл — аутосомно-рециссивно наследуемое редкое состояние, проявляющееся массивной гипербилирубинемией, развивающейся у всех детей, рожденных от одной матери страдающей этим заболеванием, в первые четыре дня их жизни.
Патогенез заключается в наличии фактора — ингибитора конъюгации билирубина в крови и моче матери и постнатально в крови и моче детей. Сыворотка таких матерей ингибирует in vitro конъюгацию билирубина в 5 — 7 раз сильнее, чем сыворотка женщин, не являющихся кондукторами данного синдрома. Вероятно, подобный фактор представлен стероидом, но он до сих пор не идентифицирован. Клиническая картина соответствует тяжелой гипербилирубинемии вплоть до ядерной желтухи.
ДД проводится с синдромами Криглера — Найяра типов I и II, новобиоциновой желтухой, эстрогеновой (транзиторная желтуха детей, вскармливаемых грудным молоком) и окситоциновой желтухой.
Лечение семейных функциональных гипербилирубинемий проводится по следующим принципам:
Литература
1. Алажиль Д., Одъевр М. Заболевания печени и желчных путей у детей. М.: Медицина, 1982. — 486 с.
2. Асоян А. В. Применение гипербарической оксигенации в комплексном лечении гипербилирубинемии у новорожденных с гемолитической болезнью. Автореф. дис. к. м. н. М., 1985. — 24 с.
3. Гасан Абу-Джабаль. Хронический гастродуоденит у детей на фоне дисплазии соединительной ткани. Автореф. дис. к. м. н. М., 1997. — 24 с.
4. Имамбаев С.Е. Эхография в диагностике заболеваний желчевыводящей системы у детей. Автореф. дис. к. м. н. М., 1986. — 24 с.
5. Подымова С. Д. Болезни печени. М.: Медицина, 1993. — 544 с.
6. Emery A., Rimoin D. (Ed.) Principles and practice of medical Genetics. London, Vv. 1, 2. — 1983.
7. Leiber B. Die klinischen Syndrome. Muenchen. — 1990.
8. Moelbert E., Marx R. Elektronenmikroskopiesche Untersuchungen am Lebergewebe beim Rotor-Syndrom. Acta hepato-splenoloy, 1966. — 13. — ss. 160 — 175.
Газета «Новости медицины и фармации» Гастроэнтерология (390) 2011 (тематический номер)
Вернуться к номеру
Прогрессирующий внутрипеченочный холестаз (болезнь Байлера)
Авторы: И.В. Шалаева, Донецкий национальный медицинский университет им. М. Горького
Версия для печати
Синдром желтухи у детей обусловлен массой состояний. Если гемолитические, паренхиматозные и реже встречающиеся у детей механические желтухи хорошо известны, то так называемые семейные формы (функциональные гипербилирубинемические синдромы) часто относятся к разделу казуистики. Следует отметить, что пациенты с функциональными нарушениями обмена билирубина достаточно долгое время (по некоторым данным, от 6 месяцев до 3 и более лет) наблюдаются с первоначально ошибочными диагнозами. Между тем вспомнить о заболевании — это значит на 50 % его диагностировать.
У детей раннего возраста дифференциальная диагностика синдрома холестаза вызывает определенные трудности. Благодаря активному изучению в последние годы редких заболеваний этого типа достигнуты значительные результаты в понимании сути механизма холестатических желтух. Важным событием в этом отношении стало выделение болезни Байлера и близких к ней заболеваний.
Болезнь Байлера, несомненно, является редким заболеванием. Однако оно представляет большой интерес и с клинической, и с патофизиологической точки зрения. Впервые данное нарушение было описано у детей Джакоба Байлера и с тех пор названо его именем.
До недавнего времени понятия «прогрессирующий семейный внутрипеченочный холестаз» (ПСВХ) и «болезнь Байлера» отождествлялись. На сегодняшний день, благодаря достижениям в области молекулярной генетики, выделяют три типа ПСВХ. Первым из них является болезнь Байлера.
Развитие ПСВХ обусловлено генетически детерминированным нарушением структуры канальцевой мембраны гепатоцита. Данное заболевание имеет аутосомно-рецесссивный тип наследования и включает три типа (табл. 1).
Наиболее изученным является ПСХВ I типа — болезнь Байлера. В основе этого типа нарушений лежит дефицит мембраносвязанного фермента — П-типа АТФазы, которая играет важную роль в транспорте желчных кислот через канальцевую мембрану гепатоцита. Как следствие, первичные желчные кислоты накапливаются в клетках печени и повреждают их.
В то же время первичные желчные кислоты не поступают в желчную систему и далее в кишечник. Это ведет к нарушению всасывания, в том числе жирорастворимых витаминов А, D, Е, К.
Первые признаки холестаза чаще всего отмечаются уже у новорожденных, реже — в возрасте 1–10 мес. жизни. Особенностью лабораторных изменений при I типе ПСВХ является низкая активность гаммаглутамилтранспептидазы (ГГТП) и низкий уровень холестерина крови. Одновременно отмечается повышение показателей других маркеров холестаза, в том числе активности щелочной фосфатазы (ЩФ), уровней прямой фракции билирубина и желчных кислот.
Фермент ГГТП является мембраносвязанным, локализуется он в основном в эпителиальных клетках внутрипеченочных желчных протоков. Его выделение стимулируют преимущественно желчные кислоты, которые при данном заболевании во внутрипеченочной желчной системе отсутствуют. Ген, ответственный за развитие заболевания, локализуется в регионе длинного плеча 18-й хромосомы (18q21).
При II типе ПСВХ преимущественно нарушается экскреция через канальцевую мембрану гепатоцита хенодезоксихолевой кислоты из-за отсутствия на ее поверхности П-гликопротеина. Патогенез изменений аналогичен изменениям при I типе ПСВХ. Лабораторными особенностями также являются низкая активность ГГТП и низкий уровень холестерина сыворотки крови, повышение активности ЩФ. Так как происходит нарушение экскреции только одной первичной желчной кислоты, течение данного типа менее тяжелое в сравнении с I типом.
ПСВХ II типа описан в изолированных популяциях на Среднем Востоке, в Гренландии и Швеции. Ген, ответственный за синтез П-гликопротеина, локализуется во 2-й хромосоме (2q24). Молекулярная структура гена похожа на структуру гена, ответственного за развитие I типа ПСВХ.
В основе III типа ПСВХ лежит нарушение экскреции фосфолипидов (в первую очередь фосфатидилхолина) через канальцевую мембрану гепатоцита, которое связано с отсутствием на ее поверхности MDR-3-П-гликопротеина.
В норме фосфолипиды соединяются с желчными кислотами в мицеллы, предотвращая токсическое действие свободных желчных кислот на эпителиальные клетки внутрипеченочных желчных протоков. При III типе ПСВХ фосфолипиды не поступают во внутрипеченочную желчную систему. Это приводит к разрушению протоков под действием желчных кислот. Деструкция канальцев приводит к развитию синдрома холестаза, который проявляется повышением активности ГГТП и уровня холестерина сыворотки крови. Это является основным отличием от I и II типов ПСВХ. Ген, ответственный за развитие ПСВХ III типа, локализуется в 7-й хромосоме (7q21.1).
Обязательными клиническими симптомами ПСВХ являются желтуха и зуд. Вначале холестаз (желтуха) самостоятельно разрешается через несколько недель или месяцев. Затем интенсивность желтухи постепенно нарастает, присоединяется мучительный зуд. Печень и селезенка существенно увеличиваются. Кроме того, наблюдается стеаторея.
Желтуха имеет перемежающийся характер и связана с повторяющимися эпизодами холестаза. Рецидивы холестаза могут провоцировать респираторные инфекции верхних дыхательных путей. Желтуха сопровождается потемнением мочи и светлым стулом. У пациентов с болезнью Байлера имеются нарушения роста, рахит, явления геморрагического диатеза.
При гистологическом исследовании на раннем этапе заболевания печень сохраняет нормальную архитектонику, далее наступает перегруппировка гепатоцитов, образующих тубулярные структуры, псевдоканальцы. Иногда обнаруживается гиперплазия желчных протоков или их редукция. Холестаз выражен и в желчных канальцах, и в гепатоцитах. Прогрессирование болезни приводит к формированию классической картины билиарного цирроза.
Прогноз у данного заболевания неблагоприятный. Большинство пациентов умирает в возрасте от 2 до 15 лет от осложнений цирроза печени. Однако описаны отдельные больные с продолжительностью жизни до 25 лет. Возможно развитие на фоне цирроза рака печени.
Лечение болезни Байлера аналогично лечению билиарного цирроза. Больным обычно назначают симптоматическое лечение, предусматривающее профилактику и коррекцию осложнений синдрома холестаза. Назначаются витамины А, D, Е, К для компенсации эндогенного дефицита. В комплексе с витамином D применяют глюконат кальция. Для уменьшения кожного зуда назначают: холестирамин (4–16 г/сут), фенобарбитал (5 мг/кг/сут), рифампицин (8–10 мг/кг/сут). Также для лечения используют мочегонные препараты (верошпирон, фуросемид) и желчегонные средства.
Одним из способов лечения является трансплантация печени. По данным ряда авторов, катамнез больных в первые 5–10 лет после пересадки печени позволяет говорить об эффективности этого метода и отсутствии рецидивов заболевания.
На основании вышеизложенного можно сказать, что болезнь Байлера как редкое наследственное заболевание вызывает значительные диагностические трудности. Отставание ребенка в развитии, кожный зуд часто могут быть ведущими, а иногда первыми клиническими проявлениями. Волнообразное течение холестаза, при котором отмечаются низкая активность ГГТП и низкий уровень холестерина вместе с повышением показателей других маркеров холестаза, является основным диагностическим критерием заболевания.
Благодаря своевременно начатой симптоматической терапии значительно улучшается качество жизни ребенка и увеличивается ее продолжительность. Основная причина смерти больных, не получающих лечение, — желудочно-кишечное кровотечение, вызванное дефицитом витамина К. Однако его можно предотвратить назначением препаратов витамина К.
Единственным радикальным методом лечения болезни Байлера является ортотопическая трансплантация печени.
/59/1.png)