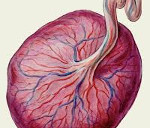
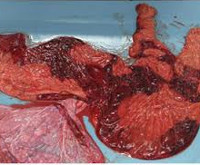
серозный децидуит что это гистология
ЗАМЕРШАЯ БЕРЕМЕННОСТЬ: ЭТИОЛОГИЯ И ПАТОМОРФОЛОГИЯ
Среди потерь I триместра беременности крайне актуальной является неразвивающаяся беременность. Согласно российской статистике, замершая беременность составляет 45-88% от числа самопроизвольных абортов, 11% первых беременностей заканчиваются хирургическим абортом, а частота невынашивания беременности достигает 20% (Милованов А.П., 2011). В клинической практике больше половины подобных ранних потерь остаются не распознанными в отношении этиологии и патогенеза.
Цель:анализ современных методических подходов для патоморфологической диагностики причин раннего невынашивания беременности по соскобам эндометрия.
Задачи:1) анализ литературных источников;2) анализ диагностических методов;3) разбор клинического наблюдения.
Содержание:
Замершая беременность отличается от спонтанного аборта отсутствием сократительной деятельности матки и длительным нахождением в ее полости фрагментов хориального мешка и погибшего эмбриона. Это требует их хирургической эвакуации и последующего патоморфологического исследования. В каждом конкретном случае вызвать подобный исход беременности могут различные причины или комплекс этиологических факторов. К основным причинам можно отнести такие, как эндокринные нарушения в организме матери, хромосомные аномалии и «сбои» в генетической программе, воспалительные агенты (бактериальные и вирусные), нарушения гемостаза и иммунные расстройства.
Исследование соскобов эндометрия согласно диагностическому алгоритму позволяет диагностировать эндокринопатии в виде нарушения лютеиновой фазы менструального цикла (МЦ), выявить морфологические признаки, указывающие на возможность аберрантной фолликулярной фазы МЦ, диагностировать острый экссудативный децидуит и проявления хронического эндометрита [1,2]. В соскобах эндометрия проводится оценка состояния ворсин хориона, васкулогенеза, вневорсинчатого и инвазивного цитотрофобласта, фибриноидной трансформации стенки артерий маточно-плацентарной области, состояния стромы, сосудистого русла париетального эндометрия и базальной децидуальной пластинки.
Клиническое наблюдение:
У пациентки К. возраста 33 года, поступившей в стационар с клиническим диагнозом неразвивающаяся беременность в сроке 8-9 недель, при исследовании соскоба эндометрия выявили морфологические признаки незавершенной децидуализации стромы, ретардацию желез спонгиозного слоя эндометрия, лейкоцитарные инфильтраты, часто массивные, с формированием картины «затёков». Морфологическое строение ворсин хориона, инвазия цитотрофобласта в маточно-плацентарной области, фибриноидная трансформация стенки спиральных артерий соответствовали сроку гестации. В связи с этим в качестве ведущих причин раннего невынашивания у пациентки диагностировали: Острый экссудативный децидуит. Эндокринопатия в виде недостаточности лютеиновой фазы и ретардации желез эндометрия.
Таким образом, многоэтапное последовательное исследование соскобов эндометрия согласно диагностическому алгоритму позволяет определить вероятные причины патологии беременности и ориентировать клиницистов на выбор диагностических подходов и предгравидарную подготовку женщины к последующей беременности.
Литература:
Волкова Л.В. Полякова А.А. Раннее невынашивание беременности (этиопатогенез и патоморфологическая диагностика).- Курск: КГМУ.- 2009.- 30 с.
Исследование плода и плаценты при врожденных пороках развития, несовместимых с жизнью
Целью исследования было выявить структуру врожденных пороков развития плода, несовместимых с жизнью, приведших к индуцированному прерыванию беременности по медицинским показаниям, структурные изменения в последе при наличии пороков развития. Проведено ран
The aim of the study was to reveal the structure of fatal congenital malformations of the fetus, leading to the induced interruption of pregnancy due to medical indications, structural changes in the afterbirth in the presence of malformations. The randomized comparative study was conducted in 2 stages (retrospective and prospective).
Врожденные пороки развития (ВПР) плода считают важнейшей медицинской и социальной проблемой, поскольку они занимают ведущее место в структуре причин перинатальной, неонатальной и младенческой заболеваемости, смертности и инвалидности [1]. Также актуальной является проблема прерывания беременности в поздние сроки по медицинским показаниям со стороны плода, так как на ее долю приходится около 20% от общего числа абортов, а количество осложнений возрастает в 3–4 раза при прерывании беременности во втором триместре по сравнению с первым [2]. Согласно данным ВОЗ, ВПР отмечают у 4–6% детей. В России ежегодно более 50 000 детей рождаются с ВПР, число пациентов с ВПР превышает 1,5 млн человек. При наличии у плода ВПР, несовместимых с жизнью, или сочетанных пороков с неблагоприятным прогнозом для жизни и здоровья, при ВПР, приводящих к стойкой потере функций вследствие тяжести и объема поражения при отсутствии методов эффективного лечения, женщине предоставляется информация о возможности искусственного прерывания беременности по медицинским показаниям [3]. При отказе женщины прервать беременность из-за наличия ВПР, несовместимых с жизнью, или иных сочетанных пороков беременность ведется в соответствии с разделом I настоящего порядка. Высокие затраты на лечение, уход и реабилитацию детей с ВПР обусловливают необходимость разработки и совершенствования не только методов контроля, диагностики и профилактики ВПР у детей, но и изучения патоморфологии плода и последа [4].
В последние десятилетия интенсивно изучаются многочисленные антенатальные факторы, приводящие к повреждению нервной системы плода — внутриутробные инфекции, генетические дефекты, проблемы резус-конфликта, воздействие на плод лекарственных веществ и целый ряд других факторов. Нередко причинами врожденных пороков развития плода и последа являются инфекционные причины: инфекционные фетопатии формируются с 16-й недели, когда происходит генерализация инфекции у плода, вследствие чего могут возникать такие пороки развития, как фиброэластоз эндокарда, поликистоз легких, микро- и гидроцефалия (ранние фетопатии) [5].
Большое количество работ посвящено методам прерывания беременности в позднем сроке по медицинским показаниям со стороны плода — врожденным порокам развития плода, реабилитации женщин после элиминации плода [6–11]. В то же время недостаточно описаны результаты патологоанатомического исследования плода и плаценты при врожденных пороках, несовместимых с жизнью. Наше исследование посвящено прерыванию беременности во втором триместре по медицинским показаниям со стороны плода. Данная публикация посвящена вопросам патологоанатомического исследования плода и последа.
Целью данного исследования было выявить структуру врожденных пороков развития плода, несовместимых с жизнью, приведших к прерыванию беременности по медицинским показаниям, их сочетания со структурными изменениями в последе.
Материалы и методы исследования
Исследование одобрено локальным этическим комитетом ФГБОУ ВО ОмГМУ МЗ РФ, Омск (№ 63 от 09.10.2014 г.) и выполнено на базе БУЗОО ГКПЦ, Омск. Прерывание беременности во II триместре по медицинским показаниям проводилось согласно Распоряжению Министерства здравоохранения Омской области № 308-р от 17.09.2013 г. в указанном учреждении, где был создан центр по прерыванию беременности второго триместра и женщине выдавалось заключение перинатального консилиума специалистами (акушер-гинеколог, перинатолог, неонатолог и др.). Гистологическое исследование элиминированных плодов и плацент проведено согласно рекомендациям А. П. Милованова и осуществлялось в патологоанатомическом отделении БУЗОО ОДКБ, Омск.
Основным показанием к прерыванию беременности на всех этапах являлись ВПР плода, несовместимые с жизнью. При наличии у плода ВПР, несовместимого с жизнью, или наличии сочетанных пороков с неблагоприятным прогнозом для жизни и здоровья, при ВПР, приводящих к стойкой потере функций вследствие тяжести и объема поражения при отсутствии методов эффективного лечения, предоставлялась информация о возможности искусственного прерывания беременности по медицинским показаниям. Искусственное прерывание беременности проводилось при наличии информированного добровольного согласия женщины.
На первом ретроспективном этапе (до внедрения в практику регламентирующих документов [3, 12]) проведен анализ гистологического исследования плацент после прерывания беременности у 150 женщин, которые в зависимости от метода прерывания были разделены на две группы: группу А составили 75 женщин, которым проведено прерывание беременности в поздние сроки методом трансвагинального трансцервикального амниоцентеза: амниоинфузия 10% раствором хлорида натрия. Группу Б составили 75 женщин, которым с целью прерывания беременности в поздние сроки для возбуждения и стимуляции родовой деятельности использовали гель динопростон для эндоцервикального введения. Более подробно методы прерывания беременности, их эффективность и исходы описаны в наших предыдущих публикациях [13–15]. Критериями включения пациенток в группы А и Б были следующие: срок беременности 18–21 неделя 6 дней, возможность родоразрешения через естественные родовые пути и отсутствие противопоказаний к применению гипертонического раствора хлорида натрия (10% NaCl) и простагландинов. Пациентки обеих групп были идентичны по возрасту, особенностям менструальной функции, наличию экстрагенитальных и гинекологических заболеваний, паритету. Все пациентки были консультированы в медико-генетическом отделе.
На втором этапе под проспективным наблюдением было 195 беременных, разделенных на две группы. Основную группу составили 98 женщин, которым проведено прерывание беременности в поздние сроки следующим комбинированным методом: мифепристон перорально и введение ламинарий в цервикальный канал. В группу сравнения были включены 97 женщин, прерывание беременности которым проводилось по схеме ВОЗ. Критерии включения в группы: пациентки, которым дано заключение консилиума врачей для прерывания беременности по медицинским показаниям со стороны плода в сроки гестации 18–21 неделя согласно приказам МЗСР РФ № 736 от 03 декабря 2007 г. [16] и № 572н от 01.11.2012 [3].
На проспективном этапе исследования материалом для изучения послужили результаты патоморфологического исследования плодов (аутопсийного материала) и последов (макроскопическое и микроскопическое). В работе использованы антропометрические, органометрические, гистологические методы. С целью уточнения гестационного возраста плода и дополнительных скрытых аномалий развития в соответствии с имеющимися стандартами использовали антропометрические и органометрические исследования [17–20]. Гистологические исследования органов плода, плодных оболочек, пуповины и плаценты проводили на парафиновых срезах, изготовленных по общепринятой методике и окрашенных гематоксилином и эозином, а также избирательно пикрофуксином по методу Ван Гизона. Для гистологического исследования предварительно материал фиксировали в 10% нейтральном формалине, после промывки и стандартной проводки заливали в парафин. Парафиновые срезы толщиной 3–5 мкм окрашивали гематоксилином и эозином. Элементы соединительной ткани определяли пикрофуксином по методу Ван-Гизона. Методы гистологического исследования выполнялись по прописям, изложенным в классических руководствах по гистологической технике и гистохимии. Обследование элиминированных плодов включало тщательную визуальную оценку имеющихся стигм эмбриогенеза, врожденных пороков. Для гистологического исследования отбирали фрагменты органов с целью изучения их гистоархитектоники [17].
Использовался способ статистической обработки результатов по критерию t таблиц Стьюдента, позволяющий вычислить степень достоверности различий при небольшом числе наблюдений. Перед каждым вычислением достоверности различий между количественными признаками, а также для выбора критерия корреляции оценивали нормальность их распределения по критерию Колмогорова–Смирнова. В случае ненормального распределения количественных признаков или неравенстве дисперсий применялся U-критерий Манна–Уитни. Для факторов, имеющих биноминальное распределение, дополнительно были рассчитаны 95% доверительные интервалы.
Результаты исследования
Пациентки всех групп были идентичны по возрасту, особенностям менструальной функции, наличию экстрагенитальных и гинекологических заболеваний, паритету. Эффективность прерывания беременности в поздние сроки методом амниоцентеза составила 93,3%, при применении простагландинов — 92%, на проспективном этапе не имела достоверных различий и составила 99,0% в основной группе и 96,9% — в группе сравнения.
В структуре выявленных ВПР плода на первом месте в основной группе были врожденные пороки сердечно-сосудистой системы (34 наблюдения — 34,7%), на втором — пороки центральной нервной системы (ЦНС) (29 наблюдений — 29,6%), на третьем — множественные пороки развития (13–13,3%), на четвертом — пороки мочевыводящей системы (9–9,2%) (табл. 1). В остальных наблюдениях выявлены ВПР опорно-двигательного аппарата (7–7,1%) и другие (6–6,1%): кожи и мышц, желудочно-кишечного тракта, легких, шеи и лица, прочие. В группе сравнения на первом месте также были врожденные пороки сердечно-сосудистой системы (32 наблюдения — 33,0%), на втором — пороки ЦНС (30 наблюдений — 30,9%), на третьем — множественные пороки развития (15–15,5%), на четвертом — пороки мочевыводящей системы (10–10,3%). В остальных наблюдениях выявлены ВПР опорно-двигательного аппарата (8–8,2%) и другие (2–2,1%): кожи и мышц, желудочно-кишечного тракта, легких, шеи и лица, прочие.
Среди пороков сердечно-сосудистой системы в обеих группах чаще наблюдались транспозиция магистральных сосудов, дефекты межжелудочковой и межпредсердной перегородок, общий артериовенозный канал, тетрада Фалло, сочетанные пороки сердца, аномалии Эбштейна, гипоплазия левого отдела, прочие врожденные пороки сердечно-сосудистой системы.
В структуре пороков ЦНС чаще наблюдалась гидроцефалия, анэнцефалия, синдром Арнольда–Киари и Денди–Уокера, микроцефалия, агенезия мозолистого тела, акрания, spina bifida (спинномозговая грыжа). Гидроцефалия — заболевание, характеризующееся избыточным накоплением цереброспинальной жидкости в желудочках и подоболочечных пространствах головного мозга, сопровождающееся их расширением и атрофией мозгового вещества.
В ходе ретроспективной оценки исследования последов в группе А в подавляющем большинстве наблюдений (78,7%) определялись серозно-гнойный и гнойно-некротический децидуит и лишь в небольшом проценте случаев (21,3%) наблюдался серозный децидуит. Также в этой группе отмечалось наличие дисциркуляторных нарушений (выраженный отек стромы ворсин, тромбоз межворсинчатого пространства, ретроплацентарные гематомы). В группе Б серозный париетальный децидуит определялся в большинстве случаев (54,7%), воспалительные изменения не определялись в 38,7% наблюдений, серозно-гнойный париетальный децидуит обнаружен в 6,6% случаев.
На ретроспективном этапе при исследовании последа в большей степени были обнаружены патологическое строение и пороки развития пуповины, чем в плаценте. Так, на первом месте среди признаков патологического строения пуповины была тощая пуповина: 19 наблюдений в основной группе (19,4%) и 21 (21,6%) в группе сравнения (табл. 2). На втором месте определялись ложные узлы пуповины: 16 (16,3%) и 17 (17,5%) соответственно исследуемым группам, на третьем месте — истинные узлы пуповины: 14 (14,2%) и 15 (15,5%). Нередко в структуре патологических вариантов строения пуповины было оболочечное прикрепление пуповины: 12 (12,2%) и 9 (9,3%) соответственно. Реже были выявлены гипо- и гиперизвитая пуповина: 8 (8,2%) и 7 (7,2%) соответственно исследуемым группам; единственная артерия пуповины: 6 (6,1%) и 4 (4,1%); гематома пуповины: 1 (1,0%) в основной группе и 2 (2,1%) в группе сравнения. Всего при исследовании нарушения строения пуповины были выявлены в 76 случаях основной группы и в 75 — группы сравнения, в целом в исследовании — в 77,4% наблюдениях.
При гистологическом исследовании плаценты отмечалась относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения (23 наблюдения — 23,5% в основной группе и 29–30,0% в группе сравнения). Серозный париетальный децидуит определялся в 17,3% наблюдений основной группы и 16,5% группы сравнения. Такие скудные изменения в плаценте, выявленные при исследовании, свидетельствуют о том, что ВПР плода, несовместимые с жизнью, чаще сочетаются с патологией строения пуповины, чем с нарушениями строения и пороками развития плаценты. Также относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения указывают на то, что прерывание беременности проводилось современным медикаментозным способом, который имитирует спонтанную сократительную деятельность матки и не вызывает грубых изменений в плаценте.
Таким образом, в структуре выявленных ВПР плода, несовместимых с жизнью, в исследуемых группах на первом месте были врожденные пороки сердечно-сосудистой системы, на втором — пороки ЦНС, на третьем — множественные пороки развития, на четвертом — пороки мочевыводящей системы. В остальных наблюдениях выявлены ВПР опорно-двигательного аппарата и другие: желудочно-кишечного тракта, дыхательной системы, шеи и лица, прочие.
При гистологическом исследовании плаценты ретроспективного этапа (до внедрения в акушерскую практику современных методов производства позднего индуцированного аборта) при проведении амниоинфузии гипертоническим раствором в подавляющем большинстве определялись серозно-гнойный и гнойно-некротический мембранит, при применении динопростона чаще наблюдался серозный париетальный децидуит. После внедрения в работу акушерско-гинекологической службы регламентирующего Приказа 572н при гистологическом исследовании плаценты у пациенток второго этапа обеих групп отмечалась относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения.
При исследовании последа чаще встречались пороки развития пуповины, чем плаценты. На первом месте среди признаков патологического строения пуповины была тощая пуповина, на втором месте — ложные узлы пуповины, на третьем — истинные узлы. Реже определялось оболочечное прикрепление пуповины. Значительно реже были выявлены гипо- и гиперизвитая пуповина, единственная пупочная артерия; гематома пуповины. При гистологическом исследовании плаценты отмечалась относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения. Скудные изменения в плаценте (в сравнении с изменениями в пуповине), выявленные при исследовании, свидетельствуют о том, что врожденные пороки развития плода, несовместимые с жизнью, чаще сочетаются с патологией строения пуповины, чем с плацентарными пороками. Также относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения указывают на то, что прерывание беременности проводилось современным медикаментозным способом, который имитирует спонтанную сократительную деятельность матки и не вызывает грубых изменений в плаценте.
Литература
* ФГБОУ ВО ОмГМУ МЗ РФ, Омск
** БУЗОО ОДКБ, Омск
Плацентит
Плацентит – это воспаление плаценты, которое возникает под действием неинфекционных и инфекционных факторов. Патология плаценты может проявиться на любом сроке, симптомы зависят от выраженности воспаления. Плацентит приводит к дисфункции фето-плацентарного комплекса, его исходом становятся плацентарная недостаточность, задержка развития плода, внутриутробное инфицирование. Значительно возрастает риск преждевременных родов и гибели новорожденного. Для диагностики используется УЗИ, которое позволяет заметить нарушение структуры плаценты, плацентарного кровотока. Лечение плацентита проводится антибиотиками, а также препаратами, улучшающими функцию плаценты.
МКБ-10
Общие сведения
Плацентит – инфекционно-воспалительное заболевание, чаще всего является результатом восходящего распространения инфекции. У 98% женщин приводит к неблагоприятному течению беременности и развитию осложнений. Угроза прерывания, ассоциированная с плацентитом, отмечается у 76% беременных. В большинстве случаев плод страдает от внутриутробной гипоксии, 9% детей рождается с признаками гипотрофии. Инфекция вызывает несвоевременное излитие вод у 38% беременных, у трети женщин это приводит к аномалиям родовой деятельности. Риск внутриутробного инфицирования существует у 6% детей, которые развиваются в условиях плацентита.
Причины плацентита
У всех беременных наблюдается физиологическая иммуносупрессия, вызванная повышением выработки прогестерона. При наличии очагов хронической или острой инфекции она может распространиться на плаценту. Чаще всего инфицирование происходит восходящим путем из влагалища через шейку матки. К плацентиту приводят различные виды микроорганизмов и действие неинфекционных факторов:
Патогенез
Воспаление может возникать в различных слоях плаценты. Воспалительная реакция сопровождается миграцией лейкоцитов и инфильтрацией тканей, нарушением кровообращения, которое вызвано микротромбозами межворсинчатого пространства, микроинфарктами, ишемией концевых ворсин. Также определяется полнокровие и отек стромы. В зависимости от вовлеченного слоя различают следующие формы плацентита:
Плацентит не всегда приводит к инфицированию плода, но может сказаться на состоянии эндометрия после родов и ухудшить прогнозы для следующих беременностей. Одновременно внутриутробная инфекция у ребенка может протекать без признаков плацентита. Такой вариант течения наблюдается при некоторых вирусных инфекциях. Для каждого типа возбудителя характерна своя гистологическая картина.
Симптомы плацентита
Патология может быть следствием острой либо хронической инфекции. У нее нет специфических проявлений, при латентном течении симптомы могут вовсе отсутствовать. Учитывая восходящий путь инфицирования, беременную могут беспокоить вагинальные выделения. Они могут быть белыми, с желтоватым или сероватым оттенком, с неприятным запахом или без него. При остром течении вагинита из-за близкого расположения мочеиспускательного канала появляются дизурические расстройства. Женщина жалуется на неприятные ощущения во время мочеиспускания, походы в туалет становятся чаще. Выделения сопровождаются зудом и жжением, покраснением половых губ.
Боль внизу живота является следствием воспаления. При плацентите и возникновении угрозы преждевременных родов боли появляются в нижней части матки. Они тянущие, ноющие, могут отдавать в промежность или поясницу. На появление угрозы прерывания беременности указывает тонус матки, схваткообразная боль. Плод реагирует на недостаток кислорода увеличением двигательной активности или снижением количества шевелений. Настороженность должны вызывать подтекание околоплодных вод или их дородовое излитие. Это повод срочно обратиться за медицинской помощью в гинекологическое отделение на сроке до 22 недель, а на более позднем сроке – в роддом.
Осложнения
Плацентит вызывает осложнения беременности, некоторых из них становятся показанием для досрочного родоразрешения. У каждой 5-ой беременной отмечается преждевременное излитие околоплодных вод. Для беременных с плацентитом характерна плацентарная недостаточность. При декомпенсации состояния у плода развивается острая гипоксия, которая может привести к антенатальной гибели или тяжелым повреждениям центральной нервной системы ребенка. Чем раньше возник плацентит, тем выше вероятность тяжелых осложнений. Течение беременности может осложниться гестозом, внутриутробной инфекцией ребенка, преждевременными родами.
Диагностика
При нарушении самочувствия, боли в животе, появлении выделений из половых путей беременной необходимо обратиться к врачу акушеру-гинекологу, у которого она состоит на учете. Объем диагностических процедур подбирается индивидуально, опираясь на клинические проявления, данные анамнеза и предыдущих исследований. Базовая диагностика плацентита проводится неинвазивными инструментальными методами:
Подтверждается плацентит после родов. Плодное место с оболочками и пуповиной отправляется на гистологическое исследование. По его результатам можно предположить тип инфекции, если обследование не проводилось во время беременности. Для нормального восстановления в послеродовом периоде и профилактики эндометрита назначается лечение.
Лечение плацентита
Женщина с плацентитом госпитализируется для проведения качественного обследования, лечения и выбора акушерской тактики. Консервативная терапия оправдана при недоношенной беременности и признаках незрелого плода, но при сохранении его нормальной гемодинамики. При некупирующейся острой гипоксии плода и в других тяжелых случаях показано досрочное родоразрешение путем кесарева сечения. При плацентите проводится:
Прогноз и профилактика
При плацентите прогноз зависит от срока развития воспаления и способностей организма компенсировать сосудистые нарушения. Для плода плацентраная недостаточность увеличивает риск задержки развития, внутриутробного инфицирования и гипоксии, которая может завершиться внутриутробной гибелью. Профилактика плацентита заключается в прегравидарной подготовке, своевременном лечении хронических воспалительных процессов половых органов. Мазки на чистоту влагалища, которые берутся при постановке на учет, позволяют вовремя заметить воспалительные изменения, провести дополнительное обследование и лечение.








_575.gif)