сера архипская что такое
Сера архипская что такое
Чистая желтая сера
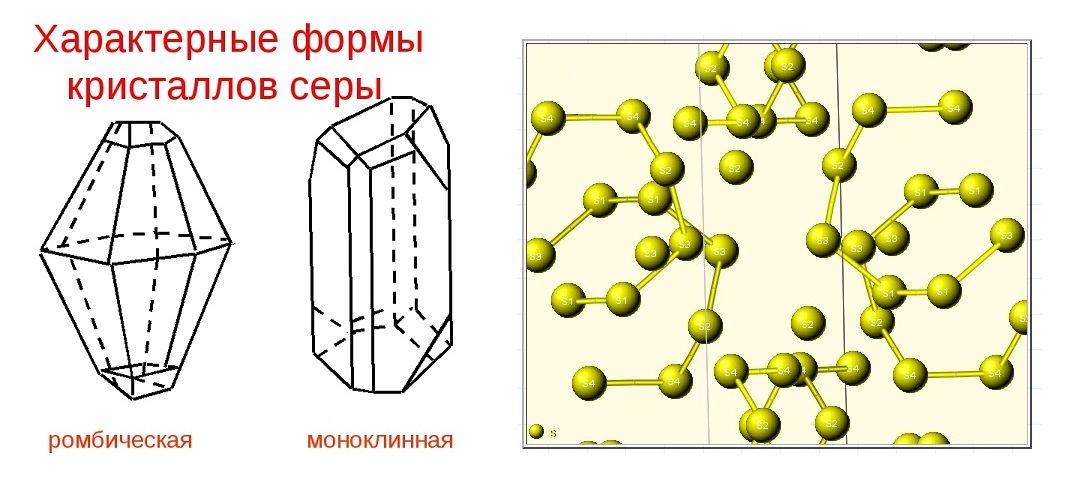
Сера — минерал из класса самородных элементов. Сера представляет собой пример хорошо выраженного энантиоморфного полиморфизма. В природе образует 2 полиморфные модификации: a-сера ромбическая и b-сера моноклинная. При атмосферном давлении и температуре 95,6°С a-сера переходит в b-серу. Сера жизненно необходима для роста растений и животных, она входит в состав живых организмов и продуктов их разложения, ее много, например, в яйцах, капусте, хрене, чесноке, горчице, луке, волосах, шерсти и т.д. Она присутствует также в углях и нефти.
СТРУКТУРА
Кристаллическая структура и две сингонии серы
Самородная сера обычно представлена a-серой, которая кристаллизуется в ромбической сингонии, ромбо-дипирамидальный вид симметрии. Кристаллическая сера имеет две модификации; одну из них, ромбическую, получают из раствора серы в сероуглероде (CS2) испарением растворителя при комнатной температуре. При этом образуются ромбовидные просвечивающие кристаллы светложелтого цвета, легко растворимые в CS2. Эта модификация устойчива до 96° С, при более высокой температуре стабильна моноклинная форма. При естественном охлаждении расплавленной серы в цилиндрических тиглях вырастают крупные кристаллы ромбической модификации с искаженной формой (октаэдры, у которых частично «срезаны» углы или грани). Такой материал в промышленности называется комовая сера. Моноклинная модификация серы представляет собой длинные прозрачные темножелтые игольчатые кристаллы, также растворимые в CS2. При охлаждении моноклинной серы ниже 96° С образуется более стабильная желтая ромбическая сера.
СВОЙСТВА
МОРФОЛОГИЯ
Образует усечённо-дипирамидальные, реже дипирамидальные, пинакоидальные или толстопризматические кристаллы, а также плотные скрытокристаллические, сливные, зернистые, реже тонковолокнистые агрегаты. Главные формы на кристаллах: дипирамиды (111) и (113), призмы (011) и (101), пинакоид (001). Также сростки и друзы кристаллов, скелетные кристаллы, псевдосталактиты, порошковатые и землистые массы, налёты и примазки. Для кристаллов характерны множественные параллельные срастания.
ПРОИСХОЖДЕНИЕ
Сера образуется при вулканических извержениях, при выветривании сульфидов, при разложении гипсоносных осадочных толщ, а также в связи с деятельностью бактерий. Главные типы месторождений самородной серы — вулканогенные и экзогенные (хемогенно-осадочные). Экзогенные месторождения преобладают; они связаны с гипсо-ангидритами, которые под воздействием выделений углеводородов и сероводорода восстанавливаются и замещаются серно-кальцитовыми рудами. Такой инфильтрационно-метасоматический генезис имеют все крупнейшие месторождения. Самородная сера часто образуется (кроме крупных cкоплений) в результате окисления H2S. Геохимические процессы её образования существенно активизируются микроорганизмами (сульфатредуцирующими и тионовыми бактериями). Сопутствующие минералы — кальцит, арагонит, гипс, ангидрит, целестин, иногда битумы. Среди вулканогенных месторождений самородной серы главное значение имеют гидротермально-метасоматические (например, в Японии), образованные сероносными кварцитами и опалитами, и вулканогенно-осадочные сероносные илы кратерных озёр. Образуется также при фумарольной деятельности. Образуясь в условиях земной поверхности, самородная сера является всё же не очень устойчивой и, постепенно окисляясь, даёт начало сульфатам, гл. образом гипсу.
Используется в производстве серной кислоты (около 50% добываемого количества). В 1890 г. Герман Фраш предложил плавить серу под землёй и извлекать на поверхность через скважины, и в настоящее время месторождения серы разрабатывают главным образом путём выплавки самородной серы из пластов под землёй непосредственно в местах её залегания. Сера также в больших количествах содержится в природном газе (в виде сероводорода и сернистого ангидрида), при добыче газа она откладывается на стенках труб, выводя их из строя, поэтому её улавливают из газа как можно быстрее после добычи.
ПРИМЕНЕНИЕ
Сера входит в состав спичечной головки
Примерно половина производимой серы используется в производстве серной кислоты. Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.
Минерал сера: описание, свойства, применение и фото
Сера является элементом периодической системы Д. И. Менделеева, ее атомный номер – шестнадцать. Обладает неметаллическими свойствами. Обозначается латинской буквой S. Название, предположительно, имеет индоевропейский корень – «гореть».
Исторический ракурс
Когда была открыта сера и начата ее добыча, не выяснено. Известно лишь то, что о ней древние люди знали задолго до нашей эры. Ранние жрецы применяли ее при своих культовых обрядах, включали в состав окуривающих смесей. Минерал серу относили к продукту, который производили боги, в основном обитающие в подземном мире.

С давних пор, о чем свидетельствуют исторические документы, она использовалась как составляющий элемент горючих смесей, которые применялись в военных целях. Гомер также не обошел своим вниманием минерал серу. В одном из своих произведений он описал «испарения», которые оказывали пагубное воздействие на человека при горении.
Историки предполагают, что сера была составляющим элементом в так называемом «греческом огне», который наводил страх на врагов.
В средние века она была одним из трех главных элементов у алхимиков. Они активно применяли минерал самородную серу в своих изысканиях. Зачастую это приводило к тому, что опыты с ней приравнивались колдовству, а это в свою очередь приводило к гонениям со стороны инквизиции древних химиков и их последователей. Именно с тех времен, со средних веков и эпохи Возрождения, запах горящей серы, их газы, стали ассоциировать с деяниями нечистой силы и дьявольскими проявлениями.
Свойства

Описания минерала серы разнообразны. Она имеет оттенки светло-желтые, соломенные, медовые, зеленоватые. В сере, которая имеет в своей структуре органические вещества, наличествует бурая, серая или черная окраска. На фото минерал сера в твердом, чистом, кристаллическом виде всегда притягивает взгляд и легко узнаваем.
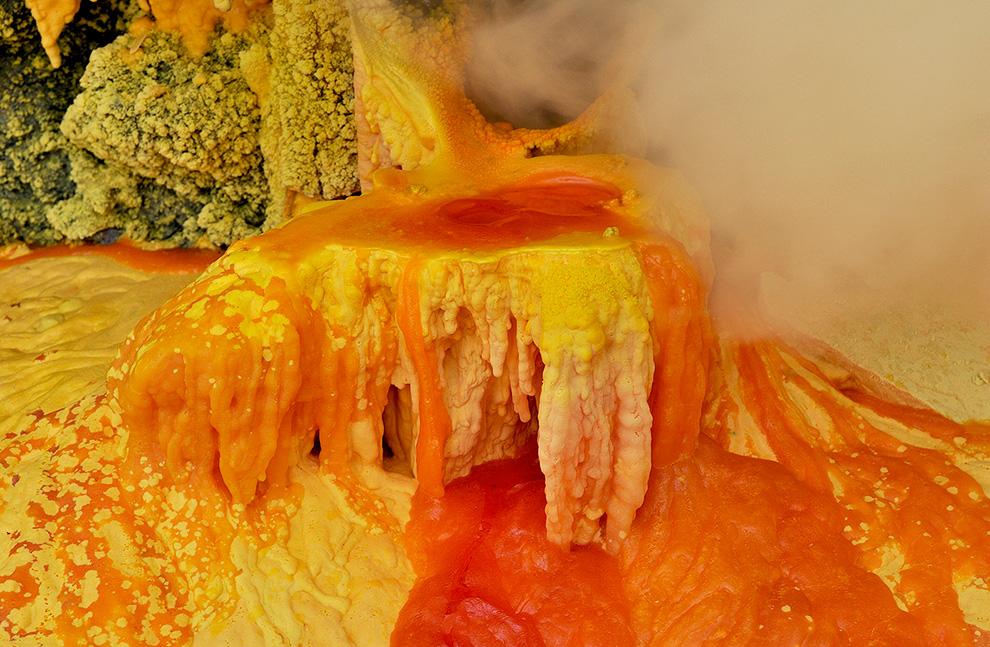
Вулканическая сера ярко-желтая, зеленоватая, оранжевая. В природе можно встретить ее в виде различных масс, плотных, землистых, порошковых. Встречаются в природе и кристаллические наросшие серные кристаллы, но достаточно редко.
Сера в природе
Природная сера в чистом состоянии встречается редко. Но в земной коре ее запасы очень значительны. В основном это руды, где в большом количестве присутствует серные прослойки.
До настоящего времени наука не определилась с причиной возникновения месторождений серы. Некоторые версии является взаимоисключающими. С учетом того, что сера проявляет высокую химическую активность, предполагается, что в процессе формирования поверхности земной коры она многократно связывалась и выделялась. Как шли эти реакции, доподлинно не установлено.
По одной из версий предполагается, что сера является следствием вымывания сульфатов, которые стали продуктами жизнедеятельности отдельных бактерий. Последние используют соединения минерала как пищу.
Исследователи рассматривают различные версии о процессах замещения серы в земной коре, которые приводят к ее выделению и накоплению. Но однозначно понять природу возникновения пока не получается.
Физические и химические свойства серы
Первые научные исследования были произведены лишь в XVIII веке. Тщательное изучение свойств минерала серы осуществил французский ученый Антуан Лавуазье. Так, он установил, что она кристаллизуется из расплавов, первоначально принимая игольчатые виды. Однако эта форма не стойкая. При уменьшении температуры сера перекристаллизуется, образуя объемные полупрозрачные образования лимонно-желтого или золотистого оттенка.
Месторождения, добыча серы
Основным источником добычи минерала серы являются месторождения. По расчетам исследователей-геологов следует, что ее мировые запасы насчитывают около 1,4 млрд тонн.
Древние люди, а также рудокопы Средневековья, добывали серу путем закапывания на глубину большой глиняной емкости. На нее помещали другую, в которой имелось отверстие в днище. Верхнюю емкость наполняли породой, в которой содержалось сера. Эту конструкцию нагревали. Сера начала плавиться и стекать в нижний сосуд.
В настоящее время добыча происходит путем открытой выработки, а также с применением способов выплавки из-под земли.
Крупные месторождения серы на территории Евразии имеются в Туркмении, в Поволжье, иных местах. Значительные залежи в России обнаружены на левых берегах реки Волги, которые протянулись от Самары до Казани.
При разработке минерала серы особое внимание уделяется безопасности. Это связано с тем, что руде всегда сопутствует скопление сероводорода, который очень вреден для дыхания. Сам минерал имеет свойство возгораться и образовывать взрывчатые составы.
Если минерал залегает глубоко и объемы его значительны, используют для добычи метод Фраша.
Во второй половине XX века активно начал использоваться метод для добычи посредством использования токов высокой частоты. Их воздействие также приводит к расплавлению серы. Последующее нагнетание сжатого горячего воздуха позволяет ускорить подъем ее в жидком состоянии на поверхность.
В больших объемах сера содержится в природных газах. Для ее добычи подходит метод Клауса. Используются специальные серные ямы, в которых осуществляется дегазация. В результате получается твердый модифицированный продукт с большим серным содержанием.
Применение
Биологическая роль
Сера является важным биогенным элементом. Входит в состав значительного числа аминокислот. Составной элемент при образовании белковых структур. В бактериальном фотосинтезе минерал принимает участие в окислительно-восстановительных реакциях организма, является источником энергии. В человеческом теле на один килограмм веса приходится около двух граммов серы.
Сера в чистом виде ядовитым веществом не является, в отличие от летучих газов, к которым относится сернистый, серный ангидрид, сероводород и так далее.
Пожароопасные свойства
Сера – это пожароопасный минерал. Тонко измельченные ее фракции способны самовозгораться в присутствии влаги, при наличии контактов с окислителями, а также при создании смесей с углем, жирами, маслами. Тушат серу распыленной водой и воздушно-механической пеной.
Сера. Свойства серы. Применение серы
Описание и свойства серы
Если говорить о строении атома элемента серы, то на внешней его орбите есть электроны, валентное число которых достигает шести. Это объясняет свойство элемента быть максимально шестивалентным в большинстве объединений. В структуре природного химического элемента есть четыре изотопа, и это – 32S, 33S, 34S и 36S. Говоря о внешней электронной оболочке, атом имеет схему 3s2 3р4. Радиус атома – 0,104 нанометра.
Свойства серы в первую очередь делятся на физического типа. К нему относится то, что элемент имеет твердый кристаллический состав. Два аллотропических видоизменения – основное состояние, в котором устойчив этот элемент серы. Первое видоизменение ромбическое, имеющее лимонно-желтую окраску. Его устойчивость ниже, чем 95,6 °С. Второй – моноклинный, имеющий медово-желтую окраску. Его устойчивость колеблется от 95,6 °С и 119,3 °С.
На фото минерал сера
Во время плавки химический элемент стает движущейся жидкостью, имеющей желтый цвет. Она буреет, достигая температуры более 160 °С. А при 190 °С цвет серы превращается в темно-коричневый. После достижения отметки 190 °С наблюдается уменьшение вязкости вещества, которое все же после нагревания 300 °С стает жидкотекучим.
Другие свойства серы:
К характеристике элемента серы важно добавить и ее химические особенности. Она является активной в этом отношении. Если серу нагреть, то она может просто объединяться практически с любым химическим элементом.
На фото образец серы, добытый в Узбекистане
За исключением инертных газов. При контакте с металлами, хим. элемент образовывает сульфиды. Комнатная температура способствует тому, что элемент может вступить в реакцию с ртутью. Увеличенная температура способствует увеличению активности серы.
Рассмотрим, как поведение серы с отдельными веществами:
Месторождения и добыча
Основной источник для получения серы – ее месторождения. В целом во всем мире насчитывается 1,4 млрд т запасов этого вещества. Ее добывают как при открытом и подземном способе выработки, так и с помощью выплавки из-под земли.
Добыча серы в вулкане Кава Иджен
Если применим последний случай, то используется вода, которую перегревают и расплавляют ею серу. В бедных рудах элемент содержится примерно в 12 %. Богатых – 25% и больше. Распространенные типы месторождений:
Первый тип связан с толщами, несущими название сульфатно-карбонатных. При этом рудные тела, которые имеют мощность до нескольких десятков метров и с размером до сотни метров находятся в сульфатных породах. Также эти пластовые залежи можно найти посреди пород сульфатного и карбонатного происхождения. Второй тип характеризуется залежами серого цвета, которые приурочиваются к соляным куполам.
Последний тип связывают с вулканами, имеющими молодую и современную структуру. При этом рудный элемент имеет пластообразную, линзовидную форму. В нем сера может содержаться в размере 40 %. Этот тип месторождения распространен в Тихоокеанском вулканическом поясе.
Месторождение серы в Евразии находится в Туркмении, в Поволжье и других местах. Породы серы находят возле левых берегов Волги, которые тянутся от Самары. Ширина полосы пород достигает нескольких километров. При этом их можно найти вплоть до Казани.
Кристаллы серы могут иметь различные оттенки желтого
На фото сера в горной породе
В Техасе и Луизиане в кровлях соляных куполов находят огромное количество серы. Особо красивые Италийские кристаллы этого элемента находят Романьи и Сицилии. А на острове Вулькано находят моноклинную серу. Элемент, который был окислен пиритом, нашли на Урале в Челябинской области.
Для добычи серы хим элемента используют разные способы. Все зависит от условия его залегания. При этом, конечно же, особое внимание уделяют безопасности. Так как вместе с серной рудой скопляется сероводород, то необходимо особо серьезно подходить к любому способу добычи, ведь этот газ ядовитый для человека. Также и сера имеет свойство возгораться.
Чаще всего пользуются открытым способом. Так с помощью экскаваторов снимаются значительные части пород. Затем с помощью взрывов дробится рудная часть. Глыбы отправляются на фабрику для обогащения. Затем – на завод по плавке серы, где и получают серу из концентрата.
Серу часто перевозят морским транспортом
В случае глубокого залегания серы во многих объемах, используют метод Фраша. Сера расплавляется, находясь еще под землей. Затем, как и нефть выкачивается наружу через пробитую скважину. Такой подход основывается на том, что элемент легко плавится и имеет небольшую плотность.
Также известен способ разделения на центрифугах. Только этот способ имеет недостаток: сера получается с примесями. И тогда необходимо проводить ее дополнительную очистку. В некоторых случаях используют скважный метод. Другие возможности добычи серного элемента:
Применение серы
Большая часть добытой серы уходит, чтоб изготовить серную кислоту. А роль этого вещества очень огромная в химическом производстве. Примечательно, что для получения 1 тонны серного вещества необходимо 300 кг серы. Бенгальские огни, которые ярко светятся и имеют много красителей, также производятся с помощью серы. Бумажная промышленность – это еще одна область, куда уходит значительная часть добытого вещества.
Серная мазь используется для лечения болезней кожи
Чаще всего применение сера находит при удовлетворении производственных нужд. Вот некоторые из них:
В некоторых случаях элемент сера входит в мази, которые лечат кожные болезни.
Цена серы
По последним новостям необходимость в сере активно растет. Стоимость на российский продукт равняется 130 долларам. На канадский вариант – 145 долларов. А вот в Ближнем Востоке цены возросли до 8 долларов, что привело к стоимости в 149 долларов.
На фото крупный экземпляр минерала сера
В аптеках можно найти молоту в порошок серу по цене от 10 до 30 рублей. К тому же есть возможность купить ее оптом. Некоторые организации предлагают по невысокой цене приобрести гранулированную техническую газовую серу.
Сера. Общая характеристика, получение, химические свойства
Сера (S), Sulfur
При нормальных условиях атомы серы образуют циклические восьмиатомные молекулы с химической формулой S8.
Физические свойства серы
Сера образует более 30 твердых аллотропов, больше, чем любой другой элемент.
Сера содержит 23 известных изотопа, четыре из которых являются стабильными:
Природные минералы серы:
— колчеданы (FeS2 – железный колчедан (пирит), FeCuS2 – медный колчедан (халькопирит))
— сульфиды (ZnS – цинковая обманка, PbS – свинцовый блеск, CuS – медный блеск (халькозин)).
Сера является десятым наиболее распространенным элементом по массе во Вселенной и пятым наиболее распространенным на Земле.
Хотя иногда серу можно найти в чистом природном виде, на Земле она обычно встречается в виде сульфидных и сульфатных минералов.
Сера в изобилии в естественной форме была известна в древние времена, и ее упоминали в древней Индии, древней Греции, Китае и Египте. В Библии сера упоминается как «горящий камень».
Сегодня почти вся элементарная сера производится как побочный продукт удаления серосодержащих загрязнений из природного газа и нефти.
Элементная сера используется в спичках, инсектицидах и фунгицидах.
Какой у серы запах?
Многие соединения серы имеют душистый аромат, а запах органических газов, специфический неприятный запах у скунса, грейпфрута и чеснока происходят из-за сероорганических соединений.
Сера в Космосе
32S создается внутри массивных звезд на глубине, где температура превышает 2,5 × 109 К, в результате слияния одного ядра кремния с одним ядром гелия.
Отличительные цвета вулканической спутника Юпитера Ио приписываются различным формам расплавленной, твердой и газообразной серы.
Сера на Земле
Элементарная сера может быть найдена около горячих источников и вулканических областей во многих частях мира, особенно вдоль Тихоокеанского Огненного Кольца; такие вулканические отложения в настоящее время добываются в Индонезии, Чили и Японии.
Самородная сера синтезируется анаэробными бактериями, действующими на сульфатные минералы, такие как гипс в соляных куполах.
Сера и Геология
Самородная сера может быть получена только в результате геологических процессов.
Обычные природные соединения серы включают
Сера и ее соединения
Некоторые из основных классов серосодержащих органических соединений включают следующие:
Сероорганические соединения ответственны за некоторые неприятные запахи разлагающегося органического вещества.
Не все органические соединения серы неприятно пахнут при всех концентрациях:
Серная горчица (иприт), сильнодействующий реагент, использовалась в Первой мировой войне в качестве средства для выведения из строя.
Сера и Римская мифология
В наиболее распространенном типе промышленного «отверждения» и упрочнения натурального каучука элементарная сера нагревается с каучуком до такой степени, что химические реакции образуют дисульфидные мостики между изопреновыми звеньями полимера.
Из-за высокой температуры и серы процесс был назван вулканизацией в честь римского бога кузницы Вулкана.
Сера и древние времена
Будучи в изобилии доступным в естественном виде, сера была известна в древние времена и упоминается в Торе (Бытие).
Согласно папирусу Эберса, серная мазь использовалась в древнем Египте для лечения зернистых век.
Он упоминает ее использование для фумигации, медицины и отбеливания ткани.
К 3-му веку китайцы обнаружили, что сера может быть извлечена из пирита.
Военный трактат династии Сун в 1044 году нашей эры описывает различные формулы для китайского черного порошка, который представляет собой смесь нитрата калия (KNO3), древесный уголь и серу. Этот состав до сих пор остается компонентом черного пороха.
В 1777 году Антуан Лавуазье помог убедить научное сообщество, что сера является элементом, а не соединением.
Сера вступает в реакцию непосредственно с метаном с образованием дисульфида углерода, который используется для производства целлофана и вискозы.
Сера и Растения
Сера все чаще используется в качестве компонента удобрений.
Со временем почвенные бактерии могут превращать его в растворимые производные, которые затем могут использоваться растениями.
Это важное питательное вещество для роста растений, формирования корневых клубеньков бобовых, а также иммунитета и защитных систем.
Поскольку атмосферные поступления серы продолжают уменьшаться, дефицит ввода / вывода серы, вероятно, увеличится, если не использовать серные удобрения.
Важно! Газообразный сероводород и гидросульфидный анион чрезвычайно токсичны для млекопитающих из-за их ингибирования кислородоносности гемоглобина и некоторых цитохромов способом, аналогичным цианиду и азиду.
Сера и Лекарства
Сероорганические соединения используются в фармацевтике, красителях и агрохимикатах.
Большинство β-лактамных антибиотиков, включая пенициллины, цефалоспорины и монолактамы, содержат серу.
Сульфат магния, известный как соль Эпсома в гидратированной кристаллической форме, может использоваться в качестве слабительного средства, добавки для ванн, эксфолианта, добавки магния для растений или (в обезвоженном виде) в качестве осушителя.
Сера и Пестициды
Элементарная сера является одним из старейших фунгицидов и пестицидов.
Она обладает хорошей эффективностью против широкого спектра мучнистой росы, а также от черных пятен.
Сера и Вино
Небольшие количества добавляемого газообразного диоксида серы (или эквивалентное добавление метабисульфита калия) к ферментированному вину с образованием следов серной кислоты (образующейся при взаимодействии SO2 с водой) и ее сульфитных солей в смеси, называют «самым мощным инструментом в виноделии».
Без этой стадии консервирования обычно требуется непременное охлаждение продукта перед употреблением.
Сера и Кожа
Сера (в частности, октасерная кислота, S8) используется в фармацевтических препаратах для кожи для лечения прыщей и других состояний.
Общие побочные эффекты включают раздражение кожи в месте нанесения, в виде сухости, жжения, зуда и шелушения.
Это седьмой или восьмой самый распространенный элемент в организме человека по массе, примерно равный по содержанию калию и немного превышающий натрий и хлор.
Человеческое тело весом 70 кг (150 фунтов) содержит около 140 г серы.
Сера и Белки
У растений и животных аминокислоты цистеин и метионин содержат большую часть серы, и этот элемент присутствует во всех полипептидах, белках и ферментах, которые содержат эти аминокислоты.
Дисульфидные связи (связи S-S) между остатками цистеина в пептидных цепях очень важны для сборки и структуры белка.
Например, высокая прочность перьев и волос частично обусловлена высоким содержанием связей S-S с цистеином и серой.
Высокое содержание дисульфидных связей в волосах и перьях способствует их неперевариваемости и характерному неприятному запаху при сгорании.
Во внутриклеточной химии сера действует как носитель восстановления водорода и его электронов для клеточного восстановления окисления.
Тиоредоксины, класс малых белков, необходимых для всей известной жизни, используют соседние пары восстановленных цистеинов для работы в качестве общих белков-восстановителей с аналогичным эффектом.
У бактерий важные ферменты нитрогеназы содержат кластер Fe-Mo-S и являются катализатором, который выполняет важную функцию азотфиксации, превращая атмосферный азот в аммиак, который может использоваться микроорганизмами и растениями для производства белков, ДНК, РНК, алкалоидов. и других органических соединений азота, необходимых для жизни.
Сера и Биогеохимия
Цикл серы был первым из обнаруженных биогеохимических циклов.
Виноградский назвал эту форму метаболизма неорганическим окислением (окисление неорганических соединений).
Примитивные бактерии, которые живут вокруг глубоководных вулканических жерл, окисляют сероводород в этом пути с кислородом;
Гигантский трубчатый червь является примером большого организма, который использует сероводород (через бактерии) в качестве пищи для окисления.
Кто дышит серой?
Так называемые сульфатредуцирующие бактерии, например, «дышат сульфатом» вместо кислорода.
Сульфатредуцирующие бактерии используют серу в качестве акцептора электронов и восстанавливают различные окисленные соединения серы обратно в сульфид, часто в сероводород.
Сероводород, производимый этими бактериями, ответственен за некоторые запахи кишечных газов (газы) и продукты разложения.
Сера поглощается корнями растений из почвы в виде сульфата и транспортируется в виде фосфатного эфира.
SO4 2- → SO3 2- → H2S → цистеин → метионин
Сера в Химии
Сера горит синим пламенем с образованием диоксида серы, который имеет удушающий и раздражающий запах.
Сера реагирует почти со всеми другими элементами, за исключением благородных газов.
Растворимые сульфатные соли плохо абсорбируются и оказывают слабительное действие.
Когда сера горит в воздухе, она производит диоксид серы (SO2)
В воде этот газ производит серную кислоту и сульфиты; сульфиты являются антиоксидантами, которые подавляют рост аэробных бактерий и полезную пищевую добавку в небольших количествах.
Триоксид серы (получаемый в результате катализа из диоксида серы) и серная кислота одинаково сильно кислотны и вызывают коррозию в присутствии воды.
Серная кислота является сильным дегидратирующим агентом, который может удалять имеющиеся молекулы воды и компоненты воды из сахара и органических тканей.
После этой познавательной информации необходимо изучить химические свойства серы, а также ее получение, поэтому я составила таблицу для использования в подготовке к ОГЭ и ЕГЭ по химии.
Таблица: химические свойства серы
1) Получение
Из водных растворов:
2) В промышленности
4) H2S (газ) → S↓ + H2 (t > 400 C);
5) SO2 +C → CO2 + S↓ (t).
2) SO2 + C → CO2 + S↓ (t).
1) CaSO4 + 4C → 4CO↑ + CaS (t);
2) Химические свойства
Окислительные и
восстановительные свойства
1) С металлами:
3S + 2Al → Al2S3 (t);
S + 2Na → Na2S (расплав);
S + Me → MeS + Q (Me = металлы, кроме Au, Pt, Ir).
2) С неметаллами:
S (тв.) + H2 → H2S (150 – 350 C);
2S + C → CS2 (800-900 C);
3S + 2P → P2S3 (расплав);
5S + 2P → P2S5 (без доступа воздуха).
3) С щелочами:
3S + 6NaOH → 2NaS + Na2SO3 + 3H2O;
3S + 3Ca(OH)2 → 2CaS + CaSO4 + 3H2O (кипячение);
2S + 4NaOH + 3O2 → 2Na2SO4 + 2H2O (расплав, t).
4) С кислотами:
S + 2HI → H2S + I2.
5) C солями:
3S + 2KClO3 → 3SO2↑ + 2KCl (t);
S + 2KMnO4 → K2SO4 + 2MnO2 (в слабощелочной среде);