селективность в химии что это
Селективность (химия)
Математически общая химическая селективность S выражается для продукта j в замкнутой системе по формуле:
Для непрерывной системы выход рассчитывается с использованием молярных расходов:
Селективность реакции обычно зависит от температуры, состава, давления и многих других факторов, таких как однородность раствора. Его необходимо тщательно смоделировать, чтобы не повлиять на урожайность во время индустриализации («масштабирования») процесса.
Резюме
Селективность в органической химии
Мгновенная селективность, глобальная селективность и урожайность
Глобальная селективность, определенная выше, представляет собой интегрированную форму мгновенной селективности. Мгновенная дискриминация определяется следующим образом:
С помощью набора дифференциальной записи можно выразить мгновенную селективность как алгебраическую функцию скоростей реакции:
Общая селективность, которая представляет собой среднее значение мгновенной селективности, получается путем интегрирования:
В случае идеальных реакторов:
Знание мгновенной селективности позволяет определить концентрацию интересующего продукта j для заданной скорости превращения ограничивающего реагента i :
∫ нет ^ j ( 0 ) нет ^ j ( т ) d нет ^ j знак равно ν j ν я ∫ нет ^ я ( 0 ) нет ^ я ( т ) s j / я ⋅ d нет ^ я <\ displaystyle \ int \ limits _ <<\ hat
Общая селективность позволяет определить выход продукта j :
Селективность в химии что это
1.2.Выход продукта и селективность
Максимальная масса продукта, которая может быть получена из данного сырья, рассчитывается по уравнению реакции, при этом учитывается содержание в сырье реагента, подлежащего превращению.
Для сложных реакций, когда с одним и тем же исходным веществом могут происходить несколько химических превращений и образовываться различные продукты, оценивать ход процесса лишь по степени превращения или выходу недостаточно. Степень превращения может быть высокой, т. е. большая часть исходных продуктов вступает в химическую реакцию, но не всегда приводит к образованию нужных (целевых) продуктов. Наряду с целевыми могут образовываться побочные продукты. Чем больше образуется целевых и меньше побочных продуктов, тем эффективнее протекает процесс. Для характеристики таких сложных процессов и установление доли целевых продуктов в общем, количестве полученных веществ пользуются величиной селективности.
Поскольку общая масса полученных продуктов равна массе прореагировавшего вещества 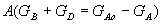
Материальный баланс составляется из расчёта расхода сырья и полученных продуктов на единицу основного продукта. Поскольку на практике приходится иметь дело не с чистыми веществами, а с сырьём сложного химического состава, при составлении материального баланса учитывается масса всех компонентов. Для этого используются данные анализов.
В большинстве случаев масса вещества определяется отдельно для твёрдой, жидкой и газовой фаз. Таким образом, уравнение материального баланса имеет вид:
где 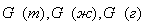
В практических расчётах не всегда присутствуют все три фазы, может быть несколько веществ в какоё-то одной фазе и тогда уравнение (1.1) может упрощаться или усложняться. Нередко материальный баланс составляется для какой-нибудь одной фазы гетерогенного процесса, происходящего в реакторе. Тогда в процессе перехода веществ из одной фазы в другую масса веществ, поступающих в реактор в составе этой фазы (например, газовой), не равна массе веществ, выходящих из реактора. В реакторе увеличивается или уменьшается масса веществ в данной фазе. В этом случае общее уравнение материального баланса, например, для газовой фазы, примет вид:
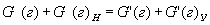
где 
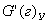
Результаты расчётов сводятся в таблицу материального баланса по массе исходных веществ и продуктов реакции и выражаются в кг. При несовпадении 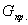
Расчет практического выхода продукта реакции в химии
Выход продукта химической реакции
Выход продукта химической реакции — масса продукта, образовавшегося в результате реакции.
Если эти два показателя равны, то считают, что реакция идет с количественным выходом. Такую реакцию называют стехиометрической.
Но большинство реакции на практике не дают количественного выхода по следующим причинам:
Поэтому для определения эффективности реакции было введено понятие:
Для реакции с количественным выходом относительный выход равен 100%.
Выход продукта реакции определяется двумя параметрами: селективностью и степенью превращения.
Понятие селективности и материального баланса
Селективность — критерий, с помощью которого в химии определяют отношение массы определенного (целевого) продукта к общей массе полученных продуктов.
Степень превращения (конверсии) показывает отношение количества исходного реагента (обычно более дорогостоящего) к количеству полученного целевого продукта.
Например, этот критерий позволяет оценить, какое количество метана CH4 превратилось в угарный газ CO при конверсии водяным паром. Может быть выражена не только через количество вещества, но и через любые пропорциональные ему величины: массу, объем.
Для обеспечения максимального выхода целевого продукта недостаточно только высокой степени конверсии (значительное количество вещества может вступить в реакцию, но не участвовать в образовании целевого продукта) или хорошей селективности, выход продукта определяется совокупностью этих факторов.
Например, N0 моль исходного вещества А вступило в реакцию, из них прореагировало Nx моль со следующим распределением:
Тогда селективность S реакции по целевому продукту B составит:
Степень превращения реагента A для данного примера будет равна соотношению между числом моль прореагировавшего вещества A к общему числу моль, которые были затрачены на реакцию:
Выход продукта ηB в этом примере будет равен соотношению между числом моль реагента A, пошедшего на образование целевого продукта, к числу моль, которые были затрачены на реакцию:
Таким образом, между выходом продукта B, селективностью процесса относительно образования B и степенью превращения исходного реагента A существует взаимосвязь:
Селективность подразделяют на:
Селективность важна для катализаторов, чтобы избирательно увеличивать скорость целевой реакции при наличии нескольких побочных. Высокой селективностью отличаются ферменты (95 — 100%), для гетерогенных катализаторов этот показатель достигает 70%. Гомогенные занимают промежуточное значение.
Выход, степень превращения и селективность — величины безразмерные, учитываются при составлении материального баланса процесса.
Материальный баланс (баланс масс) выводится на основании закона сохранения массы вещества.
Для химических процессов можно сформулировать его так: суммарная масса исходных веществ в начале реакции должна быть равна суммарной массе всех полученных продуктов (целевых и побочных), включая неиспользованные реагенты и растворители, в конце реакции.
Материальный баланс составляется с расчетом расхода реагентов и полученных продуктов на единицу основного продукта. Поскольку на производство вещества поступают в виде смесей, при составлении материального баланса учитывается масса всех компонентов отдельно для твердой, жидкой и газовой фаз. Для процессов, которые идут в несколько стадий, баланс составляется для каждой стадии отдельно.
Материальный баланс, как и выход продукта, может быть:
Как увеличить выход продукта реакции, способы расчета, формулы
Фактический выход конкретного химического процесса можно увеличивать при регулировании следующих факторов:
Для каждой химической реакции, лежащей в основе промышленного производства, необходимо эффективно использовать ресурсы, максимально повысить выход целевого продукта, но при этом он должен быть надлежащего качества и в достаточном количестве. Для это обязательно рассчитывают выход продукта.
Расчет выхода продукта
Например, если процент выхода равен ω=80%, это означает, что количество полученного продукта составляет 80% от теоретически возможного.
Выход продукта реакции можно выразить также через коэффициент, обозначается буквой η (эта):
Как рассчитать теоретический выход продукта реакции, примеры задач
Алгоритм расчета теоретического выхода ηтеор приведен на примере решения следующей задачи:
При взаимодействии 9,84 г оксида железа (III) и 12 г монооксида углерода СО образовались железо и углекислый газ. Рассчитайте теоретический выход (в молях и граммах) железа.
1. Записать уравнение химической реакции:
2. Расставить коэффициенты так, чтобы в обеих частях уравнения количество атомов каждого элемента было одинаковым:
3. Вычислить молярные массы реагентов и целевого продукта (для взятого примера — Fe). Из таблицы Менделеева или справочника узнать атомные массы Ar всех составляющих элементов и посчитать молярные массы М 1 моля каждого исходного вещества и целевого продукта:
4. Найти количество вещества ν каждого реагента:
Если в условии задачи указана масса только одного реагента, то он считается ключевым, и все дальнейшие расчеты выполняются по нему; ν второго исходного вещества вычислять не нужно (пункт 5 пропускается).
5. Для определения ключевого компонента — реагента, который расходуется быстрее остальных, следует определить продолжительность реакции и теоретический выход:
Это говорит о том, что количество используемого для реакции CO в 7 раз больше, чем количество Fe2O3;
Fe2O3 + 3CO → 2Fe + 3CO2↑.
На одну молекулу Fe2O3 должно приходится 3 молекулы CO.
Можно сделать заключение, что CO взят в избытке и расчет следует вести по Fe2O3, который является ключевым компонентом.
По закону кратных соотношений, чтобы найти теоретическое количество целевого продукта νтеор, нужно количество расчетного компонента поделить на коэффициент при нем и умножить на коэффициент при целевом продукте:
νтеор= 0,0615 моль :1 × 2= 0,123 моль — это и есть теоретический выход продукта.
7. Масса продукта (Fe), соответствующая данному количеству вещества, будет равна:
Если в задаче требуется рассчитать теоретический выход одного или нескольких побочных продуктов, то для каждого из них вычисляется молярная масса (пункт 3), а затем последовательность действий повторяется с 6 пункта.
На практике также важен расчет фактического выхода продукта ηпракт или массовой доли выхода продукта ω в %.



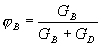

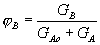
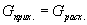


 (1.14)
(1.14) .
. ,
, – скорость расходования реагента А по целевой реакции;
– скорость расходования реагента А по целевой реакции;  – суммарная скорость расходования реагента А.
– суммарная скорость расходования реагента А. (1.15)
(1.15)
 4NO + 6Н2О;
4NO + 6Н2О;
 (1.16)
(1.16) . (1.17)
. (1.17) . (1.18)
. (1.18) ,
, . (1.19)
. (1.19) ,
, ,
, ,
,
 rR + sS. (I)
rR + sS. (I)


 (2.2)
(2.2) (2.3)
(2.3) , (2.4)
, (2.4)


 (2.5)
(2.5) , (2.6)
, (2.6)