сдг биохимия что это
Научная электронная библиотека
Тапбергенов С. О., Тапбергенов Т. С., Советов Б. С.,
10.1. Гормоны-медиаторы симпато-адреналовой системы и активность сукцинатдегидрогеназы (СДГ)
Сукцинатдегидрогеназа (КФ.1.3.99.1) является ферментом катализирующим окисление янтарной кислоты. Активность этого фермента зависит от целого ряда факторов: концентрация субстрата, наличие конкурентных ингибиторов (малат, оксалоацетат), степени сопряжения дыхания и фосфорилирования. Коферментом сукцинадегидрогеназы является флавинадениндинуклеотид (ФАД), в структуре которого находится витамин В2 (рибофлавин).
Как было уже отмечено, одной из наиболее стойкой к повреждению является система окисления янтарной кислоты, которая, например, при инфаркте миокарда повреждается в меньшей степени и восстанавливается более полно, чем система НАД-зависимых дегидрогеназ (Т.В. Фетисова, Р.А. Фролькис., 1976). Авторы считают, что окисление янтарной кислоты становится основным энергодающим процессом, восполняющим ущерб запасов макроэргов при стрессорных поражениях миокарда.
Комплексом проведенных нами исследований было установлено, что дофамин, введенный животным в дозе 1,5 мг/100 г за 15 минут до исследования снижает активность сукцинатдегидрогеназы (СДГ) в митохондриях мозга и печени, в сердце активирует этот фермент. Дофамин, как генетический предшественник норадреналина оказывает слабое воздействие на α- и β-адренорецепторы (О.М. Авакян, 1980) и является агонистом собственных рецепторов.
Норадреналин, как агонист α-адренорецепторов, введенный животным в дозе 0,5 мг/100 г также активирует СДГ в сердце и снижает активность в митохондриях мозга, печени и почек. Адреналин, в отличие от норадреналина как α- и β-адренагонист, введенный в дозе 0,015 мг/100 г вызывает только активацию СДГ и в сердце, и в печени.
Можно предположить, что эффекты основных представителей катехоламинов на СДГ в какой-то мере связаны с адренорецепцией.
Используя изадрин, как специфичный β-адренагонист было установлена аналогичная эффекту дофамина и норадреналина активация СДГ в митохондриях сердца и снижение активности СДГ в мозге, печени и почках. Предварительная блокада β-адренорецепторов обзиданом снимает активирующий эффект изадрина на СДГ в сердце и приводит к снижению активности СДГ в митохондриях, мозга, печени и почек. Блокада α-адренорецепторов введением фентоламина не вызывает изменений активности СДГ в сердце и других органов.
Таким образом, эти данные свидетельствуют, что активирующий на СДГ митохондрий сердца эффект катехоламинов опосредован через бета-адренорецепторы.
Другой причиной наблюдаемых сдвигов активности СДГ в разных тканях может быть вызванна особенностями катаболизма катехоламинов в них и наложением к ним эффектов метаболитов гормонов.
Введение диэтилдитиокарбомата натрия – ингибитора дофамин-бета-гидроксилазы, предотвращая превращение дофамина в норадреналин, не изменяет эффектов дофамина на СДГ всех изучаемых органов. Аналогично, блокада катехол-О-метилтрансферазы введением пирогаллола, предотвращающего превращение норадреналина в адреналин, не приводит к изменению действия норадреналина на СДГ митохондрий всех тканей. Одновременная блокада катехол-О-метилтрансферазы и МАО пирогаллолом и гармином приводит к активации СДГ в митохондриях печени и не влияет на эффекты норадреналина в других тканях.
Эти данные свидетельствуют о том, что ингибирующий эффект норадреналина и дофамина на СДГ митохондрий печени связан с действием метаболитов моноаминоксидазного пути окисления катехоламинов.
Таким образом, наблюдаемая активация СДГ норадреналином в печени на фоне блокады катехол-О-метилтрансферазы и МАО есть эффект нативной молекулы норадреналина, возможно, как и в сердце опосредованный через бета-адренорецепторы.
Известно, что адреналин слабо подвергается моноаминоксидазному окислению. Это является причиной отсутствия изменений активности СДГ в митохондриях мозга и почек при введении адреналина животным.
Исследования, проведенные по изучению влияния продуктов хиноидного окисления катехоламинов на сукцинатдегидрогеназу митохондрий, показало, что адреноксил (моносемикарбозон адренохрома) в дозе 0,2 мг/100 г введенный за 30 минут до исследования, как дофамин и норадреналин, вызывает активацию СДГ в сердце и снижение активности в печени, мозге и почках. Аналогичный эффект на СДГ оказывает и сам адренохром.
Анализ полученных данных показал, что продукты хиноидного окисления при их непосредственном воздействии на СДГ всех тканей вызывают снижение активности фермента митохондрий. В тканях с высокой активностью МАО (печень) снижение активности СДГ могут вызвать продукты окислительного дезаминироваания катехоламинов.
Активирующий эффект продуктов хиноидного окисления катехоламинов на СДГ, как и самих катехоламинов, сопряжен с аденилатциклазным механизмом, реализующимся только при наличии целостной мембранной структуры эффекторных клеток, поскольку, как показали наши наблюдения, 3`5`-АМФ или 3`5`ГМФ не приводят к существенным изменениям активности СДГ митохондрий сердца, мозга, печени и почек.
Таким образом, катехоламины оказывают регуляторное влияние на сукцинатдегидрогеназу (СДГ) митохондрий следующим образом:
– повышают активность СДГ через бета-адренорецепторный аденилатциклазный механизм;
– снижают активность СДГ посредством образующихся продуктов хиноидного или моноаминоксидазного окисления.
Что входит в биохимический анализ крови

БАК или Биохимический анализ крови – это высокоинформативный метод лабораторный диагностики, способный дать общую картину состояния пациента для оценки работы всех внутренних органов и обмена веществ. Расшифровка биохимии позволяет врачу определить точную причину болезни и назначить правильное лечение.
Показания к проведению биохимического анализа крови
Исследование проводится на первой стадии диагностики любых соматических заболеваний любого профиля. Обязательным направление пациента на биохимию крови является при следующих жалобах и симптомах:
Как проводится забор крови на биохимический анализ
Как подготовиться к сдаче крови на «биохимию»?
Чтобы результаты были максимально точными, необходимо соблюдать правила подготовки к анализу крови на биохимическое исследование:
Расшифровка и данные нормальных показателей
Что касается нормальных показателей, то данные для взрослых выглядят так:
| Анализ | Мужчины | Женщины |
| Общий белок | 64-84 г/л. | 64-84 г/л. |
| Гемоглобин | 130-160 г/л | 120-150 г/л. |
| Гаптоглобин | 150-2000 мг/л | 150-2000 мг/л |
| Глюкоза | 3,30-5,50 ммоль/л. | 3,30-5,50 ммоль/л. |
| Мочевина | 2,5-8,3 ммоль/л. | 2,5-8,3 ммоль/л. |
| Креатинин | 62-115 мкмоль/л | 53-97 мкмоль/л. |
| Холестерин | 3,5-6,5 ммоль/л. | 3,5-6,5 ммоль/л. |
| Билирубин | 5-20 мкмоль/л. | 5-20 мкмоль/л. |
| АлАТ (АЛТ) | до 45 ед/л. | до 31 ед/л. |
| АсАТ (АСТ) | до 45 ед/л. | до 31 ед/л. |
| Липаза | 0-190 ед/л. | 0-190 ед/л. |
| Альфа-амилаза | 28-100 ед/л. | 28-100 ед/л. |
| Панкреатическая амилаза | 0-50 ед/л. | 0-50 ед/л. |
Расшифровка основных показателей БАК
Общий белок. Биохимическое исследование крови определяет суммарную концентрацию различных белков, которые состоят из аминокислот. Белок принимает активное участие процессах свертывании, переработки и транспортировки питательных веществ в органы и ткани.
Гемоглобин. Этот специфический белок из системы эритроцитов отвечает за перемещения кислорода в организме
Гаптоглобин. Белок плазмы крови, который связывает гемоглобин и отвечает за сохранение железа в организме. Также участвует в контроле местных воспалительных процессов.
Глюкоза. Важный компонент, который отвечает за углеводный обмен. Ее содержание в артериальной крови всего выше, чем в венозной.
Мочевина. Этот основной продукт распада белков, в которой ненужный организму азот удаляется с мочой.
Креатинин. Это, как и мочевина, конечный продукт белкового обмена. Содержание креатинина в крови зависит от пола, возраста, мышечной массы.
Билирубин. Продукт распада гемоглобина, токсичное вещество двух видов: прямой и не прямой. Они образуют «общий» и норма при расшифровки биохимического исследования крови указывается именно для него.
АлАТ (АЛТ). Аланинаминотрансфераза – это фермент содержат клетки печени, почек и сердца, поэтому его наличие в крови говорит о разрушении клеток этих органов.
АсАТ (АСТ). Аспартатаминотрансфераза — клеточные ферменты, которые участвуют при обмене аминокислот и содержатся в клетках печени сердца и почек.
Липаза. Фермент, способствующий расщеплению жиров.
Амилаза. Она занимается расщеплением углеводов из пищи и обеспечивает их переваривание. Различают альфа-амилазу (диастазу) и панкреатическую амилазу.
Важно помнить, что оценить результаты исследования крови, расшифровать биохимический анализ, поставить диагноз и назначить лечение может только специалист!
Где сдать кровь на биохимию в СВАО
Сдать кровь для биохимического анализа, вы можете в любой клинике, которая имеет лабораторию и необходимые инструменты для проведения исследования. «Поликлиника «ПрофиМед» в двух шагах от метро Отрадное (Москва, СВАО) с 2008 года работает в сфере частных медицинских услуг и имеет собственную лабораторию и штат высококвалифицированных специалистов.
Сдг биохимия что это
Сукцинатдегидрогеназа (СДГ и КФ 1.3.5.1) представляет собой гетеротетрамерный ферментативный комплекс, который одновременно участвует в цикле Кребса и дыхательной цепи переноса электронов. Фермент играет центральную роль в клеточном метаболизме и преобразовании энергии. На шестой стадии цикла Кребса сукцинатдегидрогеназа катализирует реакцию окисления сукцината до фумарата с восстанавлением убихинона до убихинола. СДГ содержит ковалентно связанный кофактор ФАД. Активность фермента выявлена практически во всех исследованных организмах. Даже некоторые анаэробные прокариоты содержат множественные гены, кодирующие II комплекс дыхательной цепи. Впервые очищенный препарат растворимой СДГ из животных тканей был получен Сингером в 1954 г. [1].
В исследовании сукцинатдегидрогеназы важную роль играет выяснение механизмов регуляции активности СДГ не только на уровне белковой молекулы (воздействие на скорость ее функционирования различных метаболитов), но и регуляция фермента путем действия на генетический аппарат. Известно, что комплекс СДГ связан с внутренней мембраной митохондрий, имеет сложную структуру и состоит из 4 субъединиц, включая 2 гидрофильные субъединицы – СДГ-А и СДГ-Б, которые вместе образуют каталитический центр энзима, и 2 гидрофобные субъединицы – СДГ-С и СДГ-Д [2].
2.Сукцинатдегидрогеназа: структура, механизм катализа, регуляция активности
СДГ состоит из четырёх субъединиц, кодируемых ядерным геномом. Молекулярная масса составляет от 125кД до 140 кД. СДГ-С и СДГ-Д содержат гидрофобные компоненты, которые закрепляют комплекс на внутренней мембране митохондрий. Гидрофобные субъединицы С и Д — трансмембранные белки. Вместе они образуют цитохром b560, в шести трансмембранных α-спиралях которого расположен гем b и сайт связывания убихинона. Две молекулы фосфолипидов, один кардиолипин и один фосфатидилэтаноламин, которые заполняют гидрофобное пространство между субъединицами С и Д ниже гема b [2]. В сторону матрикса обращены субъединицы СДГ-А и СДГ-Б. Субъединица СДГ-А содержит ковалентно связанный ФАД и сайт для связыввания сукцината, а субъединица СДГ-Б содержит 3 железо-серных кластера: [2Fe-2S], [4Fe-4S] и [3Fe-4S], которые обеспечивают перенос электрона от сукцината к убихинону. В комплексе СДГ есть два убихинон-связывающих сайта. Сайт с высоким сродством образован субъединицами СДГ-Б, СДГ-С и СДГ-Д, расположенными вблизи со стороны матрицы внутренней митохондриальной мембраны. Сайт с низким сродством образован субъединицами СДГ-С и СДГ-Д, расположенными ближе к межмембранному пространству внутренней митохондриальной мембраны. Наконец, гем B, который расположен между СДГ-С и СДГ-Д, предположительно поглощает свободные электроны, чтобы предотвратить образование активных форм кислорода [4].
На субъединице A расположен сайт связывания и окисления сукцината. Сайт связывания сукцината и сайт связывания убихинона соединены цепочкой из редокс-центров, состоящей из ФАД и трёх железосерных кла-стеров. Эта цепочка простирается на 40 Å через всё тело фермента. Прибли-зительная дистанция между кофакторами не превышает физиологический предел для переноса электронов в 14 Å [2].
Установлено, что присутствие в структуре комплекса II всех субъединиц является необходимым требованием для обеспечения его стабильности. Исследования на дрожжах показали, что отсутствие одной из гидрофобных субъединиц СДГ приводит к значительному снижению обеих гидрофильных субъединиц, следовательно, каталитический центр, не может существовать как свободная димерная структура, без мембранного домена [5].
Все больше свидетельств указывает на то, что дыхательный комплекс II является источником и модулятором активных форм кислорода (АФК). Как потеря функций II комплекса, так и его фармакологическое ингибирование могут приводить к образованию активных форм кислорода в клетках, что оказывает существенное влияние на развитие патофизиологических состояний, то есть рака и нейродегенеративных заболеваний. Несмотря на то, что участие II комплекса в производстве АФК была определена, тонкие детали все еще ожидают прояснения. Важно разрешить эти аспекты, чтобы полностью понять роль II комплекса в патологии и изучить его терапевтический потенциал при раке и других заболеваниях [6].
2.2. Механизм катализа сукцинатдегидрогеназы
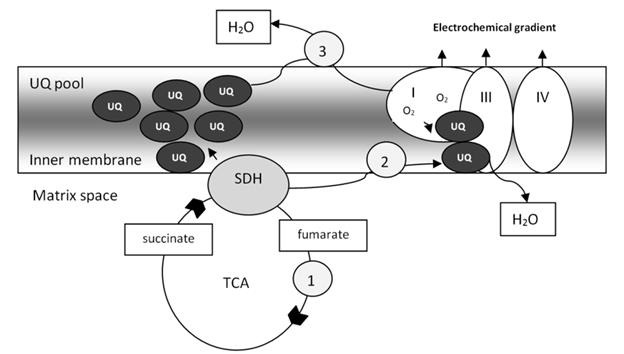
Сукцинатдегидрогеназа является ключевым ферментом в промежуточном метаболизме и преобразовании энергии в живых клетках. Митохондриальный комплекс СДГ катализирует окисление сукцината до фумарата в цикле Кребса и подает электроны в пул убихинона (UQ) дыхательной цепи (рис.1.). Этот фермент катализирует окисление сукцината до фумарата в цикле Кребса (1), а полученные электроны поступают в дыхательный комплекс III для восстановления кислорода и образования воды (2). Это создает электрохимический градиент через внутреннюю мембрану митохондрий, что позволяет синтезировать АТФ. Альтернативно, электроны могут быть направлены для уменьшения пула убихинона (пула UQ) и обеспечения восстанавливающих эквивалентов, необходимых для уменьшения супероксидных анионов, происходящих либо из экзогенного источника, либо из самой дыхательной цепи (3) [7].
Рисунок 1. Подача электронов в пул убихинона дыхательной цепи. [7].
В реакции окисления сукцината до фумарата два атома водорода удаляются из субстрата с помощью ФАД, протезной группы, которая тесно связана с сукцинатдегидрогеназой.
Два электрона из восстановленного комплекса СДГ-ФАДН2 переносятся на убихинон (Q). Затем убихинон восстанавливается до убихинола (QH2). Восстановленный убихинол окисляется комплексом III, а затем электроны переносятся через цитохром c в комплекс IV, где молеку-лярный кислород восстанавливается до воды. Протонная накачка комплекса-ми I, III и IV генерирует электрохимический градиент, который затем ис-пользуется для синтеза АТФ комплексом V (АТФ-синтаза).
Биохимические исследования выявили, что в СДГ митохондрий эука-риот имеется два сайта связывания убихинона [8]. Первый сайт – проксимальный (Qp) располагается на стороне матрицы митохондрий, обладает высоким сродством к убихинону и образован фрагментами СДГБ, СДГС и СДГД, а второй – дистальный (Qd) близок к межмембранному пространству, имеет слабое сродство к убихинону [2,9]. Восстановление убихинона протекает в два этапа: на первом происходит неполное восстановление семихинона (в качестве стабилизатора выступает проксимальный сайт) который восстанавливается до убихинола [2]. В реакции окисления сукцината до фумарата два атома водорода удаляются из субстрата флавинадениндинуклеотидом, протеиновой группой, прикрепленной к сукцинатдегидрогеназе. Два электрона из восстановленного комплекса СДГ ФАДH2 затем переносятся на убихинон растворимой части фермента электронно-транспортной системы. Происходит восстановление убихинона до убихинола. ФАД является неотъемлемым кофактором сукцинатдегидрогеназы. АТФ в митохондриях связывается с окисленным НАДН и ФАДH2 и восстановленным кислородом в воде дыхательной цепи митохондрий [10].
Транспортирование электронов от центра связывания сукцината с пер-вым или проксимальным хинонсвязывающим сайтом осуществляется вдоль цепи окислительно-восстановительных групп, которые включают ковалентно присоединенные ФАД и три кластера железо-серы [12].
В комплексе II расположены два различных активных центра и коор-динированный катализ на этих участках связывает два ключевых биологических пути, то есть окисление сукцината в цикле трикарбоновых кислот и восстановление хинона в цепи переноса электронов. Субъединица СДГА содержит ковалентно присоединенный ФАД-редокс-фрагмент и сайт связывания дикарбоксилата, где сукцинат окисляется до фумарата. Протоны этого окисления переносятся на растворитель, а фумарат действует как следующий субстрат в цикле Кребса. Электроны продукта катализа переносятся на 40 Å через три кластера железо-серы в белке СДГБ. Эти электроны действуют как сосубстраты на втором активном центре, расположенном на границе интегральных мембранных субъединиц. На этом хинон-восстанавливающем сайте, 2Н + и 2е- уменьшают убихинон до убихинола. Полученный пул хинола поддерживает синтез АТФ [13].
Два электрона, абстрагированные от дегидрирования сукцината, последовательно направляются в цепь переноса электронов от флавин-адениндинуклеотида до захваченного мембраной убихинона через кофакторы [2Fe-2S], [4Fe-4S], [3Fe-4S] и, возможно, гем b. Этот дальний, линейно-линейный электронный канал простирается более чем на 40 Å от растворимого каталитического домена СДГ до мембранно-закрепляющего домена фермента [2]. Участие гема b как части цепи переноса электронов не было четко установлено, поэтому функциональная значимость гема неясна [14].
2.3.Регуляция активности фермента сукцинатдегидрогеназы
Активность СДГ можно модулировать с помощью конкурентов сукцината, ингибиторов убихинона или посттрансляционных модификаций. Конкурентными ингибиторами сукцината являются малонат, малат и оксалоацетат. По структуре эти соединения похожи на сукцинат, что объясняет их способность конкурировать за связывание с активным центром СДГ. Примечательно, что как малат, так и оксалоацетат являются метаболитами цикла трикарбоновых кислот. Карбоксин и теноилтрифторацетон являются синтетическими ингибиторами убихинона, которые блокируют перенос электрона от комплекса СДГ к убихинону [4].
Что касается посттрансляционных модификаций, было показано, что фосфорилирование и ацетилирование остатков лизина субъединицы СДГA модулируют активность СДГ [15,16]. Например, снижение SIRT3, обладающий деацетилазной активностью, приводил к накоплению ацетилированного лизина СДГА. Это снизило активность комплекса СДГ. После повторной экспрессии SIRT3 ацетилирование лизина СДГA было удалено, а активность СДГ восстановлена [16]. Точно так же фосфорилирование остатков лизина СДГА оказывает аналогичное влияние на активность СДГ [15]. Недавно сообщалось о сукцинилировании остатков лизина СДГА в клетках, обработанным ингибитором СДГ или при снижение активности сукцинил-КоА-синтетазы. Модификация сукцинил-лизина может модулировать активность СДГ. [17,18]
Установлено, что в условиях in vitro ингибирующим эффектом на сук-цинатдегидрогеназную активность митохондрий обладают все исследован-ные производные 1,3,4-тиадиазинов. Максимальное ингибирующее влияние показано для L-9 и L-10 1,3,4-тиадиазиновых соединений, под воздействием которых активность СДГ снизилась в 6 раз по сравнению с нативными митохондриями. Высказано предположение о том, что сходный ингибирующий эффект на активность СДГ обусловлен наличием 1,3,4-тиадиазиновых колец и колец морфолина, тогда как разная степень ингибирующей активности СДГ, вероятно, связана с различием заместителей в пятом положении 1,3,4-тиадиазинового кольца [19].
За последние несколько лет комплекс СДГ стал предметом нового интереса. Это было обусловлено, прежде всего, открытием его роли в различных заболеваниях, а также открытием новых факторов сборки. Как и большинство важных открытий, эти новые открытия дают больше вопросов, чем ответов. Предстоящие годы, вероятно, станут свидетелями нового понимания сборки СДГ, включая новые факторы и большую ясность в отношении механизмов [20].
Таким образом, изучая заболевания человека, связанных с СДГ, позволяет предположить, что фермент играет не только центральную роль в цикле Кребса и дыхательной цепи, но также отличается от других митохондриальных дегидрогеназ благодаря своим уникальным окислительно-восстановительным свойствам. В партнерстве с убихиноном СДГ будет представлять собой важный антиоксидантный фермент в митохондриях [7].
Биохимия 19 показателей (расширенная) (вен. кровь) в Москве
Расширенный биохимический анализ крови включает 19 информативных показателей, характеризующих состояние главных систем организма – почек, печени, желчного пузыря, сердечно-сосудистой и костно-мышечной системы, содержит маркеры нарушений метаболизма, ведущих к развитию хронических заболеваний. Комплекс также включает самую эффективную методику ранней диагностики сахарного диабета до появления первых симптомов.
Что входит в комплекс
Приём и исследование биоматериала
Когда нужно сдавать анализ Биохимия 19 показателей (расширенная)?
Профилактическое обследование, возраст от 20 лет.
Подробное описание исследования
Этот комплекс особенно рекомендуется тем, у кого есть недомогания неустановленной причины, при плохом самочувствии. Результаты обследования помогут оценить нарушения в работе основных систем организма, что позволит врачу вовремя начать необходимое лечение и не допустить развитие хронических заболеваний.
Рекомендуется проходить ежегодную профилактическую проверку организма, чтобы выявить начинающиеся патологические изменения на самой ранней стадии, когда они еще обратимы и поддаются коррекции.
Регулярная проверка основных биохимических показателей организма – залог сохранения здоровья.
Что ещё назначают с этим исследованием?
Использованная литература
Подготовка к исследованию
Противопоказания и ограничения
Абсолютных противопоказаний нет.
Интерпретация результата
Альбумин:
Повышенный уровень альбумина в крови может наблюдаться при обезвоживании.
Причины пониженного уровня альбумина: нарушение синтеза альбумина (при заболеваниях печени или наследственных патологиях), при повышенном расходе белка (при ожогах, сахарном диабете, потере крови, заболеваниях почек), повышенная скорость обмена веществ (при тиреотоксикозе, инфекционных и ревматических заболеваниях, опухолях), задержка жидкости в сосудистом русле (при приеме эстрогенсодержащих препаратов, патологиях сердца), дефицит поступления альбумина с пищей (при голодании или заболеваниях пищеварительного тракта).
Креатинин:
Повышение уровня при: активной физической нагрузке, употреблении мясной пищи, акромегалии, гипотиреозе, гигантизме, инфекционных процессах и сахарном диабете.
Понижение уровня при: гипертиреозе, употреблении вегетарианской пищи, анемии, лейкозе, параличе, мышечных дистрофиях, заболеваниях с уменьшением мышечной массы, развернутой стадии патологии почек, воспалительных и метаболических заболеваниях.
Калий, Натрий, Хлориды:
Снижение калия (гипокалиемия): хроническое голодание (непоступление с пищей), продолжительная рвота, понос (потеря с кишечным соком), нарушение функции почек, избыток гормонов коры надпочечников (в т.ч. прием лекарственных форм кортизона), муковисцидоз.
Повышение натрия (гипернатриемия): избыточное потребление соли, потеря внеклеточной жидкости (профузный пот, тяжелая рвота и диарея, повышенное мочеотделение (несахарный диабет), избыточная задержка (повышенная функция коры надпочечников), нарушение центральной регуляции водно-солевого обмена (патология гипоталамуса, кома).
Снижение натрия (гипонатриемия): потеря (злоупотребление мочегонными, патология почек, надпочечниковая недостаточность), снижение концентрации за счет повышения объема жидкости (сахарный диабет, хроническая сердечная недостаточность, цирроз печени, нефротический синдром, отеки).
Повышение хлоридов: обезвоживание, острая почечная недостаточность, несахарный диабет, отравление салицилатами, повышенная функция коры надпочечников.
Снижение хлоридов: избыточное потоотделение, рвота, промывание желудка, увеличение объема жидкости.
Холестерин общий:
Повышение: генетические особенности (семейные гиперлипопротеинемии), заболевания печени, игипотиреоз (недостаточность функции щитовидной железы),алкоголизм,ишемическая болезнь сердца (атеросклероз), беременность
прием синтетических препаратов половых гормонов (контрацептивы).
Снижение: гипертиреоз (избыток функции щитовидной железы),нарушение усвоения жиров.
Глюкоза:
Гликированный гемоглобин:
Повышение показателя: нарушение толератности к глюкозе,сахарный диабет.
Фосфатаза щелочная:
Повышение при: беременности, заболеваниях печени, заболевания костной системы, инфекционный мононуклеоз, первичный цирроз печени.
Понижение при: гипотериозе, недостатке магния и цинка, анемии тяжелой формы.
Триглицириды:
Повышение: заболевания печени, ожирение, нарушение толерантности к глюкозе, алкоголизм, ИБС, избыточное употребление животных жиров, наследственная предрасположенность.
Мочевина:
Повышение уровня мочевины характерно: при диете с избыточным содержанием белка, усиленном катаболизме белков, прием глюкокортикоидов, андрогенов, лихорадочные состояния, усиленной физической нагрузке, при ослаблении выделительной функции почек (гломерулонефрит, амилоидоз почек, пиелонефрит, туберкулез почек, приеме нефротоксичных препаратов (тетрациклина), сердечной недостаточности, сильных кровотечениях, шоке, кишечной непроходимости, ожогах, нарушение оттока мочи (опухоль мочевого пузыря, аденома простаты, камни в мочевом пузыре), дегидратации.
Понижение уровня мочевины при: нарушение функций печени (гепатиты, цирроз), отравление фосфором, вегетарианской низкобелковой диете, голодании, беременности, при синдроме нарушенного кишечного всасывания (мальабсорбция), гипергидратации, состоянии после диализа.
Мочевая кислота:
Повышение показателя наблюдается при подагре, почечной недостаточности, токсикозе беременных, при тяжелой физической нагрузке.
Понижение показателя: болезнь Вильсона-Коновалова, синдром Фанкони, диета бедная нуклеиновыми кислотами.
Амилаза:
Повышение показателя: заболевания поджелудочной железы и пищеварительного тракта, инфекционное поражение слюнных желез (эндемический паротит), хирургическую патологию.
Понижение при: недостаточности функций поджелудочной железы, инфекционном поражение клеток печени, развитием осложнений во время беременности, муковисцидозе.
Аланинаминотрансфераза (АЛТ):
Повышение при: заболеваниях печени, при приеме токсических лекарственных препаратов, непроходимости желчных путей, цитолизе.
Понижение: в норме активность низкая.
Аспартатаминотрансфераза (АСТ):
Повышение: заболевания печени, при приеме токсических лекарственных препаратов, непроходимости желчных путей, цитолизе, травмах, сильных физических нагрузках, опухолях, повреждении мышц.
Понижение: в норме активность низкая.
Билирубин общий:
Повышение: желчнокаменная болезнь, анемия, желтуха новорожденных, генетические нарушения обмена билирубина (например, синдром Жильбера), воспаление желчного пузыря и желчевыводящих путей, гепатиты, цирроз печени, приём токсических лекарственных препаратов.
Понижение: в норме активность низкая.
Лактатдегидрогеназа общая (ЛДГ):
Повышение: тромбоэмболии, патология мышц, анемии, злокачественные новообразования, заболевания печени, сердечная недостаточность, переломы, инфекционный мононуклеоз, эклампсия, гипотиреоз, ожоговая болезнь.
Понижение: приём лекарственных препаратов.
Гамма ГТ:
Повышение: заболевание печени и желчевыводящих путей (воспалительные процессы, цирроз, механическая желтуха, образования, алкоголизм), панкреатит, ожирение, приём токсических лекарственных препаратов, системная красная волчанка, злокачественные опухоли, сердечная недостаточность, гипертиреоз.
Сывороточное железо:
Повышение: наследственный гемохроматоз, талассемия, прием препаратов железа, употребление продуктов, содержащих железо, B12-дефицитная анемия.
Понижение: железодефицитная анемия, нарушение всасывания железа (гастрит, резекция желудка), диета, беременность, онкологические заболевания, хронические аутоиммунные заболевания.
Общий белок:
Повышение: потеря жидкости, острая и хроническая инфекция, аутоиммунные заболевания, дыхательная недостаточность.
Понижение: голодание, воспалительные процессы в кишечнике, заболевания печени, травмы, длительная лихорадка, злокачественные новообразования, сахарный диабет, заболевания почек.