с чем взаимодействует гидроксид кальция
Гидроксиды щелочных металлов (щелочи)
Гидроксиды щелочных металлов (щелочи)
Способы получения
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гид-ридов и некоторых других бинарных соединений с водой также образуют-ся щелочи.
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Химические свойства
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Еще пример : гидроксид натрия с гидроксидом алюминия в растворе образует также комплексную соль:
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например : гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
Сера взаимодействует с щелочами только при нагревании:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
С щелочами взаимодействуют соли тяжелых металлов.
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
NH4Cl + NaOH = NH3 + H2O + NaCl
2LiOH → Li2O + H2O
NaOH ↔ Na + + OH —
4NaOH → 4Na + O2 + 2H2O
Гидроксид кальция
| Гидроксид кальция | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Гидроксид кальция |
| Химическая формула | Ca(OH)2 |
| Физические свойства | |
| Состояние (ст. усл.) | белые кристаллы |
| Отн. молек. масса | 74.093 а. е. м. |
| Молярная масса | 74.093 г/моль |
| Плотность | 2.211 г/см³ |
| Термические свойства | |
| Температура плавления | 512 °C |
| Химические свойства | |
| Растворимость в воде | 0.185 г/100 мл |
| Классификация | |
| Рег. номер CAS | [1305-62-0] |
Содержание
Тривиальные названия
Получение
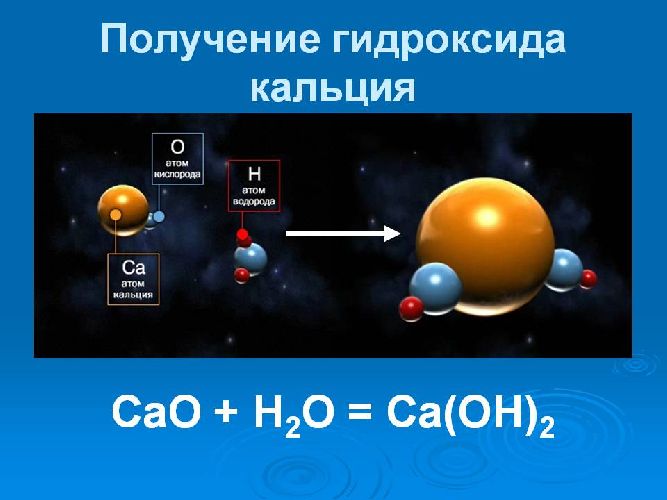
Получают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
Эта реакция экзотермическая, идёт с выделением 16 ккал (67 кДж) на моль.
Свойства
Внешний вид — белый порошок, мало растворимый в воде:
| Температура, °C | Растворимость, г Ca(OH)2/100 г H2O |
|---|---|
| 0 | 0,173 |
| 20 | 0,166 |
| 50 | 0,13 |
| 100 | 0,08 |
Гидроксид кальция является довольно сильным основанием, из-за чего водный раствор имеет щелочную реакцию. Растворимость падает с ростом температуры.
Как и все основания, реагирует с кислотами (см. реакция нейтрализации) с образованием соответствующих солей кальция:
по этой же причине раствор гидроксида кальция мутнеет на воздухе, так как гидроксид кальция, как и другие сильные основания, реагирует с растворённым в воде углекислым газом:
Если продолжить барботацию углекислого газа, выпавший осадок растворится, так как образуется кислая соль — гидрокарбонат кальция:
причём при нагревании раствора гидрокарбонат снова разрушается и выпадает осадок карбоната кальция:
Гидроксид кальция реагирует с угарным газом при температуре около 400 °C:
Как сильное основание реагирует с солями, но только если в результате реакции выпадает осадок:
Гидроксид кальция
| Гидроксид кальция | |
|---|---|
| Систематическое наименование | Гидроксид кальция |
| Традиционные названия | гашёная (едкая) известь |
| Хим. формула | Ca(OH)2 |
| Рац. формула | Ca(OH)2 |
| Состояние | белые кристаллы |
| Молярная масса | 74.093 г/моль |
| Плотность | 2.211 г/см³ |
| Температура | |
| • плавления | 512 °C |
| • разложения | 580 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | 0.185 г/100 мл |
| ГОСТ | ГОСТ 9262-77 |
| Рег. номер CAS | [1305-62-0] |
| PubChem | 6093208 |
| Рег. номер EINECS | 215-137-3 |
| SMILES | |
| Кодекс Алиментариус | E526 |
| RTECS | EW2800000 |
| ChEBI | 31341 |
| ChemSpider | 14094 и 21170965 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидроксид кальция (гашёная известь, едкая) — химическое вещество с формулой Ca(OH)2, сильное основание. Представляет собой мелкокристаллический порошок белого цвета, малорастворимый в воде.
Содержание
Некоторые распространённые названия
Получение
Получают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
Эта реакция сильно экзотермическая, происходит с выделением 16 ккал на моль (67 кДж на моль).
Физические свойства
| Температура, °C | Растворимость, г Ca(OH)2/100 г H2O |
|---|---|
| 0 | 0,173 |
| 20 | 0,166 |
| 50 | 0,13 |
| 100 | 0,08 |
По внешнему виду представляет собой белый порошок, малорастворимый в воде. Растворимость в воде падает с ростом температуры.
При нагреве вещества до температуры 512 °C парциальное давление водяного пара, находящегося в равновесии с гидроксидом кальция становится равным атмосферному давлению (101,325 кПа) и гидроксид кальция начинает терять воду, превращаясь в оксид кальция, при температуре 600 °C процесс потери воды практически полностью завершается:
Кристаллизуется в гексагональной кристаллической структуре.
Химические свойства
Гидроксид кальция является довольно сильным основанием, из-за чего водный раствор имеет сильнощелочную реакцию.
Как и все основания, реагирует с кислотами; как щелочь участвует в реакциях нейтрализации кислот (см. реакция нейтрализации) с образованием соответствующих солей кальция, например:
Реакцией нейтрализации обусловлено постепенное помутнение раствора гидроксида кальция при стоянии на воздухе, так как гидроксид кальция, взаимодействует с поглощённым из воздуха углекислым газом, как и растворы других сильных оснований, эта же реакция происходит при пропускании углекислого газа через известковую воду, — реакции качественного анализа на углекислый газ:
При дальнейшем пропускании углекислого газа через известковую воду раствор снова становится прозрачным, так как при этом образуется кислая соль — гидрокарбонат кальция, имеющий более высокую растворимость в воде, причём при нагревании раствора гидрокарбоната кальция он снова разлагается с выделением углекислого газа и при этом выпадает осадок карбоната кальция:
Гидроксид кальция реагирует с оксидом углерода при температуре около 400 °C:
Реагирует с некоторыми солями, но реакция происходит только в том случае, если в результате реакции одно из образующихся веществ плохо растворимое и выпадает в осадок, например:
Гидроксид кальция
Всего получено оценок: 76.
Всего получено оценок: 76.
Гидроксид кальция – химическое вещество имеющее сильное основание. Каковы его особенности и химические свойства рассмотрим в данной статье.
Характеристика гидроксида кальция
Молярная масса гидроксида кальция составляет 74.09 г/моль. Это значит, что 74,09 г/моль количества вещества гидроксида кальция содержат 6,02*10^23 атомов или молекул этого вещества.
Гидроксид кальция используется для побелки в строительстве, дезинфекции стволов деревьев, в сахарной промышленности, для дублении кож, для получения хлорной извести. Тестообразная смесь гашеной извести с цементом и песком используется в строительстве.

Химические свойства гидроксида кальция
Гидроксид кальция, как и все основания, вступает в реакцию с кислотами:
Гидроксид кальция также способен образовывать соединения с углекислым газом. Раствор этого вещества на воздухе становится мутным, так как гидроксид кальция, подобно другим сильным основаниям, взаимодействует с растворенным в воде углекислым газом:
При нагревании до 400 градусов гидроксид кальция вступает в реакцию с оксидом углерода:
Гидроксид кальция может взаимодействовать с солями, в результате чего образуется осадок:
При температуре 520-580 градусов гидроксид кальция подвержен реакции разложения. В результате образуются оксид кальция и вода:

Что мы узнали?
Гидроксид кальция – сильное основание, малорастворимое в воде. Как и любой химический элемент он обладает рядом свойств т способен вступать в реакцию с углекислым газом, солями, а также разлагается при высокой температуре. Гидроксид кальция используют в строительстве и промышленности.
Кальция гидроокись
Кальция гидроокись
| Гидроксид кальция | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Гидроксид кальция |
| Отн. молек. масса | 74.093 а. е. м. |
| Молярная масса | 74.093 г/моль |
| Физические свойства | |
| Плотность вещества | 2.211 г/см³ |
| Состояние (ст. усл.) | белые кристаллы |
| Термические свойства | |
| Температура плавления | 512 °C |
| Химические свойства | |
| Растворимость в воде | 0.185 г/100 мл |
| Классификация | |
| номер CAS | [1305-62-0] |
Гидрокси́д ка́льция — химическое вещество, сильное основание, формула Ca(OH)2. Представляет собой порошок белого цвета, плохо растворимый в воде.
Содержание
Тривиальные названия
Часто называют просто известь или извёстка (так же называют и оксид кальция).
Получение
Получают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
Эта реакция экзотермическая, идёт с выделением 16 ккал (67 кДж) на моль.
Свойства
Внешний вид — белый порошок, мало растворимый в воде:
| Температура, °C | Растворимость, г Ca(OH)2/100 г H2O |
|---|---|
| 0 | 0,173 |
| 20 | 0,166 |
| 50 | 0,13 |
| 100 | 0,08 |
Гидроксид кальция является довольно сильным основанием, из-за чего водный раствор имеет щелочную реакцию.
Как и все гидроксиды, реагирует с кислотами (см. реакция нейтрализации) с образованием соответствующих солей кальция:
по этой же причине раствор гидроксида кальция мутнеет на воздухе, так как гидроксид кальция, как и другие сильные основания, реагирует с растворённым в воде углекислым газом:
Если продолжить барботацию углекислого газа, выпавший осадок растворится, так как образуется кислая соль — гидрокарбонат кальция:
причём при нагревании раствора гидрокарбонат снова разрушается и выпадает осадок карбоната кальция:
Гидроксид кальция реагирует с монооксидом углерода при температуре около 400°C:
Применение
Это экзотермическая реакция, выделение энергии составляет 27 ккал (113 кДж). Одновременно происходит и образование силиката кальция:
Как видно из реакции, в ходе её выделяется вода. Это является отрицательным фактором, так как в помещениях, построенных с помощью известкового строительного раствора долгое время сохраняется повышенная влажность. В связи с этим, а также благодаря ряду других преимуществ перед гидроксидом кальция, цемент практически вытеснил его в качестве связующего строительных растворов;
См. также
Полезное
Смотреть что такое «Кальция гидроокись» в других словарях:
КАЛЬЦИЯ ГИДРООКИСЬ — Calcii hydroxydum. Получают из кальция окиси (извести жженой). При обливании половинным по весу количеством воды известь жженая разогревается и значительно увеличивается в объеме, образуя кальция гидроокись. При этом куски распадаются в белый по … Отечественные ветеринарные препараты
кальция гидроокись — kalcio hidroksidas statusas T sritis chemija formulė Ca(OH)₂ atitikmenys: angl. calcium hydroxide; hydrated lime; lime hydrate; slaked lime rus. гашенная известь; гидратная известь; кальция гидроксид; кальция гидроокись ryšiai: sinonimas –… … Chemijos terminų aiškinamasis žodynas
Кальция гидроокись — гашёная известь, пушонка, Ca (OH)2, сильное основание; бесцветные кристаллы, плотность 2,24 г/см3. Технический продукт белый пушистый порошок. При нагревании отщепляет воду, превращаясь в CaO. Растворимость в воде очень мала (г на 100 г… … Большая советская энциклопедия
Кальция окись — негашёная известь, кипелка, CaO, соединение кальция с кислородом; бесцветные кристаллы, плотность 3,4 г/см3, tпл 2585 °С. Технический продукт белое пористое вещество. К. о. жадно реагирует с водой с выделением большого количества тепла и… … Большая советская энциклопедия
кальция гидроксид — kalcio hidroksidas statusas T sritis chemija formulė Ca(OH)₂ atitikmenys: angl. calcium hydroxide; hydrated lime; lime hydrate; slaked lime rus. гашенная известь; гидратная известь; кальция гидроксид; кальция гидроокись ryšiai: sinonimas –… … Chemijos terminų aiškinamasis žodynas
гидроокись кальция — Регулятор кислотности пищевого продукта, получаемый действием воды на известь СаО, содержащий основного вещества щелочи Са(ОН)2 не менее 92,0 %, фторидов не более 50 мг/кг, бария не более 300 мг/кг, свинца не более 10,0 мг/кг, представляющий… … Справочник технического переводчика
ГОСТ 27753.9-88: Грунты тепличные. Методы определения водорастворимых кальция и магния — Терминология ГОСТ 27753.9 88: Грунты тепличные. Методы определения водорастворимых кальция и магния оригинал документа: 2.1. Аппаратура и реактивы Весы лабораторные 4 го класса точности с наибольшим пределом взвешивания 500 г по ГОСТ 24104 и весы … Словарь-справочник терминов нормативно-технической документации
ГОСТ 21639.3-93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния — Терминология ГОСТ 21639.3 93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния оригинал документа: 8.2 Аппаратура, реактивы и растворы Спектрофотометр атомно абсорбционный любого типа с источником излучения… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 21639.7-93: Флюсы для электрошлакового переплава. Методы определения фтористого кальция — Терминология ГОСТ 21639.7 93: Флюсы для электрошлакового переплава. Методы определения фтористого кальция оригинал документа: 4.2 Аппаратура, реактивы и растворы Установка для определения массовой доли фтористого кальция (рисунок 1) состоит из… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 26487-85: Почвы. Определение обменного кальция и обменного (подвижного) магния методами ЦИНАО — Терминология ГОСТ 26487 85: Почвы. Определение обменного кальция и обменного (подвижного) магния методами ЦИНАО оригинал документа: 2.2. Аппаратура, материалы и реактивы 2.2.1. Для проведения анализа применяют: весы лабораторные 2 го класса… … Словарь-справочник терминов нормативно-технической документации



