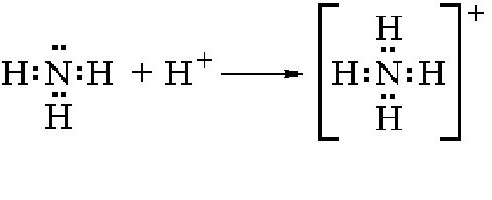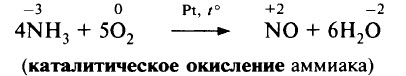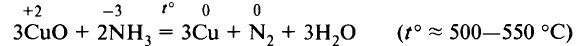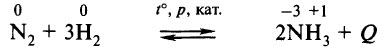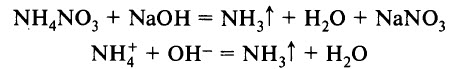с чем реагируют соли аммония
Соли аммония. Общая характеристика. Химические свойства.
Соли аммония.
Ион аммония образуется, когда аммиак, слабое основание, реагирует с кислотами Бренстеда (доноры протонов):
Таким образом, обработка концентрированных растворов солей аммония сильным основанием дает аммиак.
Когда аммиак растворяется в воде, его небольшое количество превращается в ионы аммония:
— если pH низкий, равновесие смещается вправо: больше молекул аммиака превращается в ионы аммония.
— если pH высокий, равновесие сдвигается влево: ион гидроксида отнимает протон от иона аммония, образуя аммиак.
Важно! Все соли аммония растворимы в воде, кроме гексахлороплатината аммония (раньше использовалось в качестве теста на NH4 + )
Наибольшее значение среди солей аммония в промышленности имеют хлорид аммония (NH4Cl), сульфат аммония ((NH4)2SO4), нитрат аммония (NH4NO3), характеристики которых мы сегодня и пройдем.
Уровень опасности: раздражающее средство
3) С щелочами (Ме АІ):
4) С щелочами (Ме АІІ):
5) С нерастворимыми основаниями:
6) C основаниями (комплексообразующими):
8) С солями летучих кислот:
9) С оксидами малоактивных Ме:
10) С оксидами активных Ме:
Уровень опасности: окислитель, раздражающее средство, экологически опасен
Уровень опасности: окислитель (взрывчатое вещество), раздражающее вещество
NH4NO 3
Соли аммония: получение и химические свойства
Соли аммония
Способы получения солей аммония
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Химические свойства солей аммония
NH4Cl ⇄ NH4 + + Cl –
Соли аммония реагируют с щелочами с образованием аммиака.
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Соли аммония: свойства. Соли аммония: применение
Аммоний – одно из многочисленных соединений азота. Его соли обладают рядом интересных свойств и находят практическое применение во многих областях человеческой деятельности. Исследованием свойств этого элемента занимается химия. Соли аммония изучаются в разделе исследования взаимодействий азота с другими химическими элементами.
Что такое аммоний
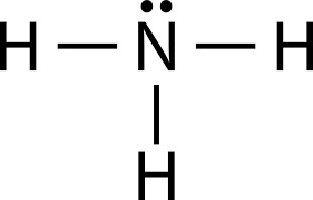
Чтобы узнать, что такое аммоний, следует более внимательно ознакомиться с принципом соединения азота и атомов углерода. Молекула аммиака записывается в виде NH3. Атом азота связан своими ковалентными связями с тремя протонами. Вследствие внутренней структуры азота одна связь остается нераспределенной.
Поэтому NH3 активно вступает в различные ковалентные связи с другими элементами, задействуя нераспределенную электронную пару. Если в соединение вступает ядро водорода, то образуется ион аммония. Схема реакции приведена ниже:
Как можно видеть, в данной реакции молекула аммиака является акцептором одного протона и тем самым ведет себя как основание. Аммоний в свободном виде не существует, так как практически мгновенно распадается на водород и аммиак. Соли аммония получаются в результате взаимодействия этого элемента с другими веществами. Как показывают практические опыты, аммоний вступает в различные соединения с кислотами, нейтрализуя их и образовывая соли аммония. Например, в случае вступления в реакцию с соляной кислотой происходит образование одной из солей этого элемента:
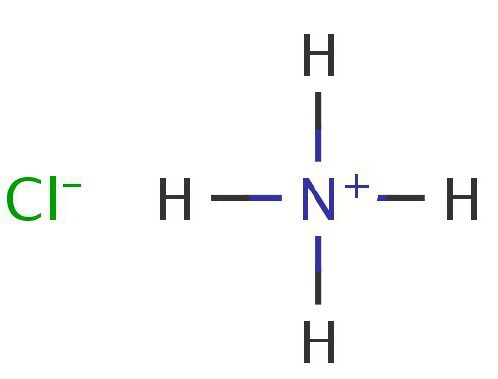
В результате реакции получается хлорид соли аммония.
Взаимодействие с водой
Поскольку количество ионов гидроксогруппы чрезвычайно велико, то водные растворы аммиака обладают щелочной реакцией. Однако по старой химической привычке водный раствор аммиака записывают, как NH4OH. Данное вещество называется гидроксидом аммония, а щелочную реакцию этого соединения рассматривают в виде диссоциации молекул, на которые раскладывается аммиак.
Соли аммония. Свойства и основные характеристики
Большая часть солей NH4 практически бесцветны и довольно хорошо растворяются в воде. Данное соединение обладает многими свойствами металлов, поэтому и соли аммония ведут себя так же, как и соли различных металлов. Вот несколько примеров такого подобия:
— Соли NH4 являются хорошими электролитами. Они подвергаются гидролизу в различных растворах. Эту реакцию можно проследить на примере диссоциации хлорида аммония:
— Подвержены гидролизу. В результате получается реакция соли слабого основания и сильной кислоты:
— имеют ионную кристаллическую решетку, обладают электропроводимостью;
— не выдерживают высоких температур и распадаются на составляющие.
Необратимые и обратимые процессы
Другие соли этого элемента, анион в которых имеет ярко выраженные свойства окислителя, распадаются безвозвратно. Стандартным примером такой реакции может служить распад нитрата аммония, который выглядит следующим образом:
Поскольку один из продуктов взаимодействия покидает ее поле, реакция прекращается.
Применение аммиака и солей аммония
Весомая доля аммиака, добываемого промышленным путем, идет на применение его в установках для заморозки и охлаждения. Находят соли аммония применение в повседневной жизни и в медицине. Но подавляющая часть аммиака идет на изготовление азотной кислоты и разнообразных азотсодержащих соединений, прежде всего, различных минеральных удобрений.
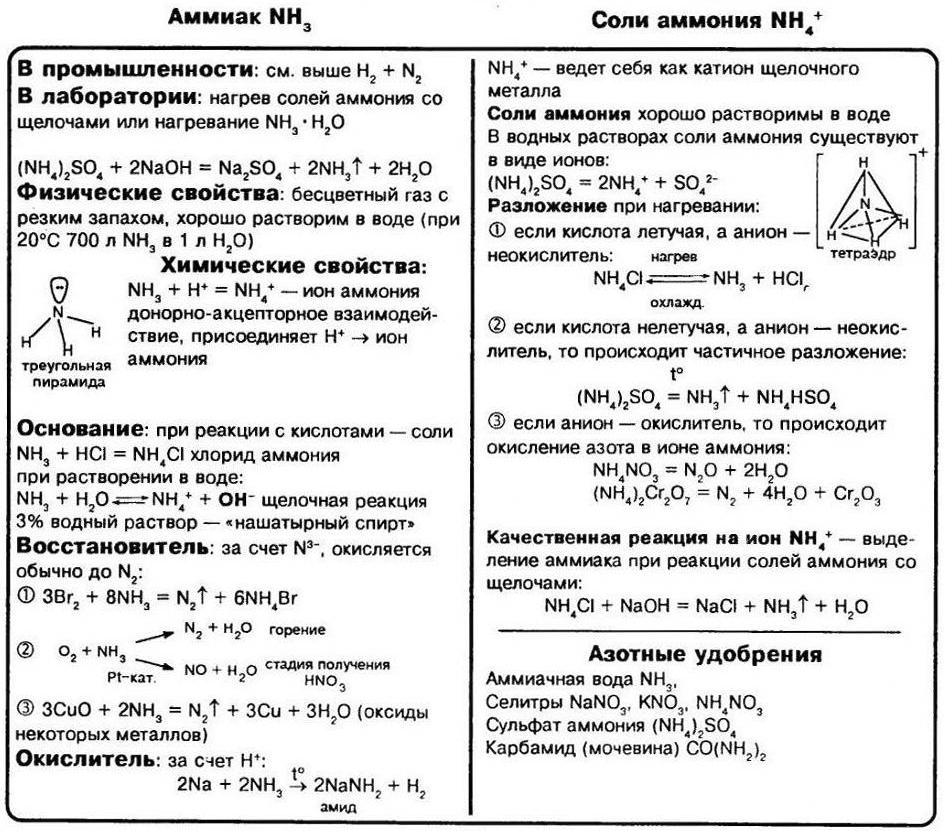
Азотистые удобрения
Наиболее известные соли производной азота, применение которых в хозяйственной деятельности крайне важно – это сульфат аммония, нитрат аммония, хлорид аммония. Азот – необходимая составляющая часть белков. Этот элемент является обязательным для существования любого живого организма. Растения извлекают азот из плодородного грунта, где этот элемент находится преимущественно в связанном виде. Обычно азот встречается, как соли аммония и соединения азотной кислоты. Растворяясь во влажной почве, эти неорганические соединения попадают в организмы растений и перерабатываются ими в различные белки и аминокислоты. Животные и люди не могут усваивать азот ни в свободном виде, ни в качестве его простых соединений. Для питания и роста им необходим белок, составной частью которого обязательно является азот. Только при участии растений мы получаем столь необходимый нам элемент для жизни и здоровья.
Нашатырь
Аммиак в жидком виде и крепкие растворы солей аммония также применяются в качестве азотных удобрений – содержание азота в них выше, чем в твердых удобрениях, и усваивается растениями он лучше.
С чем реагируют соли аммония
Ключевые слова конспекта: аммиак, строение молекулы, свойства, соли аммония, запах аммиака, гипс, азотная кислота, мочевина.
СТРОЕНИЕ МОЛЕКУЛЫ АММИАКА,
ЕГО ФИЗИЧЕСКИЕ СВОЙСТВА
Водородным соединением азота является аммиак NH3. Аммиак – вещество молекулярного строения. Его электронная и графическая формулы изображены на рисунке.
В молекуле аммиака одинарные связи, так как на атоме азота в молекуле NH3 имеется неподелённая электронная пара. Выступая в качестве донора электронной пары, атом азота может участвовать в образовании по донорно–акцепторному механизму четвёртой ковалентной связи с другими атомами или ионами, обладающими электроноакцепторными свойствами. Именно поэтому аммиак реагирует с кислотами. Молекула аммиака способна присоединять протон (или ион гидроксония). При этом возникает четвёртая ковалентная связь с атомом водорода по донорно–акцепторному механизму. В результате образуется ион аммония:
При обычных условиях аммиак – бесцветный газ с резким характерным раздражающим запахом. Aммиaк легче воздуха.
Аммиак кипит при температуре –33,3 °С, его температура плавления –77,7 °С. Аммиaк легко сжижается при охлаждении и повышении давления. Он обладает чрезвычайно высокой растворимостью в воде: в одном объёме воды растворяется около 1200 объёмов аммиака при 0 °С, а при +20 °С – 700 объёмов. Разбавленные растворы аммиака (3–10%) называются нашатырным спиртом, концентрированные растворы (18,5–25%) – аммиачной водой.
При работе с аммиаком надо помнить, что даже незначительное содержание его приводит к раздражению слизистой оболочки носа, горла и т. д.
ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА
Рассмотрим химические свойства аммиака с позиций окислительно-восстановительных и кислотно-основных взаимодействий.
В молекуле аммиака азот находится в низшей степени окисления (–3), поэтому за счёт азота аммиак обладает только восстановительными свойствами.
Если пропустить ток аммиака по трубке, вставленной в другую широкую трубку, по которой проходит кислород, то аммиак можно зажечь; он горит бледным зеленоватым пламенем. При горении аммиака образуется свободный азот:
В присутствии катализатора (сплав Pt и Rh) NH3 окисляется кислородом с образованием NO:
Этот процесс является одной из стадий промышленного получения азотной кислоты.
Аммиаком можно восстановить некоторые неактивные металлы или металлы средней активности из их оксидов:
В кислотно-основных взаимодействиях аммиак проявляет основные свойства. Он взаимодействует с кислотами с образованием солей аммония:
При растворении аммиака в воде устанавливается следующая совокупность равновесных состояний:
Поэтому водные растворы аммиака имеют щелочную реакцию.
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АММИАКА
Промышленным способом получения аммиака является его синтез из азота и водорода:
Сырьём является азот, полученный перегонкой жидкого воздуха, и водород, чаще всего получаемый разложением природного газа. Оптимальные условия проведения реакции: t° ≈ 500 °С, р ≈ 1000 атм, катализатор – губчатое железо с добавками (промоторами) К2O, Al2O3. В таких условиях выход аммиака составляет около 50%.
Лабораторным способом получения аммиака является взаимодействие солей аммония со щелочами при нагревании:
Эта реакция также является качественной реакцией на ион аммония. Её признак – появление запаха аммиака.
Образовавшийся аммиак хорошо растворяется в воде. Для получения аммиака в лаборатории лучше брать сульфат аммония и гидроксид кальция, тогда образующийся сульфат кальция связывает воду, образуется гипс – CaSO4 • 2H2O. Иногда вместо щёлочи используется натронная известь – смесь СаО и NaOH. Реакцию ведут при нагревании:
(NH4)2SO4 + Са(ОН)2 = CaSO4 + 2NH3↑ + 2H2O
Аммиак применяется для получения азотной кислоты HNO3, мочевины (H2N–СО–NH2) – ценного удобрения, для получения соды (Na2CO3) по аммиачному методу, для аминирования органических веществ. Жидкий аммиак и его водные растворы используются как жидкие удобрения. Аммиак применяется как хладагент в холодильниках (NH3 легко сжижается, а затем испаряется с поглощением большого количества теплоты). В медицине используется 10%-й раствор – нашатырный спирт.
СОЛИ АММОНИЯ
Соли аммония, как и другие соли, являются ионными соединениями, образованными катионами аммония NH4 + и анионами кислотных остатков. По многим свойствам соли аммония похожи на соли натрия и калия. При обычных условиях это твёрдые кристаллические вещества, бесцветные, если анион кислотного остатка не обусловливает какую–либо окраску.
Соли аммония разлагаются при нагревании. Состав продуктов реакции термического разложения зависит от природы кислотного остатка (аниона):
а) если соль аммония образована летучей кислотой и её анион не является сильным окислителем, то такая соль полностью разлагается с образованием соответствующих газов:
б) если в состав соли аммония входит анион, обладающий окислительной способностью, то при нагревании происходит окислительно–восстановительная реакция. Так, при нагревании нитрата или нитрита аммония происходит конпропорционирование (в результате степени окисления азота «сходятся»):
А нагревание дихромата аммония приводит к образованию оксида хрома(III), эту реакцию часто используют для имитации «вулканчика»:
Соли аммонию реагируют со щелочами с образованием аммиака:
Данную реакцию можно рассматривать как качественную на наличие ионов аммония. При нагревании аммиак улетучивается за счёт уменьшения его растворимости. Это легко определяется по характерному запаху аммиака и по окрашиванию влажной лакмусовой бумаги в синий цвет.
Конспект урока «Аммиак. Соли аммония».
С чем реагируют соли аммония
§ 25. Соли аммония
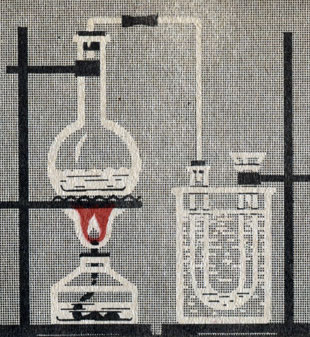
Рис. 13. Образование нитрата аммония
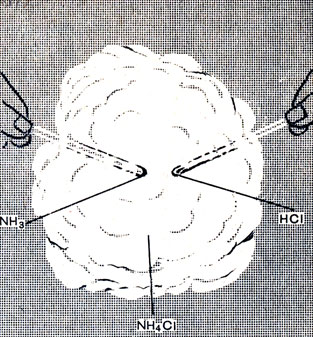
Рис. 14. Образование дыма хлорида аммония
Аммиак соединяется с кислотами с образованием солей
Поэтому соли аммония должны вступать в реакции обмена с другими солями. Так, приливая к раствору хлорида аммония раствор нитрата серебра, мы получаем осадок хлорида серебра, а в растворе нитрат аммония:
Нитрат аммония можно выделить в виде кристаллов, если отфильтровать хлорид серебра и выпарить раствор.
Ионы аммония при реакциях обмена между солями не разрушаются, а переходят без изменения в состав судной из вновь образующихся солей. Таким образом, в реакциях, не сопровождающихся разрушением аммонийного иона, соли аммония ведут себя так же, как и все другие соли.
Со щелочами соли аммония взаимодействуют иначе, чем другие соли. При приливании к раствору любой соли аммония (или твердой соли) раствора щелочи должна была бы получиться гидроокись аммония. Например:
Поэтому при взаимодействии солей аммония со щелочами получается новая соль, аммиак и вода:
Учитывая только частицы, подвергнувшиеся изменению, реакцию можно выразить следующим ионным уравнением:
Полученное уравнение выражает следующее общее свойство аммонийных солей: все соли аммония разлагаются щелочами с выделением аммиака.
Свойство солей аммония отщеплять при действии на них щелочей аммиак используется для получения аммиака в лаборатории. Это же свойство используют для распознавания солей аммония. В пробирку с испытуемой солью или ее раствором приливают раствор щелочи и смесь подогреваю. По запаху или по посинению смоченной водой красной лакмусовой бумажки, которую подносят к отверстию пробирки, заключают, происходит ли выделение аммиака. Если аммиак выделяется, то, значит, в растворе соли содержались ионы аммония.
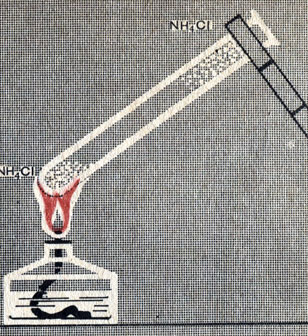
Рис. 15. Возгонка хлорида аммония
Аммиак и хлористый водород улетучиваются, а соприкасаясь с холодными стенками пробирки, снова соединяются: