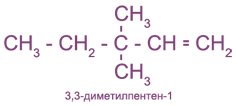
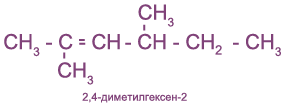
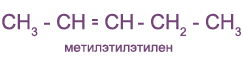
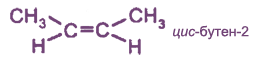
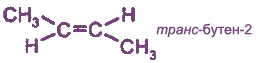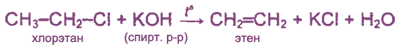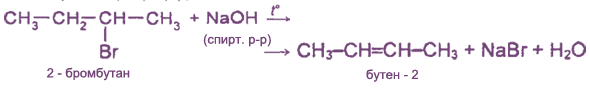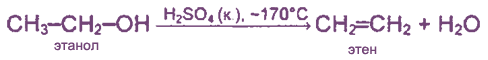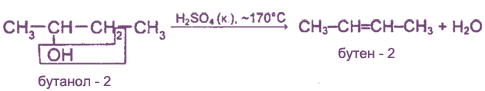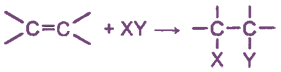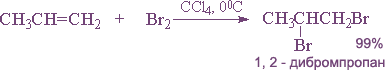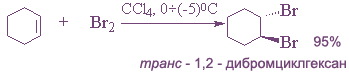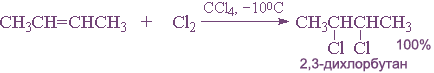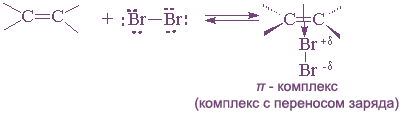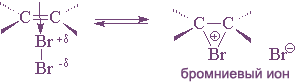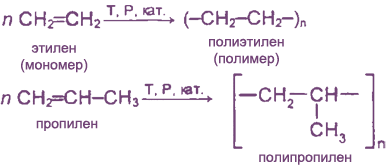с чем реагируют непредельные углеводороды
Предельные и непредельные углеводороды: классификация в таблице
Все многообразие химических веществ делится на два мира: органический и неорганический. Если неорганических соединений насчитывается чуть более ста тысяч, то органических больше трех миллионов. Они делятся на предельные и непредельные углеводороды (таблица четко это показывает). Чтобы использовать и изучать органические вещества, необходимо знать, какому соединению присущи какие свойства. Поэтому очень важно, чтобы классификация этих веществ была точной и могла отразить все многообразие различных соединений.
Классификация углеводородов
В зависимости от строения молекулы углеводороды могут быть циклическими и ациклическими. Циклические углеводороды представлены замкнутыми углеродными цепями. Строение же ациклических представлено линией.
Ациклические углеводороды (у/в)
По составу ациклические углеводороды делят на предельные, которые максимально насыщены водородом, и непредельные, в их состав входят двойные или тройные связи, которые легко разорвать, чтобы провести реакцию присоединения. Непредельные углеводороды, в свою очередь, делятся на классы по своей структурной формуле (наличие одной двойной (пи) связи — алкен, одной тройной — алкин, двух пи связей — алкадиен).
Органические соединения называют в определенном порядке:
Алканы (парафины)
Физические свойства алканов
Алкены (одна двойная связь)
Физические свойства алкенов:
С₂-С₄-жидкости; С₅-С₁₄-твердые, С₁₅-Сn-твердые.
При условии, что в реакцию вступает алкен-1, в кислой среде образуются кислота и углекислый газ, в щелочной — кислота и гидрокарбонат калия, в нейтральной — двухосновный спирт.
Алкины (одна тройная связь)
Физические свойства алкинов:
Химические свойства алкинов:
Алкадиены (две двойные связи):
Физические признаки алкадиенов:
Циклические углеводороды
По составу циклические углеводороды могут быть предельными, то есть максимально насыщенными водородом, или непредельными и содержать двойные связи. Насыщенные углеводороды — это циклоалканы, а вещества, имеющие в своем составе двойные связи, — арены.
| Число атомов углерода | Циклоалканы | Арены |
| 3 | С₃Н₆-циклопропан | нет |
| 4 | С₄Н₈-циклобутан | нет |
| 5 | С₅Н₁₀-циклопентан | нет |
| 6 | С₆Н12-циклогексан | с6н6-бензол |
| Общая формула | СnH2n | СnH2n-6 |
Циклоалканы (предельные)
Арены (ароматические углеводороды)
Жидкости с ярко выраженными запахами.
На основе сравнительной характеристики углеводородов можно понять, что вещества относятся к классам по принципу схожести признаков (физических и химических свойств, способов получения и особенностей строения).
Предельные и непредельные углеводороды

Всего получено оценок: 627.
Всего получено оценок: 627.
Соединения, содержащие только атомы углерода и водорода, классифицируются на предельные и непредельные углеводороды. Каждая группа включает несколько классов веществ, которые отличаются строением и свойствами.
Определения
Предельные углеводороды отличаются от непредельных одинарными связями. Атомы углерода в предельных углеводородах соединены простыми одинарными связями. При этом все дополнительные связи атомов углерода заняты водородами. Поэтому предельные углеводороды вступают в реакции присоединения и замещения только под действием катализаторов или высокой температуры.
Непредельные углеводороды содержат двойные или тройные связи и могут присоединять дополнительные атомы к местам разрыва кратных связей, превращаясь в предельные углеводороды.
Физические и химические свойства углеводородов меняются в зависимости от строения молекулы и количества углеродов в цепи.
К предельным или насыщенным углеводородам относятся алканы и циклоалканы. К непредельным или ненасыщенным углеводородам относятся алкены, алкины, алкадиены.
Сравнительная таблица
В сводной таблице предельных и непредельных углеводородов отображены основные характеристики классов.
Класс
Общая формула
Строение
Гомологи
Изомерия
Линейные молекулы, содержащие одинарные связи
Структурная по углеродному скелету. В некоторых случаях возможна оптическая
Циклические молекулы, содержащие одинарные связи
Структурная углеродного скелета, межклассовая, пространственная
Включают одну двойную связь (СН2=СН2)
Структурная по углеродному скелету и положению двойной связи, межклассовая с циклоалканами, пространственная
Содержат две двойные связи (СН2=С=СН2)
Структурная углеродного скелета, положения двойных связей, межклассовая с алкинами, пространственная
Содержат одну тройную связь (CH≡CH)
Структурная по углеродному скелету, положению тройной связи, межклассовая
Класс аренов (ароматических углеводородов) выделяется в отдельную группу. Арены содержат бензольное кольцо и отличаются химическими свойствами от насыщенных и ненасыщенных углеводородов.
Что мы узнали?
Предельные (насыщенные) и непредельные (ненасыщенные) углеводороды – две группы веществ, включающие отдельные классы, которые отличаются строением и свойствами. К предельным углеводородам относятся линейные алканы и циклические циклоалканы. К непредельным углеводородам относятся алкены с одной двойной связью, алкадиены с двумя двойными связями и алкины с одной тройной связью. Между классами возможна межклассовая изомерия: между алкенами и циклоалканами, между алкинами и алкадиенами.
Номенклатура
Алкены простого строения часто называют, заменяя суффикс
Иногда используют и рациональные названия. В этом случае все алкеновые углеводороды рассматривают как замещенные этилена:
Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре:
Изомерия
Для алкенов характерны два вида структурной изомерии. Кроме изомерии, связанной со строением углеродного скелета (как у алканов), появляется изомерия, зависящая от положения двойной связи в цепи. Это приводит к увеличению числа изомеров в ряду алкенов.
Изомерия положения кратной связи
Такая изомерия характерна для соединений с двойной связью.
Цис- и транс-изомеры отличаются не только пространственным строением, но и многими физическими и химическими свойствами. Транс-изомеры более устойчивы, чем цис-изомеры.
Получение алкенов
В природе алкены встречаются редко. Обычно газообразные алкены (этилен, пропилен, бутилены) выделяют из газов нефтепереработки (при крекинге) или попутных газов, а также из газов коксования угля.
В промышленности алкены получают
дегидрированием алканов в присутствии катализатора (Сr2О3).
Дегидрирование алканов
Из лабораторных способов получения
можно отметить следующие:
1. Отщепление галогеноводорода от галогеналкилов
при действии на них спиртового раствора щелочи:
2. Гидрирование ацетилена
в присутствии катализатора (Pd):
3. Дегидратация спиртов (отщепление воды).
В качестве катализатора используют кислоты (серную или фосфорную) или Аl2O3:
водород отщепляется от наименее гидрогенизированного (с наименьшим числом водородных атомов) углеродною атома (правило А.М.Зайцева):
Физические свойства
Физические свойства некоторых алкенов
Алкены малополярны, но легко поляризуются.
Химические свойства
Алкены обладают значительной реакционной способностью. Их химические свойства определяются, главным образом, двойной углерод-углеродной связью.
π-Связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента. Это можно представить в виде схемы:
Таким образом, при реакциях присоединения двойная связь разрывается как бы наполовину (с сохранением σ-связи).
Для алкенов, кроме присоединения, характерны еще реакции окисления и полимеризации.
Реакции присоединения
Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения.
1. Гидрирование (присоединение водорода).
2. Галогенирование (присоединение галогенов).
Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных:
Легче идет присоединение хлора и брома, труднее — иода. Фтор с алкенами, как и с алканами, взаимодействует со взрывом.
Реакцию галогенирования обычно проводят в растворителе при обычной температуре.
Присоединение брома и хлора к алкенам происходит по ионному, а не по радикальному механизму. Этот вывод следует из того, что скорость присоединения галогена не зависит от облучения, присутствия кислорода и других реагентов, инициирующих или ингибирующих радикальные процессы. На основании большого числа экспериментальных данных для этой реакции был предложен механизм, включающий несколько последовательных стадий. На первой стадии происходит поляризация молекулы галогена под действием электронов π-связи. Атом галогена, приобретающий некоторый дробный положительный заряд, образует с электронами π-связи нестабильный интермедиат, называемый π-комплексом или комплексом с переносом заряда. Следует отметить, что в π-комплексе галоген не образует направленной связи с каким-нибудь конкретным атомом углерода; в этом комплексе просто реализуется донорно-акцепторное взаимодействие электронной пары π-связи как донора и галогена как акцептора.
Результат этой реакции нетрудно предвидеть: анион брома атакует карбкатион с образованием дибромэтана.
Быстрое обесцвечивание раствора брома в СCl4 служит одним из простейших тестов на ненасыщенность, поскольку и алкены, и алкины, и диены быстро реагируют с бромом.
3. Гидрогалогенирование (присоединение галогеноводородов).
Алкены легко присоединяют галогенводороды:
при обычных условиях водород галогенводорода присоединяется по месту двойной связи к наиболее гидрогенизированному атому углерода, а галоген — к менее гидрогенизированному:
Правило Марковникова можно объяснить тем, что у несимметричных алкенов (например, в пропилене) электронная плотность распределена неравномерно. Под влиянием метильной группы, связанной непосредственно с двойной связью, происходит смещение электронной плотности в сторону этой связи (на крайний углеродный атом).
Такое присоединение является следствием взаимного влияния атомов в органической молекуле. Как известно, электроотрицательность атома углерода немного выше, чем водорода.
Поэтому в метильной группе наблюдается некоторая поляризация σ-связей С-Н, связанная со смещением электронной плотности от водородных атомов к углероду. В свою очередь это вызывает повышение электронной плотности в области двойной связи и особенно на ее крайнем, атоме. Таким образом, метильная группа, как и другие алкильные группы, выступает в качестве донора электронов. Однако в присутствии пероксидных соединений или О2 (когда реакция имеет радикальный характер) эта реакция может идти и против правила Марковникова.
По тем же причинам правило Марковникова соблюдается при присоединении к несимметричным алкенам не только галогеноводородов, но и других электрофильных реагентов (H2O, H2SО4, НОСl, ICl и др.).
4. Гидратация (присоединение воды).
В присутствии катализаторов [H2SO4 (конц.) и др.] к алкенам присоединяется вода с образованием спиртов. Например:
Реакции окисления
Алкены окисляются легче, чем алканы. Продукты, образованные при окислении алкенов, и их строение зависят от строения алкенов и от условий проведения этой реакции.
2. Неполное каталитическое окисление
3. Окисление при обычной температуре.
Эта реакция является качественной: фиолетовая окраска раствора перманганата калия изменяется при добавлении к нему непредельного соединения.
В более жестких условиях (окисление КМnO4 в присутствии серной кислоты или хромовой смесью) в алкене происходит разрыв двойной связи с образованием кислородсодержащих продуктов:
Реакция изомеризации
Реакции полимеризации
За счет разрыва π-связей молекулы алкена могут соединяться друг с другом, образуя длинные цепные молекулы.
Нахождение в природе и физиологическая роль алкенов
Низшие алкены в высоких концентрациях обладают наркотическим эффектом. Высшие члены ряда также вызывают судороги и раздражение слизистых оболочек дыхательных путей
Отдельные представители
Этилен является ведущим продуктом основного органического синтеза и применяется для получения полиэтилена (1-е место, до 60 % всего объёма).
Устойчив к действию воды, не реагирует с щелочами любой концентрации, с растворами нейтральных, кислых и основных солей, органическими и неорганическими кислотами, даже концентрированной серной кислоты, но разлагается при действии 50%-ой азотной кислоты при комнатной температуре и под воздействием жидкого и газообразного хлора и фтора. Со временем, происходит термостарение.
— Полиэтиленовая плёнка (особенно упаковочных, например, пузырчатая упаковка или скотч ).
— Полиэтиленовый порошок используется как термоклей.
— вызывает наркоз, обладает раздражающим действием.
Урок №61. Непредельные (ненасыщенные) углеводороды
АЛКЕНЫ
Углеводородами ряда этилена, или этиленовыми углеводородами ( олефинами или алкенами ) называют ненасыщенные углеводороды, строение которых отличается наличием в их молекулах одной двойной связи между углеродными атомами
Этиленовые углеводороды образуют гомологический ряд, состав каждого члена которого выражается общей эмпирической формулой
C n H 2n
Гомологический ряд алкенов
Структурная формула этилена
Физические свойства алкенов
С 5 – С 18 (жидкости)
Алкены не растворяются в воде, растворимы в органических растворителях (бензин, бензол и др.)
С увеличением Mr температуры плавления и кипения увеличиваются
Реакции присоединения алкенов
Химические свойства алкенов
Как и предельные углеводороды, алкены горят на воздухе :
Применение алкенов
Этилен является одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек синтеза.
Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.
АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ
Ацетиленовыми углеводородами ( алкинами ) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу
C n H 2n-2
Родоначальником гомологического ряда этих углеводородов является ацетилен
H-C≡C-H
Физические свойства
С 2 Н 2 – газ без цвета и почти без запаха, легче воздуха, мало растворим в воде
Получение в лаборатории
Из карбида кальция гидролизом ( взаимодействие с водой )
CaC 2 + 2H 2 O → Ca(OH) 2 + H-C≡C-H
Получение в промышленности
Термическим разложением метана (пиролиз)
2CH 4 1500˚С → HC≡CH + 3H 2
Применение
Из всех ацетиленовых углеводородов большое промышленное значение имеет ацетилен, который является важнейшим химическим сырьём.
При горении ацетилена выделяется много тепла, что используется для резки и сварки металлов в ацетилен-кислородной сварке (расходуется до 30 % всего производимого ацетилена).
для газовой сварки и резки металлов,
как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды ( см. карбидная лампа ),
для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
для получения технического углерода,
в атомно-абсорбционной спектрофотометрии при пламенной атомизации,
в начале XX века широкое распространение имели автомобильные ацетиленовые фары, которые только в 1920-е были вытеснены электрическими.
В конце 19-го — начале 20-го века широкой популярностью пользовались многочисленные ацетиленовые светильники ( источником ацетилена служил дешевый карбид кальция ), используемые на железнодорожном и водном транспорте, для освещения улиц, в быту. Несмотря на то, что сегодня массовое использование ацетиленовых фонарей ушло в прошлое, их выпуск и потребление не прекратились. Они производятся в небольших количествах как походное снаряжение.
ДИЕНЫ
Общая формула алкадиенов
C n H 2n-2
Наибольший интерес представляют углеводороды с сопряженными двойными связями, их используют для производства синтетических каучуков.
Наиболее массовое применение каучуков — это производство резин для автомобильных, авиационных и велосипедных шин.
Из каучуков изготавливаются специальные резины огромного разнообразия уплотнений для целей тепло- звуко- воздухо- гидроизоляции разъёмных элементов зданий, в санитарной и вентиляционной технике, в гидравлической, пневматической и вакуумной технике.
Каучуки применяют для электроизоляции, производства медицинских приборов.
ЦИКЛОАЛКАНЫ (ЦИКЛОПАРАФИНЫ)
В отличие от предельных углеводородов, характеризующихся наличием открытых углеродных цепей, существуют углеводороды с замкнутыми цепями (циклами). По своим свойствам они напоминают обычные предельные углеводороды алканы (парафины), отсюда и произошло их название – циклоалканы (циклопарафины).
Общая формула гомологического ряда циклоалканов
C n H 2n
Циклоалканы изомерны этиленовым углеводородам. В природе встречаются в составе нефти.
Представителями этого ряда соединений являются циклопропан, циклопентан, циклогексан.
Наибольшее практическое значение имеют циклогексан, этилциклогексан. Циклогексан используется в химическом синтезе, а также в качестве растворителя. Циклопропан используется в медицинской практике в качестве ингаляционного анестезирующего средства.
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ)
Типичными представителями ароматических углеводородов являются производные бензола, т.е. такие карбоциклические соединения, в молекулах которых имеется особая циклическая группировка из шести атомов углерода, называемая бензольным или ароматическим ядром.
Общая формула ароматических углеводородов
С 6 H 5 – CH 3 – толуол (метилбензол)
С 6 H 5 – CH=СH 2 – стирол (винилбензол)
Физические свойства :
1. Бензол – легкокипящая (t кип = 80,1°С), бесцветная жидкость, не растворяется в воде
3. Большинство ароматических углеводородов опасны для жизни, токсичны.
Применение
Ароматические углеводороды являются важным сырьем для производства различных синтетических материалов, красителей, физиологически активных веществ. Так, бензол – продукт для получения красителей, медикаментов, средств защиты растений и др. Толуол используется как сырье в производстве взрывчатых веществ, фармацевтических препаратов, а также в качестве растворителя. Винилбензол (стирол) применяется для получения полимерного материала – полистирола.
Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
Содержание:
Углеводороды – это органические соединения, которые состоят из углерода и водорода (иногда замещается на группы). Существует огромное количество углеводородов и для них существует множество классификаций.
По составу углеродного скелета делятся на:
По наличию кратных связей и открытости цепи:
Предельные углеводороды
Химические свойства алканов
I. Реакции замещения
Эти реакции сопровождаются гомолитическим разрывом, который начинается в неорганических молекулах.
Реакции замещения являются основным типом реакций, которые характерны для молекул алканов. В связи с высокой энергией ионизации в молекуле алканов очень насыщенные связи, из –за чего химическое взаимодействие затруднено. Общим для реакций замещения являются жесткость условий и наличие сильных окислителей.
Идет под воздействием света.
Замещение водорода проходит у наименее гидрированного атома углерода.
1888 год – Коновалов открыл реакцию взаимодействия алканов с азотной кислотой (13-14 %) под воздействием температуры в 140°С. Она используется для производства ракетного топлива и взрывчатых веществ.
Эту реакцию используют при мыловарении и в производстве синтетических моющих средств.
II. Реакции с разрывом углерод-углеродной связи
Энергия связи «углерод-углерод» высокая, поэтому она достаточно прочная. Реакций, сопровождающихся разрывом этой связи, немного и все они проходят в жестких условиях.
При нормальных условиях алканы не реагируют с сильными окислителями, такими как серная кислота, перманганат или дихромат калия.
Алканы горят бесцветным или голубоватым пламенем. У метана, этана, пропана, бутана и пентана копоть не наблюдается, а у соединений с длинными углеродными цепями она есть.
Идет в присутствии катализатора.
Это химический процесс, протекающий при действии высоких температур. В результате углеродная цепь рвется, и образуются молекулы алкана и алкена.
Крекинг бывает: термическим; каталитическим.
Для каталитической реакции используются катализаторы и меньшие температуры.
III. Реакции с разрывом углерод-водородной связи
Алканы – это вещества, с помощью которых можно получить соединения с кратными связями.
Отщепление водорода осуществляется в присутствии катализаторов и при высоких температурах.
При дегидрировании алканов с длинными углеродными цепями образуются алкены.
Нагревание линейных алканов с катализатором провоцирует образование веществ с разветвленным углеродным скелетом.
Из алканов получают топливо, которое широко используют в микробиологии, биотехнологиях, органическом синтезе.
Химические и физические свойства циклоалканов
Циклоалканы (нафтены) – это насыщенные циклические углеводороды. Циклоалканы по физическим свойствам схожи с линейными алканами. Циклопропан и циклобутан – это газы, а начиная с циклопентана – жидкости с температурой кипения и плотностью выше, чем у соответствующих парафинов. Не растворяются в воде, но растворимы в эфирах.
I. Реакции присоединения
Реакционная способность зависит от размера цикла. Низшие циклоалканы напоминают алкены, а высшие – алканы.
Действие галогена различно в зависимости от условий.
Реакция протекает в водном растворе.
В случае несимметричных молекулах соблюдается правило Марковникова.
Реакция проходит при высоких температурах и под действием таких катализаторов как никель, платина.
II. Дегидрирование
Высокие температуры (500°С) по-разному действуют на малые и большие циклы.
III. Горение
Устойчивость к окислителям повышается по гомологическому ряду.
Циклоалканы содержатся в нефтяных продуктах, и вырабатывается некоторыми видами растений. В природе они способны подвергаться микробиологическому окислению.
Непредельные углеводороды
Химические и физические свойства алкенов
Алкены (этиленовые углеводороды) – органические соединения, содержащие одну двойную связь. Температура плавления и кипения увеличивается по гомологическому ряду. При нормальных условиях с этена по бутен – газы, с пентена по гептадецен – жидкости, а далее твердые вещества. Они не растворяются в воде, но растворимы в эфирах.
π- связь менее прочная, чем σ-связь. Это связано с тем, что у негибридных облаков глубина перекрывания меньше. Для алкенов наиболее характерны реакции присоединения. Кроме того, алкены – это доноры электронов и их рассматривают как основания Льюиса.
I. Реакции присоединения
Электроны π-связи находятся вне плоскости, поэтому они более доступны для атакующей электрофильной частицы.
Реакция протекает под воздействием температуры и катализатора никеля.
Реакционная способность уменьшается в ряду HJ-HBr-HCl-HF. В этих реакциях действует правило Марковникова. Он утверждал, что при взаимодействии галогеноводородов или воды с несимметричными алкенами, водород присоединяется к более гидрированному атому углерода, а галоген – к менее.
Правило имеет несколько исключений.
Реакция подразумевает присоединение бромоводорода в присутствии перекиси водорода.
Спирты образуются при присоединении алкенов с водой в присутствии серной кислоты, высоких температурах и при оксиде алюминия.
II. Реакции полимеризации
Полимер – это соединение, состоящее из множества мономеров. Полимеризация не приводит к изменению качественного и количественного состава мономеров. Получение полиэтилена из этена имеет цепной или ступенчатый характер.
III. Реакции замещения (галогенирование)
IV. Окисление
Идет легко и образует разные продукты в зависимости от условий.
Алкены горят желтым светящимся пламенем.
Осуществляется в нейтральной среде при окислении с помощью перманганата калия. В результате образуются диолы, причем гидроксильные группы присоединяются к атомам углерода кратной связи.
Проходит в кислой среде. При окислении с помощью кипящего раствора перманганата калия происходит полное разрушение кратной связи, и атомы углероды способны создать карбоновую кислоту или углекислый газ.
В симметричной молекуле алкена образуется две молекулы одной и той же кислоты.
Если в соединении при кратной связи содержится два углеродных заместителя, то при окислении происходит образование кетона.
Жесткое окисление проходит и в щелочной среде.
Те же реакции проходят в присутствии дихромата калия.
Алкены – это исходный продукт в производстве полимеров и других органических веществ.
Химические и физические свойства диенов
Алкадиены – это органические соединения, имеющие две двойные связи. Существует несколько видов диенов:
В нормальных условиях пропадиен и бутадиен-1,3 являются газами, а изопрен – летучей жидкостью. Алкадиены с изолированными связями – жидкости. Высшие диены находятся в твердом состоянии.
I. Реакции присоединения
У кумулированых и изолированных сначала взаимодействует с реагентом одна связь, а затем другая. А у сопряженных кратные связи образуют единую систему в центре молекулы, при этом параллельно идет процесс присоединения.
CH2=CH-CH=CH2 + Br2 → Br-CH2-CH=CH-CH2-Br С помощью этой реакции обесцвечивание бромная вода.
Реакция идет при нагревании в 60°С.
II. Полимеризация
В процессе этих реакций образуются эластомеры (синтетические каучуки). Проводится в присутствии натрия.
Алкадиены могут обесцвечивать раствор перманганата калия.
Из диенов получают каучуки, из которых производят резину различных марок.
Химические и физические свойства алкинов
I. Реакции присоединения
В процессе реакции присоединение происходит сначала по одной π-связи, а затем по другой. Идут по механизмам электрофильного и нуклеофильного присоединения.
Электрофильное присоединение
Идет под действием катализатора никеля.
CH≡CH + Cl2 → Cl-CH=CH-Cl
Cl-CH=CH-Cl + Cl2 → Cl-CH(Cl)-CH(Cl)-Cl
Вышеперечисленные реакции могут подразумевать как присоединение одной молекулы, так и нескольких. В гидратации возможно присоединение только одной молекулы воды. Реакция Кучерова проходит при температуре в 70°С и катализатора в виде сульфата ртути.
Нуклеофильное присоединение
Проходит в присутствии меди в аммиачном растворе.
II. Полимеризация
Протекает в присутствии солей меди и повышенных температурах.
Протекает в присутствии активированного углерода и температурах свыше 500°С. 3
III. Реакции замещения
Замещение происходи у водорода, стоящего при углероде с кратной связью.
Получающиеся соединения взрывоопасны. Чтобы их нейтрализовать, необходимо залить их соляной кислотой.
IV. Окисление
Этин горит с большим выделением тепла.
3 CH≡CH + 8 KMnO4 → 3 KOOC-COOK + 8MnO2 + 2 KOH + 2 H2O
В кислой среде окислитель расщепляет кратную связь с образованием карбоновых кислот.
Только ацетилен используется в промышленности, и именно он является важным химическим сырьем.
Ароматические углеводороды
Химические и физические свойства бензола
Наличие ароматического кольца влияет на характер химических реакций. Единая 6π-система электронов устойчива, поэтому ароматическим углеводородам характерны реакции электрофильного замещения.
Бензол – это бесцветная жидкость, имеющая резкий запах. Горит сильно коптящим пламенем. Образует с воздухом взрывчатые смеси.
I. Реакции замещения
Все эти реакции протекают по механизму бимолекулярного нуклеофильного замещения.
II. Реакции присоединения
Протекают только в жестких условиях. Присоединяться способны только богатые энергией реагенты.
Идет под воздействием температуры и катализаторов в виде платины.
При нормальных условиях азотная кислота, хромовая кислота и др. не могут окислить бензол. Он окисляется только в жестких условиях под действием кислорода, катализатора оксида ванадия и при температуре в 450°С.
Химические и физические свойства гомологов бензола
У гомологов бензола такие же физические свойства, что и у самого бензола. Во многом и химические свойства схожи.
I. Электрофильное замещение Радикалы гомологов бензола повышают электронную плотность на кольце в орто- и параположениях.
Катализатор – хлорид алюминия.
II. Реакции по боковой цепи
Осуществляется в присутствии света. Принцип замещения схож с реакцией алканов.
В отличие от бензола его гомологи способны вступать в реакции окисления.
Окисление дизамещенных гомологов происходит по такому же принципу.
Реакция проходит под действием оксида цинка.
Химические и физические свойства стирола
Стирол – это бесцветная жидкость, имеющая резкий запах. Плохо растворяется в воде, но хорошо в органических растворителях.
I. Реакции присоединения
Стирол обесцвечивает бромную воду. Реакция идет не по бензольному кольцу, а по виниловой группе.
II. Полимеризация
В ходе реакции образуется полистирол – твердая стекловидная масса.
При производстве полимеров активно используется стирол. На его основе создаются полистирол, пенопласт, пластики.