с чем реагирует оксид фосфора 5 реагирует
Оксид фосфора (V): получение и свойства
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
Химические свойства
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
Еще пример : оксид фосфора взаимодействует с оксидом бария (при сплавлении):
С чем реагирует оксид фосфора 5 реагирует
Физические свойства: Оксид фосфора (V) Р2О5 — белый гигроскопичный порошок (поглощает воду), следует хранить в плотно закрытых сосудах.
Получение: Получается при горении фосфора в избытке воздуха или кислорода
Применение: Оксид фосфора (V) очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
Химические свойства: Оксид фосфора (V) – это кислотный оксид, взаимодействует, подобно другим кислотным оксидам с водой, основными оксидами и основаниями.
Фосфорный ангидрид особым образом взаимодействует с водой, взаимодействуя с водой при обычных условиях (без нагревания), образует в первую очередь метафосфорную кислоту НРО3:
при нагревании образуется ортофосфорная кислота H3PO4:
Свойства кислотного оксида
Типичный кислотный оксид:
Наибольшее практическое значение имеет ортофосфорная кислота Н3РO4.
Строение молекулы: В молекуле фосфорной кислоты атомы водорода соединены с атомами кислорода:
Физические свойства: Фосфорная кислота представляет собой бесцветное, гигроскопичное твердое вещество, хорошо растворимое в воде.
1) Взаимодействие оксида фосфора ( V ) с водой при нагревании:
2) Взаимодействие природной соли – ортофосфата кальция с серной кислотой при нагревании:
3) При взаимодействии фосфора с концентрированной азотной кислотой
Свойства, общие с другими кислотами
1. Водный раствор кислоты изменяет окраску индикаторов на красный:
Ортофосфорная кислота диссоциирует ступенчато:
если кислота в избытке, то образуется кислая соль:
5. Реагирует с аммиаком (по донорно-акцепторному механизму), если в избытке кислота, образуются кислые соли:
6. Реагирует с солями слабых кислот:
Специфические свойства ортофосфорной кислоты
1. При нагревании ортофосфорная кислота постепенно превращается в метафосфорную кислоту:
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуетсяжёлтый осадок:
3. Играет большую роль в жизнедеятельности животных и растений. Её остатки входят в состав АТФ. При разложении АТФ выделяется большое количество энергии, что очень важно для живых организмов.
Применение ортофосфорной кислоты:
А также, используется при пайке, для очищения от ржавчины металлических поверхностей. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество. Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
Оксид фосфора (V), свойства, получение, химические реакции
Оксид фосфора (V), свойства, получение, химические реакции.
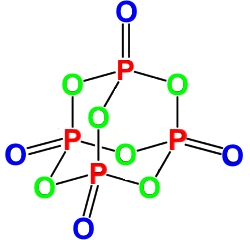
Оксид фосфора (V) – неорганическое вещество, имеет химическую формулу P4O10 и P2O5.
Краткая характеристика оксида фосфора (V). Формула оксида фосфора (V) :
Оксид фосфора (V) – неорганическое вещество белого цвета.
Оксид фосфора (V) содержит четыре атома фосфора и десять атомов кислорода.
Химическая формула оксида фосфора (V) P4O10 и P2O5. Для простоты записи используют последнюю формулу.
В воде не растворяется, а взаимодействует с ней, образуя кислоты.
Модификации оксида фосфора (V):
Твердый оксид фосфора (V) склонен к полиморфизму. Существуют три формы-модификации оксида фосфора (V): H, O`, O и G формы-модификации.
| гексагональная H-форма | орторомбическая O`-форма | орторомбическая O-форма | G-форма | |
| Состояние вещества | Кристаллический вид | Кристаллический | Кристаллический вид | Стекловидный вид |
| Характер стабильности формы | Метастабильная форма | Стабильная форма | Метастабильная форма | |
| Другие характеристики | a=0,744 нм, угол = 87°, пространственная группа R3C | a=1,63 нм, b=0,814 нм, c=0,526 нм, пространственная группа Fdd2 | a=0,923 нм, b = 0,718 нм, c = 0,494 нм, пространственная группа Pnam |
H-форма переходит в O-форму при 300-360 °C (процесс заканчивается при 378 °C).
Химические свойства оксида фосфора 5 и его применение
Оксид фосфора (V) — что это такое
Оксид фосфора (V) является кислотным оксидом. Представляет собой кристаллическое вещество белого цвета молекулярного строения.
Химическая формула оксида фосфора (V):
P 4 O 10 и P 2 O 5
Структурные модификации оксида фосфора (V):
Характеристика модификаций оксида фосфора (V) с разным строением:
Химические и физические свойства
Список физических свойств оксида фосфора (V):
Оксид фосфора (V) относят к группе кислотных оксидов неметаллов. К примеру, оксид кремния (IV) и оксид серы (VI) также являются кислотными оксидами.
Взаимодействие оксида фосфора (V) с белым фосфором можно описать с помощью уравнения:
3 P 4 O 10 + 2 P 4 → 5 P 4 O 6 ( t = 50 ° C )
Результатом реакции является образование оксида фосфора (III).
При соединении оксида фосфора (V) с натрием образуются соли метафосфат натрия N a P O 3 и фосфид натрия N a 3 P :
Химическая реакция оксида фосфора (V) и лития приводит к образованию солей в виде метафосфата лития L i P O 3 и фосфида лития L i 3 P :
При контакте оксида фосфора (V) со фтором образуются оксид-трифторид фосфора(V) и кислород:
P 4 O 10 + 6 F 2 → 4 P O F 3 + 3 O 2 ( t = 100 ° C )
Химическая реакция оксида фосфора (V) и воды протекает таким образом:
P 4 O 10 + 6 H 2 O → 4 H 3 P O 4 или P 2 O 5 + 3 H 2 O → 2 H 3 P O 4
P 4 O 10 + 2 H 2 O → 4 H P O 3 или P 2 O 5 + H 2 O → 2 H P O 3
Взаимодействие оксида фосфора (V) с оксидом кальция приводит к образованию солей:
C a O + P 2 O 5 → C a ( P O 3 ) 2
2 C a O + P 2 O 5 → C a 2 P 2 O 7
3 C a O + P 2 O 5 → C a 3 ( P O 4 ) 2 ( t ° )
Взаимодействие оксида фосфора (V) с оксидом натрия приводит к образованию соли в виде ортофосфата натрия:
3 N a 2 O + P 2 O 5 → 2 N a 3 P O 4
Реакция оксида фосфора (V) и оксида бора является процессом образования фосфата бора:
2 B 2 O 3 + P 4 O 10 → 4 B P O 4 ( t ° )
В процессе реакции оксида фосфора (V) и гидроксида натрия образуются соль ортофосфат натрия и вода:
P 4 O 10 + 12 N a O H → 4 N a 3 P O 4 + 6 H 2 O или P 2 O 5 + 6 N a O H → 2 N a 3 P O 4 + 3 H 2 O
Оксид фосфора (V) вступает в реакцию с плавиковой кислотой, что приводит к образованию оксида-трифторида фосфора и метафосфорной кислоты:
Оксид фосфора (V) реагирует с бромоводородом, что в результате позволяет получить оксид-трибромид фосфора и метафосфорную кислоту:
P 4 O 10 + 3 H B r → P O B r 3 + 3 H P O 3 ( t = 200 ° C )
Взаимодействие оксида фосфора (V) с азотной кислотой с образованием оксида азота и метафосфорной кислоты:
4 H N O 3 + P 4 O 10 → 2 N 2 O 5 + 4 H P O 3 или 2 H N O 3 + P 2 O 5 → N 2 O 5 + 2 H P O 3 ( t = – 10 ° C )
Оксид фосфора (V) взаимодействует с ортофосфорной кислотой, что сопровождается образованием дифосфорной (пирофосфорной) кислоты:
Взаимодействие оксида фосфора (V) и пероксида водорода с образованием дипероксодиоксофосфата водорода и воды:
P 4 O 10 + 8 H 2 O 2 → 4 H 3 P O 2 ( O 2 ) 2 + 2 H 2 O ( t = – 20 ° C )
В процессе реакции оксида фосфора (V) с амидами они превращаются в нитрилы. При взаимодействии вещества со спиртами, эфирами, фенолами, другими органическими соединениями образуются фосфорорганические соединения.
Получение и использование оксида фосфора (V)
Практическое применение полученного в результате данной химической реакции оксида фосфора (V) заключается в его использовании для осушения газообразных и жидких веществ, в органическом синтезе (как водоотнимающее средство). Соединение активно используют в производстве такой продукции, как:
Другим соединением фосфора является фосфин. Вещество представляет собой ядовитый газ c неприятным запахом, самовоспламеняющийся на воздухе. Фосфин является продуктом разложения органических веществ.
Оксид фосфора P2O5(V)
Фосфор является очень «плодовитым» элементом, образуя много разнообразных оксидов и кислот.
Самым устойчивым является оксид фосфора P2O5(V), который называется фосфорным ангидридом.
Физические свойства фосфорного ангидрида:
В узлах кристаллической модификации расположены, соединенные попарно, молекулы P2O5.
Химические свойства P2O5(V)
Фосфорный ангидрид является типичным кислотным оксидом, активно взаимодействует с водой, с образованием фосфорных кислот:
P2O5+H2O = 2HPO3 (метафосфорная к-та)
P2O5+2H2O = H4P2O7 (пирофосфорная к-та)
P2O5+3H2O = 2H3PO4 (ортофосфорная к-та)
В реакциях со щелочами кислотный оксид P2O5(V) образует, как средние, так и кислые соли, в зависимости от соотношения реагентов:
P2O5+4NaOH = 2Na2HPO4+H2O
P2O5+2NaOH+H2O = 2NaH2PO4
Поскольку фосфорный ангидрид является водоотнимающим средством, он применяется для получения других оксидов из их кислот:
P2O5+2HNO3 = 2HPO3+N2O5
Несмотря на то, что в фосфорном ангидриде фосфор имеет максимально возможную степень окисления (+5), оксид фосфора P2O5(V) не обладает выраженными окислительными свойствами, что объясняется тем, что +5 является крайне неустойчивой степенью окисления для фосфора.
Получают P2O5(V) при горении фосфора в избытке кислорода:
4P+5O2 = 2P2O5
Выше уже было сказано, что фосфорный ангидрид является хорошим водопоглотителем, что позволяет его использовать в качестве осушителя разнообразных веществ (в эксикаторах), при проведении реакций дегидратации и проч.
Оксид фосфора P2O3(III)
P2O3(III) реагирует с основаниями и основными оксидами с образованием фосфитов (солей фосфористой кислоты):
P2O3+4NaOH = 2Na2HPO3+H2O
Получают оксид фосфора P2O3(III) окислением фосфора при недостатке кислорода:
4P+3O2 = 2P2O3
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе