с чем не взаимодействует цинк
Цинк. Химия цинка и его соединений
Положение в периодической системе химических элементов
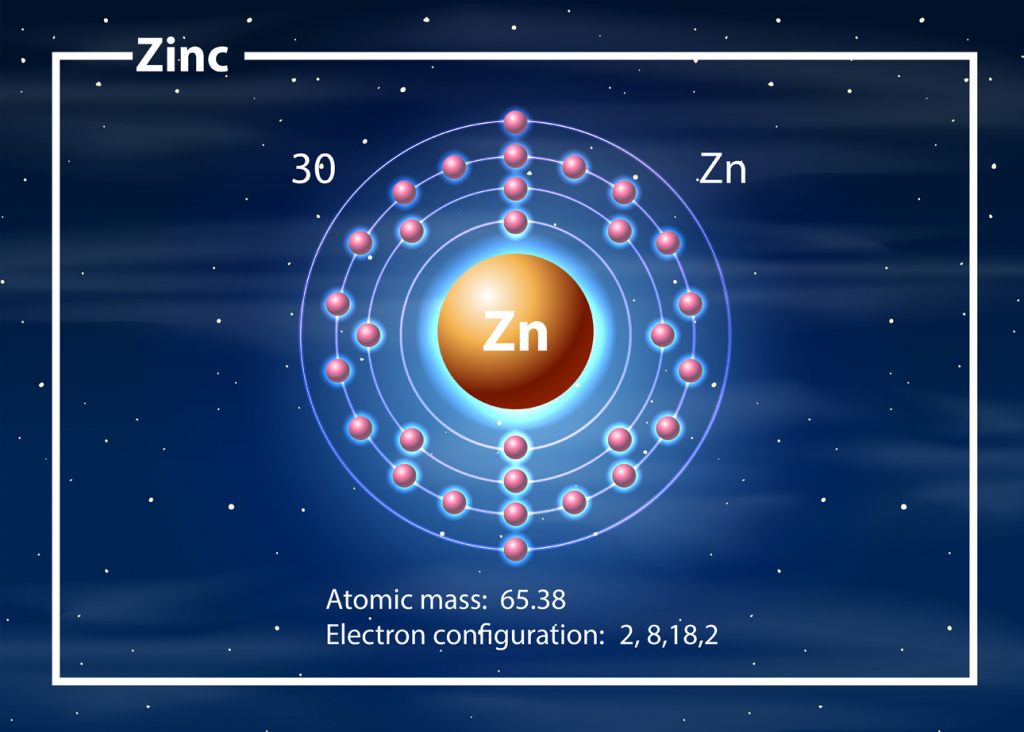
Цинк расположены в побочной подгруппе II группы (или в 12 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение цинка и свойства
Электронная конфигурация цинка в основном состоянии :
+30Zn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2
3s 

Характерная степень окисления цинка в соединениях +2.
Физические свойства
Цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (быстро тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Нахождение в природе
Цинк играет важную роль в процессах, протекающих в живых организмах.
В природе цинк как самородный металл не встречается.
Способы получения
Цинк получают из сульфидной руды. На первом этапе руду обогащают, повышая концентрацию сульфидов металлов. Сульфид цинка обжигают в печи кипящего слоя:
2ZnS + 3O2 → 2ZnO + 2SO2
Чистый цинк из оксида получают двумя способами.
ZnO + С → Zn + CO
Далее цинк очищают от примесей.
При это получаемый раствор сульфата цинка очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу.
При электролизе чистый цинк осаждается на алюминиевых катодах, с которых его удаляют и подвергают плавлению в индукционных печах. Таким образом можно получить цинк с высокой чистотой (до 99,95 %).
Качественные реакции
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид цинка растворяется с образованием комплексной соли тетрагидроксоцинката:
Химические свойства
1.1. Цинк реагируют с галогенами с образованием галогенидов:
Реакция цинка с иодом при добавлении воды:
1.2. Цинк реагирует с серой с образованием сульфидов:
Zn + S → ZnS
1.4. С азотом цинк непосредственно не реагирует.
1.5. Цинк непосредственно не реагирует с водородом, углеродом, кремнием и бором.
1.6. Цинк взаимодействует с кислородом с образованием оксида:
2Zn + O2 → 2ZnO
2. Цинк взаимодействует со сложными веществами:
2.1. Цинк реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn 0 + H2 + O → Zn +2 O + H2 0
2.2. Цинк взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой и др.). При этом образуются соль и водород.
Zn + 2HCl → ZnCl2 + H2↑
Демонстрация количества выделения водорода при реакции цинка с кислотой:
Цинк реагирует с разбавленной серной кислотой:
Порошковый цинк реагирует с концентрированной серной кислотой с образованием сероводорода, сульфата цинка и воды:
2.5. Цинк – амфотерный металл, он взаимодействует с щелочами. При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Цинк реагирует с расплавом щелочи с образованием цинката и водорода:
В отличие от алюминия, цинк растворяется и в водном растворе аммиака:
Zn + CuO → Cu + ZnO
Еще пример : цинк восстанавливает медь из раствора сульфата меди (II):
CuSO4 + Zn = ZnSO4 + Cu
И свинец из раствора нитрата свинца (II):
Восстановительные свойства цинка также проявляются при взаимодействии его с сильными окислителями: нитратами и сульфитами в щелочной среде, перманганатами, соединениями хрома (VI):
Оксид цинка
Способы получения
Оксид цинка можно получить различными методами :
1. Окислением цинка кислородом:
2Zn + O2 → 2ZnO
2. Разложением гидроксида цинка при нагревании:
3. Оксид цинка можно получить разложением нитрата цинка :
Химические свойства
1. При взаимодействии оксида цинка с основными оксидами образуются соли-цинкаты.
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката:
3. Оксид цинка не взаимодействует с водой.
ZnO + H2O ≠
5. Оксид цинка взаимодействует с растворимыми кислотами с образованием солей.
ZnO + 2HCl = ZnCl2 + H2O
ZnO + С(кокс) → Zn + СО
ZnO + СО → Zn + СО2
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Гидроксид цинка
Способы получения
1. Гидроксид цинка можно получить пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоцинката натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить исходное вещество Na2[Zn(OH)4] на составные части: NaOH и Zn(OH)2. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Zn(OH)2 не реагирует с СО2, то мы записываем справа Zn(OH)2 без изменения.
2. Гидроксид цинка можно получить действием недостатка щелочи на избыток соли цинка.
Химические свойства
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксоцинката:
4. Г идроксид цинка разлагается при нагревании :
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
Z nS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
Упражнения типа «мысленный эксперимент» по химии цинка (тренажер задания 32 ЕГЭ по химии)
Цинк — общая характеристика элемента, химические свойства цинка и его соединений

Цинк – химически активный металл, обладает выраженными восстановительными свойствами, по активности уступает щелочно-земельным металлам. Проявляет амфотерные свойства.
Взаимодействие цинка с неметаллами
При сильном нагревании на воздухе сгорает ярким голубоватым пламенем с образованием оксида цинка:
2Zn + O2 → 2ZnO.
При поджигании энергично реагирует с серой:
Zn + S → ZnS.
С галогенами реагирует при обычных условиях в присутствии паров воды в качестве катализатора:
Zn + Cl2 → ZnCl2.
При действии паров фосфора на цинк образуются фосфиды:
Zn + 2P → ZnP2 или 3Zn + 2P → Zn3P2.
С водородом, азотом, бором, кремнием, углеродом цинк не взаимодействует.
Взаимодействие цинка с водой
Реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn + H2O → ZnO + H2.
Взаимодействие цинка с кислотами
В электрохимическом ряду напряжений металлов цинк находится до водорода и вытесняет его из неокисляющих кислот:
Zn + 2HCl → ZnCl2 + H2;
Zn + H2SO4 → ZnSO4 + H2.
Взаимодействует с разбавленной азотной кислотой, образуя нитрат цинка и нитрат аммония:
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O.
Реагирует с концентрированными серной и азотной кислотами с образованием соли цинка и продуктов восстановления кислот:
Zn + 2H2SO4 → ZnSO4 + SO2 + 2H2O;
Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
Взаимодействие цинка со щелочами
Реагирует с растворами щелочей с образованием гидроксокомплексов:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
при сплавлении образует цинкаты:
Zn + 2KOH → K2ZnO2 + H2.
Взаимодействие с аммиаком
С газообразным аммиаком при 550–600°С образует нитрид цинка:
3Zn + 2NH3 → Zn3N2 + 3H2;
растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка:
Zn + 4NH3 + 2H2O → [Zn(NH3)4](OH)2 + H2.
Взаимодействие цинка с оксидами и солями
Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов:
Zn + CuSO4 → Cu + ZnSO4;
Zn + CuO → Cu + ZnO.
С водой не взаимодействует. Проявляет амфотерные свойства, реагирует с растворами кислот и щелочей:
ZnO + 2HCl → ZnCl2 + H2O;
ZnO + 2NaOH + H2O → Na2[Zn(OH)4].
При сплавлении с оксидами металлов образует цинкаты:
ZnO + CoO → CoZnO2.
При взаимодействии с оксидами неметаллов образует соли, где является катионом:
2ZnO + SiO2 → Zn2SiO4,
ZnO + B2O3 → Zn(BO2)2.
Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах:
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O;
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4];
также легко растворяется в водном растворе аммиака с образованием гидроксида тетраамминцинка:
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2.
Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl.
Свойства цинка и его взаимодействие с другими веществами
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Цинк относят к металлам, он обладает всеми их свойствами. Ему присущи блеск, твердость, пластичность, теплопроводность, электропроводность. Однако в определенных условиях цинк может проявлять свойства неметалла.
Характеристики цинка

Цинк имеет приятный серебристо-голубой цвет. В обычных температурных условиях он гибкий, иногда ломкий. Металл используют для того, чтобы раскатывать его в листы. Через некоторое время на листах возникает оксидный тонкий слой, поэтому цинк перестает взаимодействовать с воздухом. Со временем он начинает немного мутнеть, терять блеск.
В таблице Менделеева химический элемент стоит под 30-м номером. Относится к группе переходных металлов. Обозначается элемент как Zn.
Где содержится цинк?
В 18 веке Уильяму Чемпиону удалось получить чистый цинк. До этого его использовали вместе с медью, называя конечный продукт соединения латунью.
Большое количество цинка содержится в земной коре. Для промышленных целей цинк добывается из термальных источников.
Роль цинка в жизни растений и животных очень велика. Это важный биогенный элемент.
Взаимодействие цинка с водой
Если вода нагрета до высоких температур, то при взаимодействии с ней цинка выделается оксид цинка.
Взаимодействие цинка с кислотами
Конечный продукт реакции цинка с кислотой будет зависеть от двух факторов. Значение имеют вид кислоты, которая участвует в реакции, а также ее концентрация. Обычно, вступая в реакцию с кислотами, цинк вытесняет из них водород.
Технический цинк легко растворяется в кислотах, так как в нем содержатся примеси других активных металлов. Если речь идет о чистом цинке, то он практически не поддается воздействию кислот. Для ускорения реакции в раствор добавляют медь или медные соли.
Взаимодействие цинка со щелочами
Если в реакции участвует щелочь, доведенная до высоких температур, то образуются гидроцинкаты.
Внимание! В сильной щелочной среде цинк начинает демонстрировать свойства восстановителя.
Где применяют цинк?
Цинк активно применяется в современной жизни:
Внимание! В организме цинк играет важную роль, так как поддерживает гомеостаз. Также он отвечает за формирование первичных половых признаков, поддерживает в норме обменные процессы.
Данный металл активно вступает во взаимодействие с кислородом, водой, кислотами и щелочами, водородом, используется в различных сферах человеческой жизни.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Химические свойства цинка и его соединений
Цинк является типичным представителем группы металлических элементов и обладает всем спектром их характеристик: металлическим блеском, пластичностью, электро- и теплопроводностью. Однако химические свойства цинка несколько отличаются от основных реакций, присущих большинству металлов. Элемент при определенных условиях может вести себя как неметалл, например, реагировать со щелочами. Такое явление называется амфотерностью. В нашей статье мы изучим физические свойства цинка, а также рассмотрим типичные реакции, характерные для металла и его соединений.
Положение элемента в периодической системе и распространение в природе
Металл располагается в побочной подгруппе второй группы периодической системы. В нее, кроме цинка, входят кадмий и ртуть. Цинк относится к d-элементам и находится в четвертом периоде. В химических реакциях его атомы всегда отдают электроны последнего энергетического уровня, поэтому в таких соединениях элемента, как оксид, средние соли и гидроксид, металл проявляет степень окисления +2. Строением атома объясняются все физико-химические свойства цинка и его соединений. Общее содержание металла в почве составляет примерно 0,01вес. %. Он входит в состав минералов, например, таких как галмей и цинковая обманка. Так как содержание цинка в них невысокое, сначала горные породы подвергаются обогащению, которое проводится в шахтных печах. Большинство цинксодержащих минералов представляют собой сульфиды, карбонаты и сульфаты. Это соли цинка, химические свойства которых лежат в основе процессов их переработки, например, таких как обжиг.
Получение металла
Реакция жесткого окисления карбоната или сульфида цинка приводит к получениюего оксида. Процесс происходит в кипящем слое. Это специальный метод, основанный на тесном контакте мелкоизмельченного минерала и струи горячего воздуха, движущейся с большой скоростью. Далее оксид цинка ZnO восстанавливают коксом и удаляют образовавшиеся пары металла из сферы реакции. Еще один способ получения металла, основанный на химических свойствах цинка и его соединений – это электролиз раствора сульфата цинка. Он представляет собой окислительно-восстановительную реакцию, проходящую под действием электрического тока. Металл высокой чистоты при этом осаждается на электроде.
Физическая характеристика
Голубовато-серебристый, при обычных условиях хрупкий металл. В интервале температур от 100° до 150° цинк становится гибким и его можно прокатывать в листы. При нагревании выше 200° металл становится необычайно хрупким. Под действием кислорода воздуха куски цинка покрываются тонким слоем оксида, а при дальнейшем окислении он превращается в гидроксокарбонат, который играет роль протектора и препятствует дальнейшему взаимодействию металла с кислородом воздуха. Физические и химические свойства цинка взаимосвязаны. Рассмотрим это на примере взаимодействия металла с водой и кислородом.
Жесткое окисление и реакция с водой
При сильном нагревании на воздухе цинковые стружки сгорают голубым пламенем, при этом образуется оксид цинка.
Он проявляет амфотерные свойства. В парах воды, разогретых до температуры красного каления, металл вытесняет водород из молекул Н2О, кроме этого, образуется оксид цинка. Химические свойства вещества доказывают его способность взаимодействовать как с кислотами, так и со щелочами.
Окислительно-восстановительные реакции с участием цинка
Так как элемент в ряду активности металлов стоит перед водородом, он способен вытеснять его из молекул кислот.
Продукты реакции между цинком и кислотами будут зависеть от двух факторов:
Разбавленная серная кислота, которая не проявляет ярко выраженных окислительных свойств, реагирует с металлом по схеме:
Таким же образом протекают реакции элемента с фосфорной и разбавленной серной кислотами. Химические свойства, реакции цинка с нитратной кислотой имеют свои особенности. Разбавленный раствор азотной кислоты средней концентрации и цинк взаимодействуют между собой с образованием оксида азота (II), воды и средней соли – нитрата цинка. Концентрированная нитратная кислота с металлом реагируют таким образом, что в продуктах можно обнаружить оксид азота (IV), среднюю соль и воду.
Очень разбавленный раствор азотной кислоты и цинк в качестве восстановителя взаимодействуют между собой с образованием нитрата цинка, воды и нескольких возможных продуктов: аммиака, свободного азота или оксида азота (I).
Химические свойства цинка
Сплавляя твердую щелочь и металл, получают соли другого вида – цинкаты. Побочным продуктом такого процесса также будет газообразный водород.
Металл активно взаимодействует с галогенами, например, хлором, бромом или йодом, а также с азотом, серой и углеродом. В результате образуются средние соли – нитриды, сульфиды или карбиды.
В ряду активности металлов цинк располагается до водорода и, следовательно, является активным металлом. Однако он уступает по своим свойствам щелочным и щелочноземельным металлам.
Использование цинка в гальванических элементах
Оксид цинка
Белый пористый порошок, желтеющий при нагревании и возвращающий свой первоначальный цвет при охлаждении – это окись металла. Химические свойства оксида цинка, уравнения реакций его взаимодействия с кислотами и щелочами подтверждают амфотерный характер соединения. Так, вещество не может реагировать с водой, но взаимодействует как с кислотами, так и со щелочами. Продуктами реакций будут средние соли (в случае взаимодействия с кислотами) или комплексные соединения – тетрагидроксоцинкаты.
Оксид цинка применяют в производстве белой краски, которую называют цинковыми белилами. В дерматологии вещество входит в состав мазей, присыпок и паст, оказывающих на кожу противовоспалительное и подсушивающее действие. Большая же часть производимого оксида цинка применяется в качестве наполнителя для резины. Продолжая изучать химические свойства цинка и его соединений, рассмотрим гидроксид Zn(OH)2.
Амфотерный характер гидроксида цинка
Белый осадок, выпадающий под действием щелочи на растворы солей металла – это основание цинка. Соединение быстро растворяется под действием кислот или щелочей. Первый тип реакции заканчивается образованием средних солей, второй – цинкатов. В твердом виде выделены комплексные соли – гидроксоцинкаты. Особенностью гидроксида цинка является его способность растворяться в водном растворе аммиака с образованием гидроксида тетраамминцинка и воды. Основание цинка является слабым электролитом, поэтому как его средние соли, так и цинкаты в водных растворах поддаются гидролизу, то есть их ионы взаимодействуют с водой и образуют молекулы гидроксида цинка. Растворы таких солей металла, как хлорид или нитрат, будут иметь кислую реакцию вследствие накопления избытка ионов водорода.
Характеристика сульфата цинка
Рассмотренные нами ранее химические свойства цинка, в частности, его реакции с разбавленной сульфатной кислотой, подтверждают образование средней соли – сернокислого цинка. Это бесцветные кристаллы, нагревая которые до 600° и выше, можно получить оксосульфаты и трехокись серы. При дальнейшем нагревании сернокислый цинк преобразуется в оксид цинка. Соль растворима в воде и глицерине. Вещество выделяют из раствора при температуре до 39°C в виде кристаллогидрата, формула которого ZnSO4×7H2O. В этом виде его называют цинковым купоросом.
В интервале температур 39°-70° получают шестиводную соль, а выше 70° в составе кристаллогидрата остается только одна молекула воды. Физико-химические свойства сульфата цинка позволяют применять его в качестве отбеливателя при изготовлении бумаги, в виде минерального удобрения в растениеводстве, как подкормку в рационе домашних животных и птицы. В текстильной промышленности соединение используют в производстве вискозной ткани, в окрашивании ситца.
Сернокислый цинк входит также в состав раствора электролита, применяемого в процессе гальванического покрытия слоем цинка железных или стальных изделий диффузным способом или методом горячего оцинкования. Слой цинка в течение длительного времени защищает такие конструкции от коррозии. Учитывая химические свойства цинка, нужно отметить, что в условиях высокой солености воды, значительных колебаний температуры и влажности воздуха оцинкование не дает желаемого эффекта. Поэтому в промышленности нашли широкое применение сплавы металла с медью, магнием и алюминием.
Применение сплавов, содержащих цинк
Для транспортировки многих химических веществ, например, аммиака, по трубопроводам, необходимы особые требования к составу металла, из которого изготовлены трубы. Они изготавливаются на основе сплавов железа с магнием, алюминием и цинком и обладают высокой антикоррозионной устойчивостью к действию агрессивной химической среды. Кроме этого, цинк улучшает механические свойства сплавов и нивелирует вредное влияние таких примесей, как никель и медь. В процессах промышленного электролиза широкое применение получили сплавы меди и цинка. Для транспортировки продуктов нефтепереработки используют танкеры. Они построены из алюминиевых сплавов, содержащих, кроме магния, хрома и марганца, большую долю цинка. Материалы такого состава обладают не только высокими антикоррозионными свойствами и повышенной прочностью, но еще и криогенной стойкостью.
Роль цинка в организме человека
В нашей статье мы изучили химические функции цинка и его соединений, а также определили его роль в жизнедеятельности организма человека.