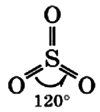
с чем может реагировать so3
С чем реагирует SO3: NO,KOH(p-p),MgCO3,NaCl(тверд), конц H2SO4,Cu И написать их уравнения. Люди пожалуйста помагите
О́леум (лат. Oleum) — раствор серного ангидрида SO3 в 100%-й серной кислоте H2SO4.
Олеум представляет собой вязкую маслянистую бесцветную жидкость или легкоплавкие кристаллы, которые, однако, могут приобретать самые различные оттенки вследствие наличия примесей. На воздухе «дымит», реагирует с водой с выделением очень большого количества тепла. Концентрация серного ангидрида может варьировать в очень широких пределах: от единиц до десятков процентов. Олеум по сравнению с концентрированной серной кислотой обладает ещё большим водоотнимающим и окислительным действием. Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
——————
Получают, окисляя оксид серы (IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5, Pt или NaVO3 или оксид железа (III) Fe2O3):
Можно получить термическим разложением сульфатов:
Fe2(SO_4)3->(t) Fe2O3 + 3SO_3
или взаимодействием SO2 с озоном:
Для окисления SO2 используют также NO2:
Эта реакция лежит в основе исторически первого, нитрозного способа получения серной кислоты.
Химические свойства
1. Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика. При взаимодействии с водой образует серную кислоту:
Однако в данной реакции серная кислота образуется в виде аэрозоля, и поэтому в промышленности оксид серы (VI) растворяют в серной кислоте с образованием олеума, который далее растворяют в воде до образования серной кислоты нужной концентрации.
Взаимодействует с основаниями:
SO3 растворяется в 100%-й серной кислоте, образуя олеум.
‘2’. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается, обычно, до сернистого ангидрида:
2SO3 + 2KI-> SO2 + I2 + K2SO4
3. При взаимодействии с хлороводородом образуется хлорсульфоновая кислота:
Также взаимодействует с двухлористой серой и хлором, образуя тионилхлорид:
Оксиды серы. Серная кислота
Сера с кислородом образует два оксида: SO2 – оксид серы (IV) и SO3 – оксид серы (VI).
Оксид серы (IV) — SO2 (сернистый газ, сернистый ангидрид)
Сернистый газ – это бесцветный газ с резким запахом, ядовит. Тяжелее воздуха более чем в два раза. Хорошо растворяется в воде. При комнатной температуре в одном объёме воды растворяется около 40 объёмов сернистого газа, при этом образуется сернистая кислота H2SO3.
Химические свойства
Сернистый газ – типичный кислотный оксид. Он взаимодействует:
а) с основаниями, образуя два типа солей: кислые (гидросульфиты) и средние (сульфиты):
б) с основными оксидами:
Сернистая кислота существуют только в растворе, относится к двухосновным кислотам. Сернистая кислота обладает всеми общими свойствами кислот.
Окислительно – восстановительные свойства
В окислительно-восстановительных процессах сернистый газ может быть как окислителем, так и восстановителем, потому что атом серы в этом соединении имеет промежуточную степень окисления +4.
Как окислитель SO2 реагирует с более сильными восстановителями, например с сероводородом:
Как восстановитель SO2 реагирует с более сильными окислителями, например с кислородом в присутствии катализатора, с хлором и т.д.:
Получение
1) Сернистый газ образуется при горении серы:
2) В промышленности его получают при обжиге пирита:
3) В лаборатории сернистый газ можно получить:
а) при действии кислот на сульфиты:
б) при взаимодействии концентрированной серной кислоты с тяжелыми металлами:
Применение
Сернистый газ находит широкое применение в текстильной промышленности для отбеливания различных изделий. Кроме того, его используют в сельском хозяйстве для уничтожения вредных микроорганизмов в теплицах и погребах. В больших количествах SO2 идет на получение серной кислоты.
Оксид серы (VI) – SO3 (серный ангидрид)
Серный ангидрид SO3 – это бесцветная жидкость, которая при температуре ниже 17 о С превращается в белую кристаллическую массу. Очень хорошо поглощает влагу (гигроскопичен).
Химические свойства
Как типичный кислотный оксид серный ангидрид взаимодействует:
а) с основаниями, образуя два типа солей – кислые (гидросульфиты) и средние (сульфаты):
Особым свойством SO3 является его способность хорошо растворяться в серной кислоте. Раствор SO3 в серной кислоте имеет название олеум.
Оксид серы (VI) характеризуется сильными окислительными свойствами (обычно восстанавливается до SO2):
Получение и применение
Серный ангидрид образуется при окислении сернистого газа:
В чистом виде серный ангидрид практического значения не имеет. Он получается как промежуточный продукт при производстве серной кислоты.
Серная кислота H2SO4
Упоминания о серной кислоте впервые встречаются у арабских и европейских алхимиков. Ее получали, прокаливая на воздухе железный купорос (FeSO4∙7H2O): 2FeSO4 = Fe2O3 + SO3↑ + SO2↑ либо смесь серы с селитрой: 6KNO3 + 5S = 3K2SO4 + 2SO3↑ + 3N2↑, а выделяющиеся пары серного ангидрида конденсировали. Поглощая влагу, они превращались в олеум. В зависимости от способа приготовления H2SO4 называли купоросным маслом или серным маслом. В 1595 г. алхимик Андреас Либавий установил тождественность обоих веществ.
Долгое время купоросное масло не находило широкого применения. Интерес к нему сильно возрос после того, как в XVIII в. был открыт процесс получения из индиго индигокармина – устойчивого синего красителя. Первую фабрику по производству серной кислоты основали недалеко от Лондона в 1736 г. Процесс осуществляли в свинцовых камерах, на дно которых наливали воду. В верхней части камеры сжигали расплавленную смесь селитры с серой, затем туда запускали воздух. Процедуру повторяли до тех пор, пока на дне ёмкости не образовывалась кислота требуемой концентрации.
В XIX в. способ усовершенствовали: вместо селитры стали использовать азотную кислоту (она при разложении в камере даёт NO2). Чтобы возвращать в систему нитрозные газы были сконструированы специальные башни, которые и дали название всему процессу – башенный процесс. Заводы, работающие по башенному методу, существуют и в наше время.

Серная кислота – это тяжелая маслянистая жидкость без цвета и запаха, гигроскопична; хорошо растворяется в воде. При растворении концентрированной серной кислоты в воде выделяется большое количество тепла, поэтому ее надо осторожно приливать в воду (а не наоборот!) и перемешивать раствор.
Раствор серной кислоты в воде с содержанием H2SO4 менее 70% обычно называют разбавленной серной кислотой, а раствор более 70% — концентрированной серной кислотой.
Химические свойства
Разбавленная серная кислота проявляет все характерные свойства сильных кислот. Она реагирует:
Процесс взаимодействия ионов Ва 2+ с сульфат-ионами SO4 2+ приводит к образованию белого нерастворимого осадка BaSO4. Это качественная реакция на сульфат-ион.
Окислительно – восстановительные свойства
В разбавленной серной кислоте растворяются металлы, которые в электрохимическом ряду напряжений находятся до водорода. При этом образуются сульфаты металлов и выделяется водород:
Металлы, которые в электрохимическом ряду напряжений находятся после водорода, не реагируют с разбавленной серной кислотой:
Концентрированная серная кислота является сильным окислителем, особенно при нагревании. Она окисляет многие металлы, неметаллы и некоторые органические вещества.
При взаимодействии концентрированной серной кислоты с металлами, которые в электрохимическом ряду напряжений находятся после водорода (Cu, Ag, Hg), образуются сульфаты металлов, а также продукт восстановления серной кислоты – SO2.

Более активными металлами (Zn, Al, Mg) концентрированная серная кислота может восстанавливаться до свободной серы или сероводорода. Например, при взаимодействии серной кислоты с цинком, магнием, алюминием в зависимости от концентрации кислоты одновременно могут образовываться различные продукты восстановления серной кислоты – SO2, S, H2S:
На холоде концентрированная серная кислота пассивирует некоторые металлы, например алюминий и железо, поэтому ее перевозят в железных цистернах:
Концентрированная серная кислота окисляет некоторые неметаллы (серу, углерод и др.), восстанавливаясь до оксида серы (IV) SO2:
Получение и применение

В промышленности серную кислоту получают контактным способом. Процесс получения происходит в три стадии:
Полученный олеум перевозят в железных цистернах. Из олеума получают серную кислоту нужной концентрации, приливая его в воду. Это можно выразить схемой:
Серная кислота находит разнообразное применение в самых различных областях народного хозяйства. Ее используют для осушки газов, в производстве других кислот, для получения удобрений, различных красителей и лекарственных средств.
Соли серной кислоты

Большинство сульфатов хорошо растворимы в воде (малорастворим CaSO4, еще менее PbSO4 и практически нерастворим BaSO4). Некоторые сульфаты, содержащие кристаллизационную воду, называются купоросами:
CuSO4 ∙ 5H2O медный купорос
FeSO4 ∙ 7H2O железный купорос
Соли серной кислоты имеют все общие свойства солей. Особенным является их отношение к нагреванию.
Сульфаты активных металлов (Na, K, Ba) не разлагаются даже при 1000 о С, а других (Cu, Al, Fe) – распадаются при небольшом нагревании на оксид металла и SO3:
Скачать:
Скачать бесплатно реферат на тему: «Производство серной кислоты контактным способом» Производство-серной-кислоты-контактным-способом.docx (237 Загрузок)
Скачать рефераты по другим темам можно здесь
*на изображении записи фотография медного купороса
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Оксид серы (VI) SO3, серный ангидрид
Взаимодействуя с кислородом, сера образует два оксида:
Молекула сернистого газа сильно полярна, угловой формы (угол между связями составляет 119°):
В таком виде молекула серного ангидрида может находиться только в газообразном состоянии.
В жидком и твердом состоянии происходит полимеризация молекул:
Физические свойства серного ангидрида:
Химические свойства серного ангидрида
Оксид серы (VI) является типичным кислотным оксидом:
Серный ангидрид очень хорошо растворяется в серной кислоте, образуя раствор, называемый олеумом:
В кислотно-восстановительных реакциях выступает в роли сильного окислителя, восстанавливаясь до сернистого ангидрида:
Получение и применение серного ангидрида
В промышленных целях серный ангидрид получают путем окисления сернистого газа в присутствии катализатора:
Серный ангидрид используют для получения серной кислоты, а также, в качестве сульфирующего и обезвоживающего реагента.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
С чем может реагировать so3
Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.
Природные соединения
В местах вулканической активности встречаются залежи самородной серы.
В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
Серу можно получить разложением пирита
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
Сера вступает в реакции диспропорционирования с щелочами.
Сера вступает в реакции с солями. Например, в кипящем водном растворе сера может реагировать с сульфитами с образованием тиосульфатов.
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).
Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.
Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
В промышленных условиях сернистый газ получают обжигом пирита.
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Диссоциирует в водном растворе ступенчато.
С сильными восстановителями сернистая кислота принимает роль окислителя.
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
§ 34. Кислородные соединения серы
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 34. Кислородные соединения серы |
| Напечатано:: | Гость |
| Дата: | Воскресенье, 28 Ноябрь 2021, 06:13 |
Оглавление
Сера, проявляя степени окисления +4 и +6, образует два устойчивых оксида состава — оксид серы(IV), или сернистый газ, и — оксид серы(VI).
Оксид серы(IV) — вещество молекулярного строения ( рис. 79 ).
При повышении степени окисления атомы серы «теряют» электроны. Это означает, что оксид проявляет свойства восстановителя, то есть реагирует с окислителями, например с кислородом, хлором. Понижая степень окисления, атомы серы присоединяют электроны, а сернистый газ выступает в роли окислителя. Это происходит при взаимодействии с сильными восстановителями, например, СО, РН3.
Прокомментируем выше сказанное и поясним уравнениями химических реакций.
I. Реакции без изменения степени окисления.
1. Реакция с водой. При пропускании сернистого газа через воду, в которую добавлен лакмус, окраска меняется от фиолетовой до красной — образуется сернистая кислота:
Структурная формула сернистой кислоты изображена на рисунке 81.
Сернистая кислота является слабой. Как двухосновная кислота она диссоциирует ступенчато:
Это также означает, что сернистая кислота образует два ряда солей — средние (сульфиты) и кислые (гидросульфиты).
2. Реакция с растворами щелочей приводит к образованию солей. Состав продуктов зависит от мольного соотношения реагентов:
| 2 : 1 или избыток щёлочи | (сульфит натрия) |
| 1 : 1 или избыток кислотного оксида | (гидросульфит натрия) |
3. С основными оксидами сернистый газ также образует соли:
II. Реакции с изменением степени окисления.
Реакции с окислителями. Взаимодействие с кислородом приводит к образованию оксида серы(VI):
что свидетельствует о восстановительных свойствах оксида серы(IV).
Реакция обратимая, протекает со значительной скоростью лишь при повышенной температуре (более 440 °С ) в присутствии катализаторов (например, V2O5).
Реакции с восстановителями. Примером такой реакции может служить утилизация сернистого газа углеродом. Так получают серу из отходящих газов в металлургической промышленности:
Применение оксида серы(IV). Сернистый газ в промышленных масштабах является промежуточным продуктом при получении серной кислоты. Как пищевая добавка (Е220) он используется в пищевой промышленности в качестве консерванта. Им окуривают хранилища овощей, плодов и фруктов для обеззараживания. Его применяют для отбеливания шёлка и шерсти, так как хлор в данном случае использовать нельзя.
Сернистый газ образуется при сжигании серы и обжиге сульфидов металлов (например, пирита, сульфида цинка).
Оксид серы(IV) в лаборатории получают действием серной кислоты на сульфиты или медь:
Следует отметить, что сернистый газ — один из загрязнителей атмосферы. Его источником являются предприятия чёрной и цветной металлургии, теплоэлектростанции.
Оксид серы(VI) — высший оксид серы ( рис. 82 ).
Оксид серы(VI) образуется при окислении сернистого газа кислородом или озоном:
Химические свойства. — типичный кислотный оксид и сильный окислитель. Как кислотный оксид реагирует с водой, образуя серную кислоту:
В реакциях со щелочами и основными оксидами образует соли:
Особым свойством оксида серы(VI) является его способность растворяться в серной кислоте.
Такой раствор называют олеумом. Он представляет собой дымящую на воздухе бесцветную маслянистую вязкую жидкость или даже кристаллы.
Олеум перевозят в стальных цистернах. Из него разбавлением получают серную кислоту нужной концентрации. При этом первоначально разбавляют серной кислотой, так как при вливании олеума в воду происходит вскипание, в результате чего образуется ядовитый сернокислотный туман.
В составе олеума, помимо серной кислоты, содержатся и другие кислоты серы(VI), например дисерная (или пиросерная):
Как окислитель SO3 реагирует с восстановителями. Атомы серы в составе оксида имеют высшую степень окисления +6 и могут её только понижать, принимая электроны от восстановителей. Примером окислительных свойств оксида серы(VI) может служить реакция с фосфором как восстановителем:
Важнейшими кислородными соединениями серы являются два кислотных оксида — оксид серы(IV), или сернистый газ SO2, и оксид серы(VI) SO3. Как кислотные оксиды они образуют кислоты при взаимодействии с водой и соли в реакциях со щелочами и основными оксидами.
Оксид серы(IV) проявляет и окислительные, и восстановительные свойства, а оксид серы(VI) — только окислительные.
Вопросы, задания, задачи
1. Запишите формулы оксидов серы и соответствующих им кислот, укажите их названия.
2. Назовите области использования сернистого газа.
3. В колбу с дистиллированной водой непродолжительное время пропускали сернистый газ, а затем добавили несколько капель индикатора. Назовите окраску содержимого колбы, если этим индикатором был:
4. Для сернистого газа рассчитайте:
5. Заполните таблицу «Химические свойства оксидов серы» соответствующими уравнениями реакций для реагентов Н2О, КОН, CaO, O2.
| Реагенты | Оксид серы(IV) | Оксид серы(VI) |
Сделайте вывод о сходстве и различии химических свойств указанных оксидов серы.
7. Составьте уравнения реакций согласно схеме, назовите каждое из исходных веществ:
9. Расставьте коэффициенты методом электронного баланса:
Укажите, окислителем или восстановителем является SO2.
1. С наименьшими потерями сернистым газом можно наполнить сосуд:
2. При нормальных условиях оксид серы(VI):
3. Относительно обоих оксидов серы(IV, VI) верно, что:
4. Оксид серы(VI) проявляет свойства кислотного оксида, реагируя с:
5. Сумма коэффициентов в уравнении реакции cернистого газа с избытком гидроксида калия в полной ионной форме равна: