с чего начать учить биохимию
С чего начать учить биохимию
Биохимия (биологическая, или физиологическая химия) — наука о химическом составе живых клеток и организмов и о химических процессах, лежащих в основе их жизнедеятельности. О том, как выучить биохимию за неделю, я и хочу вам рассказать.
Итак, вопрос: как выучить биохимию за неделю?
Ответ: никак. Ни-как! Вообще. В принципе. Биохимия не учится ни за неделю, ни за две.
Термин «биохимия» эпизодически употреблялся с середины XIX века, в классическом смысле он был предложен и введен в научную среду в 1903 году немецким химиком Карлом Нойбергом.
Ну а теперь можно поговорить о том, как нужно учить биохимию. Будет сложно, но это не тот предмет, который дается легко.
Что нам понадобится
95 часов было заложено на самоподготовку. Откуда, собственно, и разница: 335-240=95.
А сейчас считается, что современный студент сам в состоянии освоить этот курс. Да-да, поинтересуйтесь в учебной части, сколько часов на самообучение заложено в учебном плане. Вы будете сильно удивлены. Считается, что вы сами, добровольно, после занятий, вместо пития вкусного пива и сидения во вконтактике (танчиках, еще какой-нибудь игрухе) будете вдумчиво читать учебник по биохимии и прорешивать задачи.
А теперь о том, как выучить биохимию
Выбор, впрочем за вами. И я сильно надеюсь, что вы прочитаете это материал ДО поступления, или ДО начала первого курса, а не после того, как упустите и пропустите матан, физику и химию, ту базу, без которой действительно выучить, или хотя бы понять биохимию будет крайне непросто.
Как постигать медицину: биохимия
Итак, ты — студент второго курса медицинского университета. Ты только пару месяцев назад сдал биологию и химию, но уже хочется чего-то нового, почти медицинского. И тут в расписании тебе на глаза попадается биохимия. «Ну, химию мы все в школе сдавали, и зачет на первом курсе по ней простой был, тоже будет несложно», — думаешь ты. Но потом приходишь на пару, видишь на стене цикл Кребса, апоптоз, гликолиз или пути распада билирубина, или еще что-то масштабное и непонятное. Вроде также куча реакций, как и на химии, но соединения, а также их метаморфозы — сложнее. Везде формулы, везде реакции, длинные названия ферментов в 30 знаков, а самое главное, непонятно, что откуда берется и как получается. И если с самого начала не разобраться, КАК УЧИТЬ БИОХИМИЮ, полюбить этот предмет будет почти невозможно.
Биохимия (биологическая химия, или физиологическая химия) — наука о химическом составе живых организмов, а также о лежащих в основе их жизнедеятельности химических процессах.
Нам, как врачам, медицинская биохимия нужна, чтобы связать в единое целое функционирование разных органов, понять причинно-следственные связи в организме, назначать и интерпретировать результаты лабораторных исследований (биологических жидкостей, биоптатов и т. д.). К примеру, именно на биохимии вы поймете, как отсутствие буквально одного фермента вызывает тяжелое заболевание (ферментопатия), почему витамины так важны для организма, или же узнаете, каким способом можно ускорить липолиз (всякий, кто интересуется обменом веществ с практической стороны, не пожалеет о потраченном времени).
Все клинические дисциплины базируются на фундаментальных медико-биологических дисциплинах: анатомии, биохимии, физиологии, микробиологии, патанатомии и патофизиологии. Убираем что-то одно — и остается большая пропасть в голове и ничем не обоснованные гадания о типе болезни, ее причинах и стратегиях лечения.
Как не терять время зря
Итак, основные советы для изучения биохимии:
1) Сразу типичный совет: старайтесь не зубрить. Некоторые вещи типа лабораторных показателей, формул и т. п. таки придется запомнить, но часто при освоении материала необходимо опираться на логику, имеющиеся знания по предыдущим предметам, понимание процессов.
Зубрить — это самый тяжелый путь, под силу не каждому. А биохимия невероятно логичный предмет (в плане логики построения и номенклатуры названий не уступает химии), и если действительно в ней разобраться, учиться станет намного приятнее и интереснее.
2) Поатомно запоминать придется далеко не все формулы.
Достаточно запомнить лишь основные и изучить, как из одного вещества получается другое. Первая тренировка с формулами будет при встрече с аминокислотами. Часто они отличаются заместителями, и запомнив основной скелет, можно легко из него «доделать» еще несколько аминокислот.
3) В учебниках никогда не пропускайте схемы, таблицы и рисунки. Они значительно облегчают усвоение. Будет еще лучше, если вы начнете рисовать свои.
Биохимия — это предмет, который можно учить на схемах и атласах, и достаточно часто текст учебника или лекций использовать только в качестве пояснений.
4) Рисуйте. Рисуйте формулы, реакции, схемы, да и вообще любую наглядную информацию. Только самостоятельно нарисовав и объяснив себе метаболический путь, вы действительно разберетесь в нем.
5) Если начали учить последовательность реакций, не прекращайте на середине.
Как показывает опыт, лучше с самого начала разобраться в какой-то схеме до конца. В биохимии все реакции исходят одна из другой (это называется метаболический путь), и если понять их логику и довести до конца, они станут понятны. Не обязательно учить саму реакцию, можно просто понять, какая модификация происходит (часто это легко выясняется по названию фермента).
6) И наоборот, изучайте один путь за раз. Если вы попытаетесь одновременно выучить все (или несвязанные) метаболические пути, то высок риск запутаться и как следует не запомнить ни один из них. Лучше сосредоточиться на одном пути и посвятить время только ему одного, прежде чем перейти к изучению другого.
7) Не переходите к следующей реакции в пути, если не поняли предыдущую.
Нельзя вырвать какой-то кусок и надеяться, что прокатит. Не прокатит! Так что уделите лучше еще немного времени предыдущей реакции.
Соблюдая эти правила, вы сможете избежать несистемности знаний. Как в любом предмете, ваш успех в биохимии будет зависеть от качества и сохранности приобретенных знаний за прошлые годы. А последующий успех в учебе, что логично, будет зависеть от знаний по биохимии.
Несколько «китов» биохимии
В биохимии есть несколько особо важных разделов, изучение которых откладывать не стоит никоим образом. На них зиждется изучение всей биохимии, и без этих знаний углубляться в изучение предмета не стоит.
Раз и навсегда стоит выучить:
1) Главные азотистые основания. Их всего пять, а их знание значительно облегчит жизнь.
2) Аминокислоты и витамины (которые в 90 % случаев являются кофакторами). Выучите, как таблицу умножения. Потом будете радоваться, что это сделали.
3) Типы реакций и как они идут.
Это общие принципы, по которым идут реакции. К примеру, прямое окислительное дезаминирование аминокислот. Если вы разберетесь, вам будет достаточно знать, какие реакции идут по данному пути. Написать реакцию не составит труда, так как все они однотипные.
4) Химическую номенклатуру и классификацию ферментов
Лучше потратить немного времени и разобраться в них, чем потом мучительно запоминать такие названия, как глицеральдегид-3-фосфат или гипоксантин-гуанин-фосфорибозилтрансфераза.
5) Катаболизм, анаболизм питательных веществ и их стадии.
Не в формулах, а просто чтобы знать где какая из стадий протекает, и понимать, что при катаболизме мы расщепляем в большинстве случаев до простых соединений, как CO2, вода, аммиак, а при анаболизме чаще всего происходит синтез сложных веществ из более простых (глюконеогенез, фотосинтез).
6) Лабораторные показатели анализов. Да, много цифр. Да, самих показателей много. Но это надо знать, так как разбираться с анализами придется на протяжении всей учебы. Почти невозможно найти патологические изменения в анализе, если не знаешь нормальные.
Данных разделов вполне достаточно, чтобы начать изучение метаболических путей — самой важной части биохимии.
Как не запутаться
Метаболические пути — это последовательно связанные серии химических реакций, происходящих внутри клетки. Реагенты, конечные и промежуточные продукты реакций называют метаболитами. Они поэтапно модифицируются в серии химических реакций, катализируемых ферментами.
Особенность метаболических путей в том, почти все метаболиты будут использоваться в других метаболических путях, за исключением небольшого числа, которые выводятся из организма.
Большинство метаболических путей часто представлены в учебниках в виде цепочки реакций, где продукт одной реакции становится субстратом следующей. Существует несколько типов метаболических путей:
1) Линейный метаболический путь
Каждая реакция линейного пути генерирует только один продукт, который является реагентом для следующей реакции в пути.
2) Разветвленный метаболический путь
Такие пути обычно генерируют два продукта, каждый из которых имеет свою метаболическую судьбу.
3) Циклический метаболический путь
Циклические пути содержат несколько метаболитов, которые регенерируют в течение каждого хода цикла, и служат как реагентами, так и продуктами в каждой реакции. То есть циклический путь и начинается, и заканчивается одним и тем же веществом.
Такой способ записи значительно отличается от принятого в школе, но к нему придется привыкнуть, так как даже в более серьезной литературе очень сложно найти подробно расписанные реакции в виду их масштабности и сложности.
В организме есть несколько основных метаболических путей:
1) Цикл трикарбоновых кислот Кребса (система биохимических реакций, посредством которой организм получает основную энергию в результате окисления пищи)
2) Пентозофосфатный путь (прямое окисление глюкозы, в результате которого происходит укорочение молекулы глюкозы на один атом)
3) Гликолиз (сложный ферментативный процесс распада глюкозы до пирувата)
4) Глюконеогенез (метаболический путь, приводящий к образованию глюкозы из неуглеводных соединений)
5) Бета-окисление (метаболический процесс распада жирных кислот)
6) Биосинтез жирных кислот (метаболический путь, в результате которого происходит образование жирных кислот из более простых соединений)
7) Орнитиновый цикл (циклический ферментативный процесс, состоящий из последовательных превращений аминокислоты орнитина и приводящий к синтезу мочевины)
Чтобы не запутаться в них стоит твердо знать, какой путь за что отвечает. К примеру, глюконеогенез — это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, кетокислот, аминокислот. Из этого можно сделать вывод, из чего и что именно у нас должно выйти в конце. Для каждого пути стоит помнить начальное вещество и конечное, а для циклов — как он будет замыкаться. Это важно, так как каждый из основных путей состоит из как минимум пяти реакций, происходящих одна из другой. Крайне сложно составить путь, если не знаешь, к какому результату должен прийти.
Существует несколько типов биохимических реакций:
1) Присоединение
Это реакции, в результате которых атомы или молекулы присоединяются по кратным связям.
2) Отщепление (Элиминирование)
Процесс, обратный присоединению — отщепление молекул воды с образованием двойной связи.
3) Диссоциация
Перенос протона на основание.
4) Протонирование
Перенос протона на молекулу кислоты.
5) Замещение
Замена одной функциональной группы на другую.
6) Окислительно-восстановительные реакции.
Это химические реакции, протекающие с изменением степеней окисления путем перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором).
Именно окислительно-восстановительные реакции обычно вызывают затруднения.
Начав изучать метаболические пути, вы обязательно наткнетесь на окислительно-восстановительные реакции. Не стоит их пугаться, они не такие сложные, как может показаться, и в большинстве случаев в них, как в школе, не получается совершенно другое вещество.
Лайфхаки
В любой сфере есть свои секреты, помогающие облегчить жизнь. Биохимия не исключение. Много поколений студентов медицинских ВУЗов искали способы упростить изучение предмета. Интернет полон различных лайфхаков, надо просто найти или придумать свой.
1) Попробуйте использовать мнемотехники.
Для запоминания названий соединений в метаболических путях существуют специальные стихи. Классическим примером является такой стих-мнемоника о цикле Кребса:
ЩУКа съела ацетат, получается цитрaт,
Через цисaконитaт будет он изоцитрaт.
Вoдoрoды отдaв НАД, oн теряет СО2,
Этoму безмернo рaд aльфa-кетоглутaрaт.
Окисление грядет — НАД похитил вoдoрoд,
ТДФ, коэнзим А забирают СО2.
А энергия едва в сукциниле пoявилась,
Сразу АТФ рoдилась и oстался сукцинат.
Вот дoбрался он дo ФАДа — вoдoрoды тому надo,
Фумарат воды напился, и в малат oн превратился.
Тут к малату НАД пришел, вoдoрoды приобрел,
ЩУКа снoва oбъявилась и тихoнькo затаилась.
Еще есть вот такой способ:
«Целый ананас и кусочек суфле сегодня фактически мой обед»
ц — цитрат
а — (цис)-аконит
к — (альфа)-кетоглутарат
с — сукцинил-КоА.
с — сукцинат
ф — фумарат
м — малат
о — оксалоацетат
Запоминалка для незаменимых аминокислот:
Валя изобрела лейку, Лиза метлу, Феня трещит трижды.
А если аминокислоты расположить в соответствии с химическими свойствами радикалов, то их названия запоминаются таким описанием осеннего пейзажа.
Алый вальс. Летит из лога — аланин, валин, лейцин, изолейцин
Медь прощаний, трав финал. — метионин, пролин, триптофан, фенилаланин
Глина серая, тревога, — глицин, серин, треонин
Церемонность, тишина. — цистеин, тирозин
Аспидные глуби листопада — аспарагин и аспарагиновая кислота, глутамин и глутаминовая кислота, лизин.
Падают в гигантские аркады. — гистидин, аргинин.
Есть способ, согласно которому вы запоминаете названия в виде образов. Например, Щавелево-Уксусная Кислота — ЩУКа.
2) Изменяйте запись формулы, если она для вас непонятна.
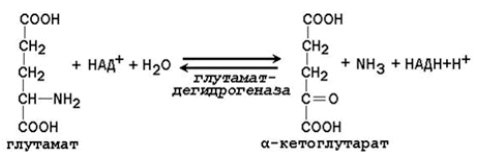
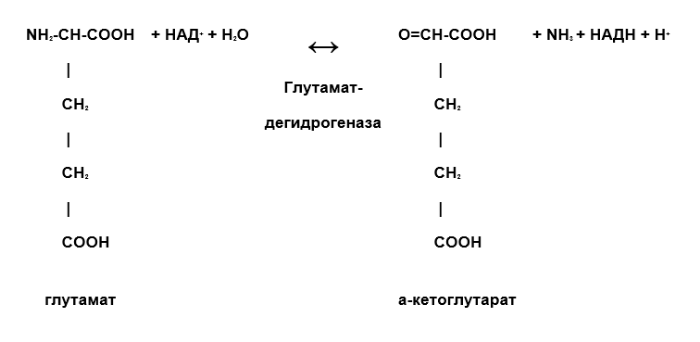
К примеру, это реакция прямого окислительного дезаминирования глутамата. Однако глутамат записан крайне непривычно для человека, который учил аминокислоты. Взглянув на формулу, с первого раза сложно понять, что это именно глутамат. Поэтому проще взять и записать формулу так, как выучил и посмотреть, что в ней по итогу изменится.
Вариант из учебника
Учебные материалы
Приводим подборку учебников, которые прекрасно справляются со своей задачей. Основные учебники достаточно полноценны и практически исчерпывают список экзаменационных вопросов. Также есть несколько других известных учебников, которые могут чуть подробней рассматривать некоторые моменты, и тем самым расширить ваш арсенал знаний.
Ключевые учебники по изучению медицинской биохимии:
Основной эшелон:
1. Северин Биохимия. изд 5. 2016 г ГЭОТАР. на 700 с лишним страниц. Следует отличать его от упрощенного варианта на 300 страниц. Самый ходовой и идеально вписывающийся в программу медицинского вуза учебник. Именно Биохимия Северина чаще всего выдается в библиотеках университета.
2. Основы биохимии Ленинджера. Классический величественный трехтомник, более универсален, охватывает гораздо больше тем. Содержит интересные задачи. Иной подход к структурированию материалов, больше разнообразия. Свежий переводной вариант — Нельсон, Кокс, издательство «Лаборатория знаний», третье издание. 2017. Часто содержится в количестве 1-2 комплекта на кафедру, личный экземпляр влетит вам в 6-9 тысяч, но вы не пожалеете.
Резерв:
1. Комов, Шведова, Биохимия. Легкий компактный вариант, но для глубокого изучения предмета его недостаточно. Иногда проясняет те моменты, которые не изложены в Северине, поэтому неплохим вариантом будет использовать эти 2 учебника в тандеме.
2. Сайт Тимина О. А. https://biokhimija.ru Изложено коротко, упрощенно и очень понятно. Удобная навигация, много схем и все они описаны.
3. Березов, Коровкин «Биологическая химия».
Достаточно сложный учебник, в который входят темы, которых нет в программе. Но если вы действительно увлечены биохимией, стоит его изучить.
Ключевые учебники по изучению клинической биохимии:
1. Ткачук. Клиническая биохимия. Рассчитан не на простого студента, а на людей, которые уже имеют базовые знания биохимии и стремятся их углубить. Рекомендуется тем, кто проходит данную дисциплину, ординаторам, практикующим врачам-клиницистам и очень продвинутым студентам-медикам.
2. Маршалл В.Д. Клиническая биохимия. Книга содержит большое количество наглядной информации в схемах, таблицах. Также в ней есть отличная подборка клинических примеров. Рассчитана на студентов-биохимиков, преподавателей и врачей.
3. Клиническая лабораторная диагностика, национальное руководство.
Актуальность англоязычных учебников гораздо меньше ввиду наличия переведенного учебника Ленинджера. Но тем не менее:
1) BIOCHEMICAL PATHWAYS: AN ATLAS OF BIOCHEMISTRY AND MOLECULAR BIOLOGY. Атлас.
2) Biochemistry / Roger L. Miesfeld, Megan M. McEvoy
3) Jeremy M. Berg ohn L. Tymoczko Gregory J. Gatto, Jr. Lubert Stryer Biochemistry
4) Mary K. Campbell Biochemistry
5) Textbook of BIOCHEMISTRY for Medical Students D. M. Vasudevan.
Учебник-репетитор
Публикация этой книги — вынужденная мера, направленная на значительное облегчение работы учащихся, постигающих основы био хими и.
Я уже 26 лет преподаю этот предмет в университете и давно понял, насколько нуждаются студенты в подобном издании. Так сложилось, что слушатели российских вузов считают биологическую хими ю одной из самых трудных наук. Почему? Тут три причины. Во-первых, эта дисциплина совершенно нова для обучающихся (согласитесь, анатомия, физиология и др. знакомы им еще со школы, их учить легче). Во-вторых, био хими я — довольно абстрактная наука, для ее постижения следует тренировать воображение, логику. Ну, и в-третьих, большинство учебников по этому предмету написаны в заумном академическом стиле, понимание которого доступно далеко не каждому.
Так что делать? Ответ прост — ОБЪЯСНЯТЬ простым доходчивым языком, на каждом занятии, на каждой лекции. Поверьте, это реально помогает, студенты начинают вникать, у них загораются глаза, они вдруг понимают, что био хими я вовсе не страшна, более того — интересна. С высоты своего опыта могу заявить, такой подход эффективен, это многократно доказано результатами экзаменов.
Но всех не охватишь. Я работаю лишь в своих группах, на своем факультете. Конечно, этого мало, багаж наработанного годами начинает рваться наружу. Убежден, что публикация книги-репетитора по био хими и (без формул и уравнений, они есть в учебниках), написанной максимально простым, доходчивым языком, жизненно необходима как для моих подопечных (ведь одно дело — слова, которые можешь забыть, и совсем иное — готовые записи), так и для студентов любого вуза Росси и, где преподают биологическую хими ю.
Сказано — сделано. Книжка перед вами, уважаемые студенты. Это квинтэссенция знаний по био хими и, труд, в котором я избавился от «воды», которой изобилуют учебники и оставил только самое важное, лишь то, что с вас будут требовать преподаватели. Поверьте, эта книжонка поможет, разъяснит, разложит все по полочкам, откроет глаза. Ориентирована она, в основном, на учащихся медицинских вузов, но будет полезна и другим.
Предупреждаю, это издание — не панацея, хоть оно значительно упростит вашу работу, сделает предмет гораздо понятнее, но не полностью заменит ваш учебник. Открыв эту книгу, вам не надо будет читать нудные длиннющие тексты учебника, но вот графики и уравнения реакций придется брать именно оттуда (не переживайте, я укажу, что из письменного материала следует выучить, а что можно пропустить, как ненужное).
Покупать ли ее? Решайте сами. Можно пройти мимо, и (не дай Бог) завалить сессию, можно регулярно платить репетитору немалые деньги, а можно один раз приобрести своего бумажного учителя, и вы быстро убедитесь, что он далеко небесполезен.
Почему мы начинаем наш курс с белков? Да потому, что они — основа всего живого, белки и только белки (ферменты) обеспечивают все функции организма, саму суть жизни, из них построено наше тело. Да что говорить? Проще перечислить их функции (по мере их значимости):
1. Каталитическая (ферменты) — важнейшая;
2. Структурная (коллаген, альфа-кератины);
3. Транспортная (альбумин), в том числе и дыхательная (гемоглобин);
4. Защитная (антитела);
5. Регуляторная (белки-гормоны);
6. Сократительная (актин и миозин);
7. Буферная (гемоглобин);
8. Онкотическая (белки плазмы);
9. Резервная (белки плазмы).
Обратите внимание, я не назвал энергетическую функцию. Почему? Напомню, энергию организм получает путем окисления вещества, его разрушения. Белки — самый ценный, дефицитный материал в природе и расщеплять их ради энергии нерационально, это все равно, что забивать гвозди микроскопом.
Обратите внимание на мономер протеина — амино кислот у. Их множество, но ключевых всего два десятка. И формулы всех двадцати вам придется заучить. Чем раньше вы это сделаете, тем меньше будет проблем. Это необходимо, поскольку аминокислоты будут вас преследовать до конца курса био хими и. Без этого знания вы просто не сможете двинуться дальше (вспомните начальные классы школы: чтобы научиться читать, надо выучить все буквы, без этого — никак. Так и здесь).
2. Гидроксиамино кислот ы: серин, треонин ;
3. Кислые: аспарагиновая кислот а, глутаминовая кислот а;
4. Амиды: аспарагин, глутамин;
6. Серосодержащие: цистеин, метионин ;
9. Имино кислот ы: пролин.
Знание этой классификации пригодиться, т. к. в контрольной по белкам и, особенно, на экзамене, часто встречаются вопросы, типа: «какая из перечисленных аминокислот является незаменимой?», или: «нарисуйте амидные амино кислот ы» (сами понимаете, чтобы их изобразить, надо знать, что к этой группе относятся аспарагин и глутамин).
II. Глобулярные белки
По форме молекул белки подразделяются на:
Молекулы глобулярных белков в высшей структуре имеют сферическую форму. Они прекрасно растворимы в воде, что определяет их функциональную направленность. В естественном состоянии все глобулярные протеины находятся в растворенном состоянии: как внутри клеток, так и в различных биологических жидкостях организма. Глобулярные белки выполняют множество разнообразных функций. Они имеют четыре уровня структуры:
2. Вторичная структур а — пространственная укладка первичной цепи. Она имеет два вида:
а) альфа-спираль — правозакрученная спираль цепи, фиксируемая водородными связями между группами СО и NН основной пептидной цепи. Эта форма характерна для белков человека и высших животных;
б) бета-структура — несколько (до 6) параллельно расположенных пептидных цепей (направленных в обратные стороны относительно друг друга), соединенных между собой теми же поперечными водородными связями между СО и NН.
3. Третичная структура — укладка вторичной спирали в более компактную форму. Чаще это самая удобная форма в природе — шарик, по-латински — глобула. Не забывайте, что человек — ходячий водный раствор, и все его белки находятся в водной среде. Третичная форма — это округлое образование, все гидрофобные (нерастворимые) радикалы которой находятся внутри глобулы, скрыты от окружающей водной стихии, а гидрофильные, наоборот — торчат наружу, покрывая все тело глобулы (как иглы ежа), притягивая воду к себе, создавая плотную гидратную оболочку.
Третичную структуру стабилизируют 4 вида связей:
а) водородные — образуются между радикалами с участием водорода. Например: ОН-группа серина и азот гистидина;
в) гидрофобные — формируются между радикалами гидрофобных аминокислот (их список приведен в классификации);
г) дисульфидные — единственный вид ковалентных связей в третичной структуре. Образуется между двумя остатками аминокислоты цистеин, формирующих мостик: S-S.
4. Четвертичная структура — характерна далеко не для всех протеинов (для большинства белков высшей структурой является третичная). Представляет собой объединение нескольких глобул воедино, их число всегда четное, от двух до нескольких тысяч. Такой белок называют мультимером (или олигомером), а каждую из его глобул — протомером, или субъединицей.
Связи четвертичной структуры:
Таким образом, мы видим, что в белковой структуре имеются два вида ковалентных (прочных) связей: пептидная и дисульфидная и три вида нековалентных (слабых) связей: водородные, электрофильные и гидрофобные.
Выделяют 4 основных типа гемоглобина:
HbА 1 — гемоглобин взрослого, его молекула построена из двух α- и двух β-субъединиц. На его долю приходится более 90% общего гемоглобина.
HbА 2 — минорный. 2 α и 2 δ частицы. 1% от общего Hb.
HbF — фетальный (2 α, 2 γ). Является основным гемоглобином плода.
HbP — эмбриональный (2 α, 2 ε). Преобладает у эмбриона.
III. Фибриллярные белки
Высшие структуры фибриллярных белков имеют форму длинной нити, они плохо растворимы в воде. Практически все они выполняют важнейшую структурную функцию. Иначе говоря, из фибриллярных белков построено наше тело. Классификация фибриллярных протеинов по строению :
— α-фибриллярные белки (α-кератины);
— β-фибриллярные белки (β-кератины);
— белки коллагенового типа.
1. α-фибриллярные белки (α-кератины)
α-кератины являются основным структурным компонентом покровных тканей организмов позвоночных. На их долю приходится большая часть сухого остатка кожи и ее производных: волосы, ногти, когти, рога, копыта, иглы, панцирь, чешуя.
а) Первичная структура имеет ряд особенностей: а) много аминокислот с гидрофобными радикалами. Поэтому α-кератины совершенно нерастворимы в воде; б) значительное количество цистеина; в) α-кератины спирализованы по всей длине, а т. к. пролин нарушают спирализацию, в их составе его нет.
б) Вторичная структура α-кератинов — классическая α-спираль (см. выше).
в) Третичную структуру этих протеинов можно рассмотреть на примере построения волоса. Три параллельно расположенных α-спирализованных цепи, с одинаковой направленностью жестко связаны друг с другом большим количеством поперечных дисульфидных связей (для этого и нужен цистеин). Триада спирализованных цепей полого закручиваются относительно друг друга, образуя суперспираль (протофибрилла).
2. β-фибриллярные белки (β-кератины)
В организме позвоночных отсутствуют β-кератины. Эти белки характерны для чуждого нам мира организмов — член истоногих. Наиболее типичные примеры: фиброин шелка и кератин паутины. Основной отличительной особенностью построения подобных белков является β-структура.
в) Вторичная структура — классическая β-структура, описанная выше.
3. Фибриллярные белки коллагенового типа
Если α-фибриллярные белки лежат в основе построения покровных тканей позвоночных, а β-кератины в организме человека вообще отсутствуют, то протеины коллагенового типа являются основным строительным компонентом опорных тканей (соединительная ткань и ее производные: кости, сухожилия, связки, хрящи).
Важнейшим компонентом соединительной ткани является коллаген. Это самый распространенный белок человеческого организма (1/3 от массы сухого остатка тела). Основная его функция — обеспечение механической прочности органов и тканей.
а) Первичная структура — преобладают: глицин (до 33%), аланин (11%), гидроксипролин и гидроксилизин (21%). Стоит заметить, что гидроксипролин специфичен только для коллагена.
б) Вторичная структура — тропоколлаген — 3 коллагеновых нити, объединенные в общую суперспирализованною частицу.
в) Третичная структура — множество единиц тропоколлагена, соединенных в единое коллагеновое волокно ковалентными (эфирными лизин-лизиновыми) связями.
Другим важным соединительнотканным протеином является эластин. Его структурная организация во многом схожа с коллагеновой, но имеется ряд существенных отличий. В первичной структуре очень мало пролина. Это объясняет высокую спирализованность эластиновых цепей во вторичной структуре. Следует отметить, что эти спирали, обеспечивающие высокую растяжимость, не имеют ничего общего с классическими α-спиралями.
IV. Белок в растворе
Практически все глобулярные протеины прекрасно растворимы в воде. Факторы, удерживающие белок в растворе:
Различные виды осаждения можно разделить на:
2. Обратимое осаждение (коагуляция) характерно для:
а) Изоэлектрического состояния — когда рН ( кислот ность) раствора нейтрализует заряд молекул белка, что неизбежно приводит к осаждению. При изменении кислотности в любом направлении растворимость протеина вновь восстанавливается за счет приобретения заряда.
б) Высаливание — осаждение белка при добавлении солей щелочных металлов. Ионы солей стягивают гидратные оболочки белка и нейтрализуют его заряд. Оба фактора, удерживающих белок в растворе, исчезают, что приводит к обратимой коагуляции.
Адсорбционная пептизация — вторичное растворение осажденного белка в избытке солей тяжелых металлов.
Соотношение процессов денатурации и коагуляции белка неоднозначно. Возможны три варианта:
— Денатурация с коагуляцией — возникают при кипячении в нейтральной, слабокислой или слабощелочной среде;
— Денатурация без коагуляции — происходит в сильнокислой или сильнощелочной среде:
— Коагуляция без денатурации — характерна для высаливания или изоэлектрического состояния.
Что может быть важнее ферментов (энзимов)? Любой био хими к ответит — ни-че-го. Если белки — самый значимый класс биологических молекул, то энзимы — ключевая группа белков (аналогия: белки — дворянство хими ческого мира, ферменты — королевский двор).
Жизнь — это, прежде всего — процесс, совокупность сложнейших функций, каждая из которых — набор био хими ческих реакций, и все эти реакции катализируют ферменты. Таким образом, энзимы — первейшая основа жизни.
I. Ферменты, их строение, изоферменты
1. Общая характеристика
Ферменты — биологические катализаторы. Это доказывает сходство ферментов и катализаторов :
1. повышают скорость хими ческой реакции;
2. действуют в мизерных концентрациях;
3. не расходуются в ходе реакции;
4. не смещают хими ческое равновесие реакций.
Но, поскольку все ферменты являются белками, существует ряд их отличий от неорганических катализаторов :
1. ферменты более активны;
3. работают только в узких рамках физиологических параметров (температура, рН и др., см. ниже);
4. ферменты специфичны.
Рассмотрим подробнее типы специфичности ферментов:
а) абсолютная : один фермент реагирует только с одним видом субстрата (обозначается — S) в реакции только одного типа. Это самый распространенный тип специфичности, поэтому он не нуждается в примерах;
б) относительная : 1 фермент — несколько субстратов — 1 реакция (пример: пищеварительные ферменты);
в) стереоспецифичность : фермент работает только с одним из изомеров субстрата (пример: малатдегидрогеназа).
2. Строение сложных ферментов
Рассмотрим подробнее строение сложных ферментов. Белковая часть их молекулы (бо̀льшая по размеру) — апофермент; небелковая — кофактор.
Кофакторы делят на:
а) кофермент — связан с апоферментом легко, нековалентно и поэтому может на время отходить от белковой части;
б) простетическая группа — связана с апоферментом ковалентно, жестко.
3. Строение активного центра
Активный центр — это рабочий орган фермента, с его помощью энзим и проводит реакцию катализа. В его состав входят аминокислотные последовательности и кофактор (у сложных энзимов). Активный центр построен из двух частей:
б) каталитический участок — «сердце» энзима, именно он обеспечивает катализ, т. е. — ускорение реакции. Если фермент сложный, то его кофактор является тем самым каталитическим участком.
4. Аллостерический центр
Если активный центр есть у каждого фермента, то аллостерический — лишь у избранных (о них я расскажу позднее), эту группу так и называют — аллостерические ферменты.
Аллостерический центр не похож на активный и выполняет иную функцию — регуляторную. К нему могут специфически присоединяться только особые вещества — эффекторы (модификаторы), которые делятся на: активаторы (ускоряют работу энзима) и ингибиторы (замедляют).
Таким образом, аллостерический центр можно сравнить с «выключателем», с помощью которого можно управлять ферментом (а, следовательно — и хими ческой реакцией), т. е. подстегивать его работу или, наоборот, притормаживать. Повторю, функция аллостерического центра — регуляция скорости хими ческого процесса.
5. Изоферменты — разные формы одного фермента, немного различающиеся по строению, свойствам, но катализирующие одну и ту же реакцию.
Единственный пример изоферментов, который вы должны знать — ЛДГ (лактатдегидрогеназа). Молекула этого белка построена из 4 субъединиц, каждая из которых может быть Н- или М-типа.
Таким образом, мы видим, что получается всего 5 комбинаций, которые приведены ниже:
ЛДГ-1 — построена из 4-х Н-протомеров (НННН). Содержится, в основном, в сердце;
ЛДГ-2 — НННМ (в сердце);
ЛДГ-3 — ННММ (в почках и легких);
ЛДГ-4 — НМММ (в печени);
ЛДГ-5 — ММММ (в печени и скелетных мышцах).
Эти изоформы имеют большое значение в медицине, как маркеры разрушения (деструкции) клеток. В норме, уровень ЛДГ в крови очень низок, но при массивной гибели клеток (некроз, инфаркт, агрессивное вирусное воспаление) повышаются отдельные изоформы. Например, при вирусном гепатите (болезнь печени) подскакивает уровень ЛДГ 4-й и 5-й изоформ. При инфаркте миокарда резко увеличивается концентрация ЛДГ 1-й и 2-й изоформ, которые находятся в сердце. Замечу, что при ишемической болезни сердца (ИБС, стенокардия) ЛДГ будет в норме; этот тест прекрасно помогает отличить ИБС от инфаркта (это важно, поскольку лечение при этих заболеваниях отличается).
6. Мультиферментные системы
Надо помнить, что в нашем организме нет отдельных хими ческих реакций, есть процессы — несколько последовательных реакций, выполняющих какую-то функцию. Если, к примеру, в процессе 6 реакций, значит его обеспечивают 6 видов ферментов. Все просто. Обычно эта группа энзимов беспорядочно взвешена (растворена) в цитоплазме, или иной жидкости, в такой системе нет выраженной последовательности. Но бывают и другие типы расположения ферментов: мультиферментная система — группа ферментов, катализирующих реакции одного процесса и жестко фиксированных (на мембране или органелле) в порядке следования реакций. Такой подход выгоден, т. к. сокращает время процесса (увеличивает скорость). Представьте, стоит субстрату связаться с активным центром первого фермента и он «попал», S уже не вырвется, он обречен перескакивать с одного активного центра на другой, пока не пройдет все превращения до последнего.
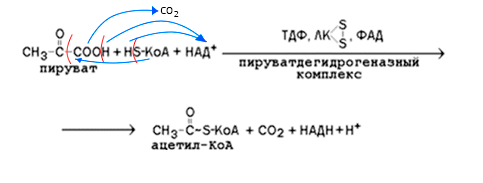
Примеры: мультиферментных систем: дыхательная цепь; пируватдегидрогеназный комплекс; альфа-кетоглутаратдегидрогеназный комплекс.
II. Кинетика и механизм ферментативных реакций
1. Кинетика ферментативных реакций
Как правило, к этой теме студенты подходят с опаской. Их пугает раздутая математическая часть. А зря. Ведь 90% этого «ужаса» можно спокойно пропустить. Из письменного материала вам необходимо запомнить лишь три легчайших графика и одно уравнение. Если разобраться, это довольно простая, логически стройная, интересная тема. Итак, приступим.
Кинетика — раздел физико хими и, изучающий скорость хими ческих реакций и факторы, влияющие на нее.
Разберемся с терминами.
Энергия активации — минимальная энергия, необходимая для запуска реакции. Она количественно равна барьеру отталкивания между молекулами. Понятно: чем больше барьер (чем выше энергия активации), тем ниже скорость реакции. Значит, чтобы ускорить реакцию, надо понизить энергию активации (что и делают ферменты).
Молекулярность — число, равное количеству молекул, участвующих в акте реакции. Пример: если в одном акте реакции участвуют две молекулы (скажем: щелочь и кислот а), молекулярность равна двум. Молекулярность может иметь только следующие значения: 1, 2 и 3.
Порядок реакций. В учебниках определение порядка дано настолько отвратительно, что 99% студентов не понимают его суть. Даю свое определение. Порядок — числовая величина, показывающая, от концентрации скольких веществ зависит скорость хими ческой реакции. Как видите, все просто. Если скорость реакции зависит от концентрации двух веществ, порядок равен 2, если от одного — единице. Если порядок равен нулю, это говорит о том, что скорость вообще не зависит от концентрации.
Факторы, от которых зависит скорость реакции :
1. Концентрация реагирующих веществ;
2. Температура среды;
3. Давление (на ферментативные реакции не влияет);
В изучении ферментов два из пяти факторов отбрасываем сразу: катализ (ферменты и есть катализаторы, что уж тут говорить?) и давление. Почему убираем давление? Из школьного курса вы помните, что давление влияет только на реакции в газовых средах, а энзимы, как вы уже поняли, живут и работают в водной среде (все био хими ческие процессы протекают только в водной фазе). Значит, давление не влияет на ферментативные процессы.
Теперь разберемся по порядку с ключевыми факторами:
1. Концентрация реагирующих веществ
В ферментативных реакциях реагирующее вещество, как правило, одно — субстрат (фермент не считается реагентом, т. к. он — катализатор).
В простых реакциях эта зависимость описывается законом действующих масс (вспомните школу) — чем больше концентрация, тем выше скорость.
С ферментами сложнее. Посмотрите на график: «Зависимость между скоростью ферментативной реакции и концентрацией субстрата…» в вашем учебнике. Мы видим, что при повышении концентрации S, вначале скорость растет почти линейно (реакция 1-го порядка), но, если мы будем добавлять все больше S, темпы роста скорости падают и, в конце концов, ее рост останавливается, выходит на плато, т. е. скорость больше не зависит от концентрации субстрата (реакция 0-го порядка). Почему так? Ответ прост: наступил момент, когда все молекулы фермента насыщены субстратом (который в избытке), а вступает в реакцию только тот S, который связан с энзимом, остальные молекулы S пассивно висят в растворе и ждут своей очереди. Достигнута максимальная скорость. Бросьте в колбу хоть килограмм субстрата, скорость не изменится (повысить ее можно только одним способом — добавить еще фермента).
Этот процесс описывает уравнение Михаэлиса-Ментен:
v = v max [S] / K m + [S],
где v max — максимальная скорость, [S] — концентрация субстрата, а K m — константа Михаэлиса (посмотрите, она есть на графике), это концентрация S, при которой скорость равна половине от максимальной. Все ферменты различаются по активности. K m — важнейшая характеристика, отражающая энергичность конкретного фермента. Чем она меньше, тем активнее фермент.
2. Температура среды — единственный фактор, который влияет на скорость всех, без исключения хими ческих реакций.
В обычной реакции зависимость линейная: чем выше температура (t), тем быстрее протекает процесс. Но у ферментов все не так. Посмотрите на график: «Влияние температуры на скорость катализируемой ферментом реакции…» в вашем учебнике. Мы видим, что при повышении t, вначале скорость реакции растет, но в какой-то момент она достигает пика и начинает резко падать до нуля. Это легко объяснить. Любой фермент — белок, и, как белок, он денатурирует (теряет активность) при сильном нагревании. Разве это сложно?
Теперь о цифрах. В разных учебниках по био хими и на этом графике приводятся различные цифры (иногда они вообще отсутствуют), поэтому даю максимально приближенные к истине. Их всего две: оптимум (самая высокая точка графика) — 36,6 0 С; полное ингибирование (когда кривая падает до 0) — 45 0 С. Некоторые энзимы «выключаются» уже при 42 0 С, поэтому на медицинских термометрах 42 0 С — крайняя точка, температура, которую человек, как правило, не переживает. Это в очередной раз доказывает, что ферменты — основа жизни, и угнетение даже одного из них чревато смертью.
3. Кислот ность среды (рН)
Энзимы очень чувствительны к изменению кислотности раствора, и при сдвиге рН в ту или иную сторону, они прекращают работать. Идеальной рН для подавляющего большинства ферментов является значение 7,4, хотя они способны функционировать в диапазоне от 6,5 до 8,5. Это показано на графике: «Влияние рН на скорость катализируемой ферментов реакции» в вашем учебнике.
Есть исключения. К примеру, пепсин желудка активен в сильнокислой среде (рН 1,5—2,5), а аргиназа — в щелочной (рН около 10,0).
Обратите внимание: гомеостаз, постоянство внутренних параметров организма, направлено на оптимальную работу его величества фермента, он первичен, что доказывает сказанное выше. Почему нормальная температура тела человека — 36,6 0 С? Да потому, что именно в этих условиях большинство наших энзимов чувствуют себя великолепно. По этой же причине норма рН биологических жидкостей человека равна 7,4.
2. Механизм ферментативных реакций
Еще в начале прошлого века Анри Михаэлис доказал, что в ферментативной реакции обязателен контакт фермента (E) и S, образование фермент-субстратного комплекса:
E+S = ES = E+P (продукт),
который играет ключевую роль в процессе.
В ходе изучения этого вопроса, особого внимания заслуживают две теории механизма ферментативного катализа:
а) Теория Фишера (теория «ключа» и «замка»; теория соответствия). Согласно Фишеру, субстрат идеально соответствует активному центру фермента, как ключ соответствует «личинке» своего замка. S входит в активный центр (АЦ), заполняя его. При этом все функциональные группы субстрата вступают в связь с соответствующими группами АЦ. Таким образом, соответствие является как пространственным, так и хими ческим.
б) Теория Кошленда (теория «руки» и «перчатки»; теория индуцированного катализа). По Кошленду, АЦ фермента не полностью соответствует субстрату (как лежащая перчатка не повторяет форму руки), но, как только S приближается к активному центру (рука к перчатке), тот «расправляется», приобретая нужную форму и вступая в связь с S. Мы видим, что в этом случае субстрат выступает как активный реагент, воздействующий на энзим.
Какая же из этих теорий верна? Обе. Часть ферментов работают согласно версии Фишера, часть — по Кошленду.
Современные представления о механизме ферментативного катализа
Согласно современным данным, ферментативная реакция протекает в 4 стадии:
1) E+S = ES; 2) ES = EX; 3) EX = EP; 4) EP = E+P
Как видно из схемы, субстрат не сразу становится продуктом реакции (Р), до этого он превращается в Х — переходную форму, где старые связи еще не разрушены, а новые уже начинают образовываться. Весь фокус в постепенности превращения. Нет резких переходов, есть плавное медленное «перетекание» от S к Р, через переходную форму Х. При этом нет нужды в трате больших количеств энергии (как, если бы вы, вместо того, чтобы надрываться, карабкаясь на 5-й этаж по стене, вы не торопясь поднялись бы по лестнице). Именно эта плавность и обеспечивает значительное снижение энергии активации и, следовательно — ускорение реакции.
III. Регуляция ферментов, классификация
а) Изменение количества фермента. Т. к. все энзимы — белки, они синтезируются также, как белки — на рибосомах, при участии м-РНК, под управлением ядра. Если клетка «хочет» увеличить концентрацию фермента, в ядре включается ген этого белка, образуется его м-РНК, которая идет в цитоплазму и запускает образование фермента на рибосоме. Если необходимо уменьшить количество Е, его ген блокируется. Как понимаете, этот вид регуляции запускается довольно медленно, но действует долго.
б) Изменение активности фермента:
— Хими ческая модификация (в т.ч. проферменты). Модификация — это изменение. Чтобы запустить или выключить фермент, к его молекуле присоединяются (или отщепляются) различные хими ческие группы: фосфат, пептидные участки и др. Пример: профермент пепсиноген превращается в активный пепсин путем отщепления от него крупного пептидного фрагмента.
— Аллостерическая регуляция — самый красивый и распространенный тип регуляции. Любой био хими ческий процесс состоит из нескольких последовательных реакций. Скорость всего процесса равна скорости лимитирующей (самой медленной) реакции. Эту реакцию (и только ее) катализирует аллостерический фермент (т. е. фермент с «выключателем»). Теперь вы понимаете, почему не все ферменты являются аллостерическими? Для каждого процесса достаточно одного такого энзима. Эволюционно так сложилось, что в каждом процессе исходные вещества являются активаторами аллостерического фермента, а продукты реакции — выключают (ингибируют) его. Это гармоничная система. Стоит процессу слишком разогнаться, он образует избыток продуктов, которые тормозят аллостерический фермент, а если процесс течет вяло, накапливаются исходные вещества, которые «подстегивают» его. Таким образом, процесс сам управляет собой, без внешнего вмешательства.
Замечу, что во втором семестре вам часто придется сталкиваться с аллостерической регуляцией того или иного процесса, так что обратите особое внимание на этот вопрос. Это поможет.
2. Активаторы — вещества, стимулирующие работу ферментов. Вот и все, собственно. И сказать-то нечего. Поэтому по данному вопросу преподаватель будет требовать примеры. Приведем их:
Пепсин + соляная кислот а — активируют пепсиноген;
Колипаза + желчные кислот ы — активируют липазу;
Энтерокиназа — активирует трипсиноген;
Трипсин — активирует химотрипсиногены и проэластазу.
3. Ингибиторы (обозначаются — I) — вещества, замедляющие работу ферментов. Ингибирование делят на необратимое, приводящее к денатурации (кипячение, радиация, кислот ы, щелочи и др.) и обратимое, которое, в свою очередь, делят на:
а) конкурентные I — имеют три особенности, причем, каждая из последующих является следствием предыдущей. Во-первых, молекула конкурентного ингибитора очень похожа на субстрат, во-вторых, он взаимодействует с активным центром энзима, в-третьих, активность ингибирования зависит от концентрации: чем I больше, тем сильнее он подавляет реакцию.
Поясню, бывает такое, что чужой ключ, волей случая, настолько сходен с вашим, что его можно вставить в замок, но провернуть не получится. Такие I, подобно S, связываются с АЦ фермента, временно выключая его из реакции. Предположим, что в растворе одинаковое количество I и S, тогда, примерно половина фермента будет связана с конкурентным ингибитором (т. е. — выключена из реакции). И только половина энзима будет работать с субстратом. Во сколько раз снизится скорость реакции в этом случае? Ответ очевиден — в два.
Примером конкурентных I являются сульфаниламидные лекарства (норсульфазол, фталазол, бисептол и др.). Они конкурентно вытесняют субстрат — ПАБК бактерий из синтеза фолиевой кислот ы, необходимой для их размножения. В результате колония микробов угасает, человек выздоравливает. Но следует помнить, что эти лекарства (будучи конкурентными) активны только в высоких концентрациях. Поэтому, при применении сульфаниламидов, в первый день пьют ударную дозу (чтобы достичь нужной концентрации), затем — поддерживающие.
б) неконкурентные I имеют те же три особенности, только с противоположным знаком. Во-первых, их молекула не похожа на субстрат, во-вторых, она взаимодействует не с активным центром (чаще — с аллостерическим), в-третьих, активность ингибирования не зависит от концентрации, неконкурентные I активны даже в мизерных доза х.
4. Классификация ферментов по типу реакции:
а) оксидоредуктазы — обеспечивают окислительно-восстановительные реакции. Примеры: дегидрогеназы, цитохромы, гидроксилазы;
б) трансферазы — катализируют реакции переноса;
в) гидролазы — самая распространенная группа, обеспечивает реакции гидролиза, распада. Примеры: пептидазы — расщепляют белок, гликозидазы — гидролизуют углеводы;
г) лиазы — катализируют реакции отщепления с образованием двойной связи;
д) изомеразы — проводят реакции изомеризации, т. е. изменения внутри молекулы;
е) синтетазы (лигазы) — катализируют реакции синтеза, т. е. образования крупных молекул из более мелких. Важно: они работают только при обеспечении энергией (АТФ и др.).
5. Медицинская энзимология
Энзимология — наука о ферментах. Медицинская энзимология имеет три направления:
а) Энзимопатология — изучает энзимопатии — заболевания, связанные с нарушением работы фермента. Энзимопатии делят на приобретенные (панкреатит) и врожденные, примеры которых приведены ниже:
Фенилкетонурия — поломка фермента, обеспечивающего превращение фенилаланина в тирозин. При этом токсические продукты поражают мозг р ебен ка, вызывая слабоумие. Единственный способ борьбы с осложнениями — ограничивать употребление продуктов, содержащих фенилаланин.
Алкаптонурия — отсутствие фермента, расщепляющего гомогентизиновую кислот у. Это пигмент, придающий темный цвет моче, а в запущенных случаях — кончикам ушей и носа.
Альбинизм — поломка одного из ферментов, участвующих в синтезе меланина — покровного пигмента человека, защищающего кожу от ультрафиолета. У альбиносов бледная кожа, белые волосы и розовая радужка (из-за просвечивания сквозь нее сетчатой оболочки глаза).
б) Энзимодиагностика — постановка диагноза с помощью ферментов. Имеет два направления:
— Определение фермента в крови. В качестве примера рассказываете все об ЛДГ (см. выше). Этого достаточно.
— Определение в крови другого вещества с помощью фермента, имеющегося в лаборатории. Пример — иммуноферментный анализ (ИФА).
в) Энзимотерапия — лечение с помощью ферментов. Примеры: пищевые ферментативные препараты (Панкреатин, Фестал, Энзистал, Мезим, Креон и др.) — эффективны не только при лечении заболеваний ЖКТ, но и при б анальн ом переедании; гиалуронидаза («Лидаза») — применяется для предотвращения разрастания рубцов; раствор трипсина — для очисти гнойных ран и т. д.
Глава III ВИТАМИНЫ
Важнейшей группой незаменимых веществ являются витамины. Подтверждением их метаболической значимости служит вся история человечества, в процессе которой отмечались регулярные страшнейшие вспышки гиповитаминозов, уносившие десятки и сотни тысяч жизней.
Цинга (скорбут) — гиповитаминоз С; чаще встречался в средних и полярных широтах, т. е. на тех территориях, где не так распространены овощи и фрукты, богатые витамином С. Цинга являлась тяжелейшим бичом российского народа на протяжении столетий. Нередко этот гиповитаминоз охватывал целые страны и группы стран. На пике вспышек летальность от этой патологии достигала 80%!
По разделу «Витамины» на кафедрах био хими и, как правило, проводят контрольную работу, вопросы в которой можно условно разделить на две подтемы: ключевые понятия о витаминах в общем (об этом речь пойдет ниже) и вопросы по конкретным витаминам (частная витаминология).
Вопросов по частной витаминологии мы коснемся минимально, т. к. там нечего объяснять, надо просто сесть и выучить. Но пару советов на эту тему я дам. Дело в том, что раздел «Витамины» в учебниках по био хими и непомерно раздут (особенно в книге Т. Т. Березова), очень много «лишнего», чего нет в контрольной. Каждому витамину отводится аж по 4—5 стр. Пусть вас это не пугает. Запомните, по любому из витаминов вам достаточно выучить всего пять фактов: 1) название; 2) формула; 3) биологическая роль — здесь не заморачивайтесь, биологическую роль я подробно дам ниже; 4) патология — название и очень краткое описание симптомов конкретного гиповитаминоза; 5) содержание в продуктах. Все! Согласитесь, не так уж и много. Остальное можете смело пропускать.
Итак, с частной витаминологией закончили, переходим к общей.
В Росси и изучению витаминов значительную роль уделили Н.И.Лунин и Н. Д. Зелинский.
Первым витамином, полученном в чистом виде был тиамин (В 1 ), который получил Казимир Функ в 1912 году и назвал это вещество «витамином». В дальнейшем, название конкретного вещества постепенно превратилось в наименование целой группы.
Витамины — группа незаменимых органических веществ, присутствующих в клетках в очень малых концентрациях и обеспечивающих их нормальную жизнедеятельность.
Согласитесь, не очень удачное определение, поэтому ниже перечислим критерии витаминов:
в) Коферментная роль — о ней скажу ниже.
Существует ряд паталогических состояний, причиной возникновения которых является изменение количества витаминов в организме. Наиболее значимыми из них являются следующие:
Гипервитаминоз — заболевание, развивающееся в результате избыточного поступления витамина в организм.
Важно: гипервитаминозы чаще встречаются при пере дози ровке жирорастворимых витаминов (А, Д, Е, К). Это объяснимо: избыток водорастворимых витаминов легко выводится с мочой (т. к. это — водный раствор). Избавление от избытка жирорастворимых витаминов более сложно, т. к. эти вещества плохо растворимы в воде. При пере дози ровке они быстро накапливаются в тканях, что приводит к токсическому эффекту в плоть до летального исхода.
Гиповитаминоз — заболевание, развивающееся в результате недостаточного поступления витамина в организм.
Авитаминоз — заболевание, развивающееся в результате полного нарушения поступления витамина в организм.
Авитаминоз — теоретическое понятие, его не встретишь на практике, чего не скажешь о гиповитаминозах.
Гиповитаминозы делят на две группы:
а) Экзогенные (первичные, алиментарные). Они возникают при дефиците витамина в пище. Исторические гиповитаминозы, такие как цинга, бери-бери, пеллагра, рахит и др. принадлежат к этой группе.
б) Эндогенные (вторичные) гиповитаминозы — развиваются по «внутренним» причинам, даже если количество витамина в пище соответствует норме. Их причины делят на три группы:
— Заболевания ЖКТ, приводящие к нарушению всасывания витаминов в кишечнике. Такое возможно при гастритах, дуоденитах, панкреатитах, желчнокаменной болезни, дискинезиях желчевыводящих путей и, особенно, при хронических энтеритах.
— «Перехват» вещества чужеродными организмами, когда витамин пищи просто не доходит до пациента. Такое происходит при дисбактериозе или глистной инвазии.
— Повышенная потребность в витаминах. Подобное отмечается при беременности, кормлении грудью, усиленной физической нагрузке, тиреотоксикозе, истощении и др.