ингибиторы микросомальных ферментов печени что это значит
Цитохром Р450 (изоферменты CYP2C19 и CYP3A4)

Цитохром Р450 представляет комплекс белка с ковалентно связанным гемом (металлопротеином), обеспечивающим присоединение кислорода. Гем, в свою очередь, является комплексом протопорфирина IX и двувалентного атома железа. Число 450 обозначает, что восстановленный гем, связанный с СО, отличается максимумом поглощения света при длине волны 450 нм.
Цитохромы Р-450 участвуют не только в метаболизме лекарств, но и в превращении гемоглобина в билирубин, синтезе стероидов и др. Все изоформы цитохрома Р-450 объединены в семейства CYP1, CYP2, CYP3. Внутри семейств выделены подсемейства A, B, C, D, E. В пределах подсемейств изоформы обозначены порядковым номером. Например, CYP2C19 — наименование 19-го по порядку цитохрома подсемейства «С», семейства «2». Всего существует около 250 различных видов цитохрома Р-450, из них примерно 50 — в организме человека и только шесть из них (CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4) имеют отношение к метаболизму лекарств.
На активность цитохромов Р-450 оказывает влияние множество факторов — курение, алкоголь, возраст, генетика, питание, болезни. Эти факторы отвечают за формирование индивидуальных особенностей работы ферментов Р-450 и определяют эффекты лекарственного взаимодействия у конкретного пациента.
Важность цитохромов Р450 для гастроэнтерологии
Значительно возросший в последнее время интерес гастроэнтерологов к изоформам цитохрома Р450 CYP2C19 и CYP3A4 обусловлен в их ролью в метаболизме производных бензимидазола, к которым относятся все лекарственные препараты из группы по АТХ A02BC «Ингибиторы протонового насоса» (омепразол, панторазол, лансопразол, рабепразол и эзомепразол). Клинически существенно, что ген CYP2C19 отличается полиморфностью и от состояния этого гена у пациента в значительной степени зависит величина терапевтического эффекта различных ИПП.
Среди ИПП наибольшее ингибирующее действие в отношении CYP2C19 проявляет лансопразол, в меньшей степени омепразол и эзомепразол. Еще ниже эффект рабепразола, однако значительное ингибирующее воздействие на активность CYP2C19 оказывает его тиоэфир, образующийся в ходе неферментного метаболизма. Наименьшее влияние на CYP2C19 оказывает пантопразол. Наибольшее ингибирующее воздействие на CYP3A4 in vitro у пантопразола, далее (по мере уменьшения эффекта) омепразол, эзомепразол и рабепразол и лансопразол. Для пациентов, получающих несколько лекарственных препаратов, из ИПП предпочтительнее пантопразол (Бордин Д.С.).
При активном участии CYP3A4 происходит метаболизм домперидона, цизаприда и большого числа других лекарств.
Целый ряд гастроэнтерологических препаратов ингибируют цитохром CYP3A4, оказывая тем самым влияние на фармакокинетику принимаемых совместно лекарств.
Проблема взаимодействия лекарств
В современной клинической практике широко распространено комбинированное применение лекарств, что связано с наличием у пациента нескольких заболеваний или недостаточной эффективностью монотерапии. При комбинированной терапии возможно взаимодействие лекарств. Более одного лекарства принимает примерно 56 % пациентов в возрасте до 65 лет и 73 % пациентов старше 65 лет. Прием двух лекарств приводит к их взаимодействию у 6 % пациентов. Назначение 5 (или 10) лекарств повышает частоту взаимодействий до 50 (или 100) %.
Потенциально опасные комбинации лекарств являются серьезной клинической проблемой. Имеются данные, что от 17 до 23 % назначаемых врачами комбинаций лекарств являются потенциально опасными. Только в США из-за непредусмотренного взаимодействия лекарств умирает 48 тысяч больных в год. FDA сняло с регистрации несколько лекарств (в том числе прокинетик цизаприд) по причине их потенциально опасных взаимодействий с другими лекарствами, приводивших, в том числе и к летальным исходам.
Основные механизмы взаимодействий лекарств связаны с изменением их фармакокинетики или фармакодинамики. Наиболее существенными, согласно современным представлениям, являются изменения фармакокинетики при метаболизме лекарств с участием цитохромов Р-450.
Примером опасного взаимодействия является недавно обнаруженное взаимодействие ИПП и клопидогрела, широко применяемого при лечении больных ишемической болезнью сердца. Для уменьшения риска гастроинтестинальных осложнений больным, получающим ацетилсалициловую кислоту в комбинации с клопидогрелом, назначают ИПП. Поскольку биоактивация клопидогрела происходит с участием CYP2C19, прием ИПП, метаболизируемых этим цитохромом, может снизить активацию и антиагрегантный эффект клопидогрела. В мае 2009 года на конференции Общества сердечно-сосудистой ангиографии и вмешательств (SCAI) были представлены данные, свидетельствующие, что одновременное использование клопидогрела и ИПП значительно повышает риск возникновения инфаркта миокарда, инсульта, нестабильной стенокардии, необходимости повторных коронарных вмешательств и коронарной смерти (Бордин Д.С.).
Цитохром CYP2C19
Изоформа цитохрома Р450 CYP2C19 (S-мефенитоин гидроксилаза) катализирует реакции 5-гидроксилирования пиридинового кольца и 5′-деметилирования в бензимидазольном кольце. В человеческом организме CYP2C19 располагается в гепатоцитах.
| Генотип CYP2C19 | Распростра-ненность (Ткач С.М. и др., 2006) | Российская популяция (Никонов Е.Л.) | Тип метаболизма | Период полувыведения ИПП, T½, час (Лапина Т.Л.) | Кислото-ингиби-рующий эффект ИПП | |
| европеоидная раса | монголоидная раса | |||||
| Без мутаций (гомозиготы) | 90 % европеоидной популяции | 50,6 % | 34,0 % | Быстрый | 1 | Низкий |
| Мутация в 1-й аллеи (гетерозиготы) | 10 % европеоидной популяции | 40,5 % | 47,6 % | Промежуточный | — | Средний |
| Мутация в обеих аллеях | 20-30 % азиатской популяции | 3,3 % | 18,4 % | Медленный | 2–10 | Высокий |
Медленные метаболизаторы от быстрых и промежуточных отличаются двукратно более высокими концентрацией ИПП в плазме крови и периодом полувыведения. Полиморфизм гена, кодирующего изоформу 2С19, определяет различную скорость метаболизма ИПП у пациентов. В связи с вышесказанным подбор ИПП рекомендуется проводить под контролем суточной рН-метрии (Хавкин А.И., Жихарева Н.С., Дроздовская Н.В.).
Влияние различных генотипов CYP2C19 на эффективность эрадикации Helicobacter pylori
В силу того, что молекулярно-генетические исследования малодоступны практикующему врачу, заподозрить «быстрых» метаболизаторов можно ориентируясь на сохранение болевого абдоминального синдрома на 3–4-е сутки от начала приёма ИПП, а также принимая во внимание медленную эндоскопическую динамику при эпителизации эрозий и рубцевании язвенных дефектов у пациента. В свою очередь, недостаточность антисекреторного эффекта от терапии с применением ИПП можно верифицировать методом суточной внутрижелудочной рН-метрии (Маев И.В. и др.).
Цитохром CYP3A4
Фермент CYP3A4 катализирует реакцию сульфоксидирования, приводящую к образованию сульфогруппы. CYP3A4 является одним из самых важных для фармацевтики цитохромов, так как им биотрансформируется, по крайней мере, частично, около 60 % окисляемых препаратов. Хотя активность CYP3А4 широко варьирует, он не подвержен генетическому полиморфизму. Расположение CYP3А4 на апикальных мембранах энтероцитов тонкой кишки и гепатоцитах облегчает исполнение им метаболизм лекарств, предшествующий попаданию вещества в системный кровоток, что известно, как «эффект первого прохождения».
Ингибиторы микросомальных ферментов печени что это значит
Лекарственные препараты, применяемые при различных патологических состояниях, в организме подвергаются трансформации, и в результате этих превращений (биотрансформации) может существенно изменяться как терапевтический эффект, так и токсичность [2, 4, 5, 6, 7, 8, 9], что следует учитывать, особенно при совместном назначении лекарственных средств (ЛС)
Биотрансформация (метаболизм) – изменение химической структуры ЛС и их физико-химических свойств под действием ферментов организма с целью превращения липофильных веществ, которые легко реабсорбируются (обратно всасываются) в почечных канальцах, в гидрофильные полярные соединения, которые быстро выводятся почками (не реабсорбируются в почечных канальцах).
Биотрансформация липофильных ЛС в основном происходит под влиянием ферментов печени, локализованных в мембране эндоплазматического ретикулума гепатоцитов. Эти ферменты называются микросомальными, потому что они оказываются связанными с мелкими субклеточными фрагментами гладкого эндоплазматического ретикулума (микросомами), которые образуются при гомогенизации печёночной ткани или тканей других органов и могут быть выделены центрифугированием (осаждаются в так называемой «микросомальной» фракции). В конце 50-х годов была обнаружена универсальная гемсодержащая монооксигеназа – цитохром Р450. Авторы открытия М. Клингерберг и Д. Гарфинкель установили, что этот фермент по химической природе простетической группы может быть отнесен к цитохромам. Т. Омура и Р. Сато в 1964 г. обнаружили, что комплекс восстановленного гемопротеина с окисью углерода имеет характерный максимум при 450 нм, что и определило название фермента. В настоящее время известно более 150 различных Р450, обнаруженных в животных, растениях, грибах, бактериях. Только у строго анаэробных бактерий гемопротеин отсутствует. Прокариоты содержат растворимый Р450. Переход к эукариотическим системам сопровождается встраиванием Р450 в мембрану, как в случае дрожжей и грибов. Все цитохромы Р450 высших организмов – мембранные ферменты. Р450 играют важную роль в окислении многочисленных соединений, как эндогенных (стероиды, желчные кислоты, жирные кислоты, проста- гландины, лейкотриены, биогенные амины), так и экзогенных (лекарства, яды, продукты промышленного загрязнения, пестициды, канцерогены, мутагены и т.п.), последние называют ксенобиотиками.
В плазме крови, а также в печени, кишечнике, легких, коже, слизистых оболочках и других тканях имеются немикросомальные ферменты, локализованные в цитозоле или митохондриях. Эти ферменты могут участвовать в метаболизме гидрофильных веществ.
Различают два основных вида метаболизма ЛС: – несинтетические реакции – метаболическая трансформация (окисление, восстановление, гидролиз); – синтетические реакции – коньюгация (ацетилирование, метилирование, образование соединений с глюкуроновой кислотой, глицином и др.).
ЛС могут подвергаться или метаболической биотрансформации (при этом образуются вещества – метаболиты), или конъюгации (при этом образуются коньюгаты). Но большинство ЛС сначала метаболизируется при участии несинтетических реакций (метаболической трансформации) с образованием реакционноспособных метаболитов, которые затем вступают в реакции коньюгации. Метаболиты менее активны, чем исходные соединения, но иногда оказываются активнее (токсичнее) исходных веществ. Коньюгаты обычно малоактивны.
К метаболической трансформации относятся следующие реакции: окисление, восстановление, гидролиз.
Окисление некоторых ЛС происходит под влиянием немикросомальных ферментов, которые локализованы в цитозоле или митохондриях. Для этих ферментов характерна субстратная специфичность, например, моноаминоксидаза типа А (МАО А) метаболизирует норадреналин, адреналин, серотонин, алкогольдегидрогеназа метаболизирует этиловый спирт до ацетальдегида.
Восстановление препаратов может происходить при участии микросомальных (хлорамфеникол) и немикросомальных ферментов (хлоралгидрат, налоксон).
Гидролиз ЛС осуществляется в основном немикросомальными ферментами (эстеразами, амидазами, фосфатазами) в плазме крови и тканях. При этом вследствие присоединения воды происходит разрыв эфирных, амидных и фосфатных связей в молекулах ЛС. Гидролизу подвергаются сложные эфиры – ацетилхолин, суксаметоний (гидролизуются при участии холинэстераз), амиды (прокаинамид), ацетилсалициловая кислота.
В процессе биосинтетических реакций (конъюгация) к функциональным группировкам молекул лекарственных веществ или их метаболитов присоединяются остатки эндогенных соединений (глюкуроновой кислоты, глутатиона, глицина, сульфаты и др.) или высокополярные химические группы (ацетильные, метальные группы). Эти реакции протекают при участии ферментов (в основном, трансфераз) печени, а также ферментов других тканей (легкие, почки). Локализуются ферменты в микросомах или в цитозольной фракции.
Наиболее общей реакцией является конъюгация с глюкуроновой кислотой. Присоединение остатков глюкуроновой кислоты (образование глюкуронидов) происходит при участии микросомального отдельного фермента глюкуронилтрансферазы, обладающей низкой субстратной специфичностью, вследствие чего очень многие ЛС (а также некоторые экзогенные соединения, такие как кортикостероиды и билирубин) вступают в реакцию конъюгации с глюкуроновой кислотой. В процессе конъюгации образуются высокополярные гидрофильные соединения, которые быстро выводятся почками (многие метаболиты также подвергаются конъюгации). Конъюгаты, как правило, менее активны и более токсичны, чем исходные ЛС.
Скорость биотрансформации ЛС зависит от многих факторов. В частности биотрансформация зависит от активность ферментов, метаболизирующих ЛС, зависит от пола, возраста, состояния организма, одновременного назначения других ЛС. У мужчин активность микросомальных ферментов выше, чем у женщин, так как синтез этих ферментов стимулируется мужскими половыми гормонами. Кроме того, вещества могут накапливаться в жировой ткани, которой у женщин от природы больше. Поэтому некоторые вещества метаболизируются быстрее у мужчин, чем у женщин.
В эмбриональном периоде отсутствует большинство ферментов метаболизма ЛС, у новорожденных в первый месяц жизни активность этих ферментов снижена и достигает достаточного уровня лишь через 1–6 месяцев (поэтому некоторые препараты могут назначаться как в меньших, так и в больших дозах, например диакарб). Гематоэнцефалический барьер не функционален, поэтому все лекарственные средства практически сразу попадают в головной и спинной мозг младенца со всеми вытекающими последствиями. Поэтому в первые недели жизни не рекомендуется назначать многие препараты: хлорамфеникол (левомицетин) вследствие недостаточной активности ферментов замедлены процессы его конъюгации и проявляются токсические эффекты.
Активность ферментов печени снижается в старческом возрасте, вследствие чего уменьшается скорость метаболизма многих ЛС (лицам старше 60 лет такие препараты назначают в меньших дозах). При заболеваниях печени снижается активность микросомальных ферментов, замедляется биотрансформация некоторых ЛС и происходит усиление и удлинение их действия. У утомленных и ослабленных больных обезвреживание ЛС происходит медленнее [1, 3, 10].
Под действием некоторых ЛС (фенобарбитал, рифампицин, карбамазепин, гризеофульвин) может происходить индукция (увеличение скорости синтеза) микросомальных ферментов печени. В результате при одновременном назначении с индукторами микросомальных ферментов других препаратов (например, глюкокортикоидов, пероральных контрацептивов) повышается скорость метаболизма последних и снижается их действие. В некоторых случаях может увеличиваться скорость метаболизма самого индуктора, вследствие чего уменьшаются его фармакологические эффекты (карбамазепин).
Некоторые ЛС (циметидин, хлорамфеникол, кетоконазол, этанол) снижают активность метаболизирующих ферментов. Например, циметидин является ингибитором микросомального окисления и, замедляя метаболизм варфарина, может усилить его антикоагулянтный эффект и спровоцировать кровотечение. Известны вещества (фуранокумарины), содержащиеся в грейпфрутовом соке, которые угнетают метаболизм таких препаратов как: циклоспорин, мидазолам, алпразолам чем усиливают их действие. При одновременном применении ЛС с индукторами или ингибиторами метаболизма необходимо корректировать назначаемые дозы этих веществ.
Скорость метаболизма некоторых ЛС определяется генетическими факторами. Появился раздел фармакологии – фармакогенетика, одной из задач которого является изучение патологии ферментов лекарственного метаболизма. Изменение активности ферментов часто является следствием мутации гена, контролирующего синтез данного фермента. Нарушение структуры и функции фермента называют энзимопатией (ферментопатией). При энзимопатиях активность фермента может быть повышена, и в этом случае процесс метаболизма ЛС ускоряется и их действие снижается. И наоборот, активность ферментов может быть снижена, вследствие чего разрушение ЛС будет происходить медленнее и действие их будет усиливаться вплоть до появления токсических эффектов.
Что такое система микросомальных ферментов печени?
Лекарственные средства преобразуются в печени в процессе нескольких процессов, катализируемых ферментами. Все эти ферменты вместе называются микросомальной ферментной системой и присутствуют в эндоплазматической сети гепатоцитов.
Микросомальные ферменты
Микросомальные ферменты в основном обнаруживаются в эндоплазматической сети клеток печени. Микросомы – это часть эндоплазматическогоретикулума и прикрепленные к ним рибосомы выделяются вместе при центрифугировании гомогенизированных клеток.
Существует несколько микросомальных ферментов, которые представлены монооксигеназами, цитохромом Р450, НАДФ цитохром с редуктазой, глюкоронилтрансферазами, глютатион-с-трансферазами, эпоксидгидролазами и т.д. Цитохром Р450 и НАДФ цитохром с редуктазой – два основных микросомальных фермента в данной системе. Цитохром Р450 связывается с кислородом, в то время как редуктаза связывает электроны между НАДФ и цитохромом Р450. В этом процессе участвуют фосфолипиды.
Цитохром Р450
Фермент Цитохром Р450 относится к семейству ферментов, содержащих комплекс гема, который нековалентно присоединен к полипептидной цепи или гемопротеинам. Фермент был назван таковым, потому что гемопротеин может образовывать комплекс, который максимально поглощает свет с длиной волны 450 нм. Этот фермент участвует в метаболизме эндогенных веществ, таких как синтез стероидов, метаболизм ретиноевой и жирных кислот и т.д.
Индукция микросомальных ферментов печени
Микросомальные ферменты печени могут быть активированы лекарственным средством, которое связывается с рецептором в цитоплазме или ядре клетки. Этот связанный рецептор может перемещаться в ядро клетки, образовывать гетеродимер, связываться с промоторными областями генов Р450 и увеличивать экспрессию генов. К таким индукторам относятся омепрозол, фенобарбитал, рифампицин и т.д.
Индукция ферментной системы может увеличивать ее метаболический уровень в 2-4 раза. Данное повышение скорости синтеза фермента будет продолжаться до тех пор пока присуствует средство-индуктор. К своим первоначальным значениям ферментная система может вернуться в течение от одной до трех недель.
Что происходит с лекарственным средством после того как оно было метаболизировано?
Индуцирующие препараты, которые активируются в результате метаболизма в печени, действуют более интенсивно и могут привести к лекарственной токсичности. Принимая во внимание, что лекарства, которые инактивируются метаболизмом, могут замедляться и проявлять меньшую интенсивность. Некоторые эндогенные молекулы, такие как стероиды и билирубин, могут подвергаться дальнейшему метаболизму.
Ингибирование системы ферментов печени
Печеночные микросомальные ферменты могут быть также замедлены лекарственными средствами, которые воздействуют непосредственно на сам фермент.
Процесс ингибирования может работать либо путем конкурентного ингибирования лекарственных средств, вводимых вместе, либо посредством процесса необратимого ингибирования. В случае конкурентного ингибирования, лекарства связываются с P450 и конкурентно ингибируют метаболизм лекарств, вводимых вместе. В случае необратимого ингибирования, лекарство метаболизируется P450, и образующийся промежуточный продукт реакции взаимодействует с гемовым фрагментом. Это приводит к ингибированию метаболизирующего эффекта Р450.
Ингибиторы микросомальных ферментов печени что это значит
Российский реестр лекарственных препаратов, применяемых у больных с нарушениями порфиринового обмена
Порфирии — группа генетически детерминированных заболеваний, ассоциированных с циклом биосинтеза гема (рис. 1). Развитие любой нозологической формы порфирии является следствием снижения активности одного из ферментов цикла биосинтеза гема, в результате мутации в патогномоничном гене. Согласно современной классификации, порфирии подразделяются:
— по месту преимущественного нарушения метаболизма порфиринов — на эритропоэтические и печеночные порфирии (табл. 1);
— по клиническим проявлениям — на острые формы, протекающие с преимущественным поражением нервной системы, и формы, протекающие с поражением кожи (см. табл. 1).
Классификация порфирий
| Формы порфирий | Порфирии |
|---|---|
| Эритропоэтические формы | Врожденная эритропоэтическая порфирия |
| Эритропоэтическая протопорфирия | |
| Печеночные формы | Х-сцепленная доминантная протопорфирия |
| Порфирия, обусловленная дефицитом дегидратазы d-АЛК | |
| Острая перемежающаяся порфирия | |
| Врожденная копропорфирия | |
| Вариегатная порфирия | |
| Поздняя кожная порфирия | |
| Острые формы порфирий | Х-сцепленная доминантная протопорфирия |
| Порфирия, обусловленная дефицитом дегидратазы d-АЛК | |
| Острая перемежающаяся порфирия | |
| Врожденная копропорфирия | |
| Вариегатная порфирия | |
| Формы, протекающие с поражением кожных покровов | Х-сцепленная доминантная протопорфирия |
| Поздняя кожная порфирия | |
| Врожденная копропорфирия | |
| Вариегатная порфирия | |
| Врожденная эритропоэтическая порфирия | |
| Эритропоэтическая протопорфирия |
Различия в клинических проявлениях при различных нозологических формах зависят от уровня цикла биосинтеза гема, на котором функционирует фермент со сниженной активностью, определяющий, какая фракция порфиринов будет преобладать в формирующемся избытке метаболитов. Если обмен гема заблокирован на высокой ступени цикла, происходит накопление изомеров собственно порфиринов, тропных к дерме и приводящих к фотодерматозу. При ферментативном дефекте, находящемся на начальных этапах цикла биосинтеза гема, среди метаболитов будут преобладать предшественники порфиринов (порфобилиноген и d-аминолевулиновая кислота, d-АЛК), обладающие нейротоксическим, демиелинизирующим воздействием, приводящим к сенсорно-моторной полинейропатии.
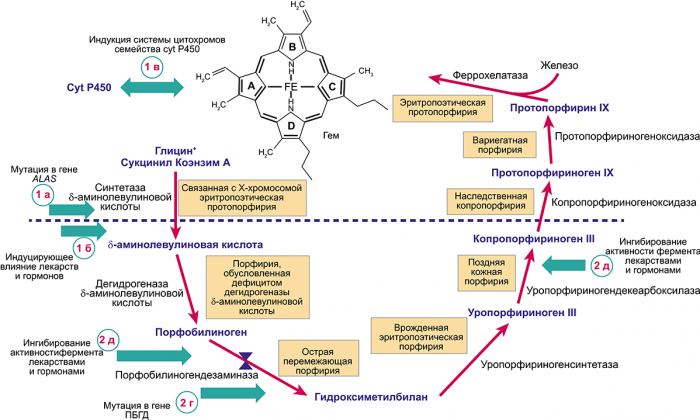
Рис. 1. Схема цикла биосинтеза гема с указанием возможных точек реализации порфириногенных эффектов лекарственных препаратов.
Эти эффекты опосредованы через возможные пути (1а—1в; 2г—2д) влияния на синтетическую активность цикла.
Независимо от тканевой принадлежности или особенностей клинического течения для всех форм порфирий характерны общие звенья патогенеза. Для клинической манифестации любой формы порфирии необходимо, чтобы произошло избыточное накопление порфиринов, как правило, являющееся следствием (см. рис. 1):
1. Повышения активности синтетазы δ-АЛК — первого фермента в цикле биосинтеза гема, причинами которого могут быть:
а) наличие мутации в гене синтетазы δ-АЛК, приводящей к увеличению ее активности;
б) непосредственное индуцирующее воздействие на фермент факторов эндогенной или экзогенной природы, например, повышение уровня эндогенного прогестерона;
в) повышенное потребление гема — конечного продукта цикла биосинтеза гема, приводящее к активации синтетазы δ-АЛК по принципу обратной связи.
2. Частичное или полное снижение активности одного из ферментов цикла биосинтеза гема, приводящее к накоплению продуктов порфиринового обмена. Возможны следующие причины снижения активности энзима:
г) наличие патологической мутации в гене фермента;
д) ингибирующее влияние на фермент экзогенных или эндогенных факторов (например, изолированное снижение активности уропорфириногендекарбоксилазы, приводящее к дебюту спорадической формы поздней кожной порфирии).
Действие известных порфириногенных факторов (табл. 2), приводящее к эскалации синтеза порфиринов, может быть опосредовано через описанные выше пути. Одним из наиболее значимых порфириногенных факторов являются лекарственные препараты. Прием порфириногенных лекарственных препаратов является причиной развития приступов острой порфирии (ОП) в 18% случаев (собственные неопубликованные данные). Индуцированные лекарствами приступы ОП отличаются более тяжелым течением, чем приступы, обусловленные другими факторами. По нашим данным, при провокации ОП лекарствами в 100% случаев отмечалось тяжелое течение болезни, а у 45% больных потребовалось длительное, более 2 мес, лечение в стационаре. У больных с нозологическими формами, протекающими с поражением кожных покровов, прием порфириногенных препаратов приводит к эскалации синтеза порфиринов и последующей манифестации фотодерматоза.
Порфириногенные факторы
| Порфириногенные факторы |
|---|
| Голодание |
| Инфекции |
| Алкоголь |
| Прием лекарств |
| Репродуктивная функция у женщин |
| Инсоляция |
| Психические стрессы |
| Физические перегрузки |
Порфириногенность лекарств реализуется через механизмы, оказывающие влияние на разные звенья порфиринового обмена (см. рис. 1).
Наиболее частым является триггерный механизм, активирующий систему цитохромов P450. Половина лекарств подвергаются окислительному метаболизму в печени с участием системы детоксикации, в которой задействованы ферменты системы цитохрома P450 (CYP). Они катализируют реакции гидроксилирования, эпоксидирования, N-, S-, O-деалкилирования, N-окисления, сульфоокисления, дегалогенирования и другие реакции, приводящие к образованию водорастворимых метаболитов. В системе CYP существует 30—100 подтипов ферментов. Изоферменты, участвующие в метаболизме ксенобиотиков, относятся к 1, 2, 3 и 4 семействам CYP. Продукция апопротеинов CYP на уровне транскрипции гена координируется с продукцией фермента ALAS1, необходимого для гема, входящего в состав холофермента CYP. Следовательно, лекарства, вызывающие индукцию CYP, активируют транскрипцию гена ALAS1. У человека транскрипция почти всех ферментов CYP, вызванная действием лекарств, опосредуется конститутивным активным рецептором — андростановым рецептором (constitutively active receptor, CAR) и прегнановым Х рецептором (pregnane xenobiotic receptor, PXR). Лекарственное вещество, которое является лигандом для PXR или CAR, сразу же должно рассматриваться как потенциально порфириногенный препарат. Для проявления порфириногенного действия лекарственного препарата нужно, чтобы индуцируемый им объем апофермента CYP был достаточен, чтобы вызвать ALASl-катализ в митохондриях для продукции гема, необходимого для образования холофермента, а также достаточен, чтобы вызывать значительный расход гема в гепатоцитах. Помимо количества вещества, инициирующего этот процесс, большое значение имеет, какие подклассы CYP будут индуцироваться. Практически все порфириногенные лекарства являются индукторами CYP3A4 и/или CYP2C9, например противоэпилептические препа-раты, блокатор кальциевых каналов нифедипин, сульфадиазин, сульфаметоксазол и рифампицин, фунгицид кетоконазол, прогестерон, тестостерон. В то же время мощные индукторы CYP2E1, 2C19 и 1A1/1A2, например, циметидин, ацетилсалициловая кислота и омепразол, не представляют опасности для больных ОП. Некоторые порфириногенные вещества являются индукторами множества микросомальных ферментов печени, включая изоферменты CYP и уридиндифосфат-глюкуронозилтрансферазы (фенобарбитал, фенитоин, карбамазепин). Они воздействуют более чем на одну систему, поэтому их назвали многофункциональными индукторами. Их порфириногенность объясняется интенсивной транскрипцией гена ALAS1, запускаемой одновременной индукцией нескольких подклассов CYP.
Лекарственные препараты могут оказывать непосредственное влияние на синтетическую активность первого фермента цикла биосинтеза гема, в частности гормональные препараты. Например, такие препараты, как производное дезогестрела — регулон.
Лекарственные препараты могут ингибировать активность ферментов цепи биосинтеза. Например, уже упоминавшиеся, оральные контрацептивы.
Кроме перечисленных механизмов действия лекарственных препаратов существуют также разные пути регуляции активности системы биосинтеза гема как в целом, так и отдельных ее частей, что находит отражение в суточных колебаниях экскреции порфиринов и предшественников в моче у больных ОП. Это, в свою очередь, может временно создать более благоприятные предпосылки для реализации лекарственно-индуцированных порфириногенных эффектов.
Для проявления порфириногенности лекарственных препаратов необходимо, чтобы их концентрация в гепатоцитах была не ниже микромолярных. Следовательно, при суточных дозах в милли-граммовом диапазоне и ниже оказываемое воздействие на печень будет недостаточным, чтобы запустить порфириногенную транскрипцию ALAS1.Поэтому имеет значение не только сам факт назначения порфириногенного препарата, но и его дозы, а также путь введения. При пероральном приеме, например аминогликозидных антибиотиков, системное воздействие незначительное и не вызывает приступа ОП. Кроме того, после перорального приема лекарственный препарат подвергается метаболизму в кишечной стенке, что также уменьшает количество неметаболизированного вещества, попадающего в печень через воротную вену. Существуют значи-тельные индивидуальные различия в степени метаболизма ксенобиотика в кишечной стенке, что затрудняет прогноз нагрузки на печень на основании информации о дозе. Примерами таких лекарств служат сальбутамол, верапамил и лидокаин. Препараты попадают в кровь при аппликации на поверхность кожи, местном использовании: нанесении на поверхность кожи, конъюнктивального мешка, роговицы или слизистой оболочки влагалища, прямой кишки, рта или носа. Степень всасывания лекарственного препарата через слизистую прямой кишки, как правило, непредсказуема. Системное воздействие лекарств, которые не вводятся непосредственно в сосудистое русло, в большей степени зави-сит от васкуляризации ткани, т.е. от места инъекции. Подкожные и однократные периневральные инъекции в этом отношении эквивалентны. Ингаля-ционное введение препаратов, например жидких испаряющихся анестетиков и лекарств для лечения дыхательных путей, также может привести к попаданию в кровь липофильных веществ. Нераство-римые в воде вещества, применяемые в форме аэрозольного порошка, такие как кромогликат нат-рия, слабо абсорбируются, и их системным воздействием можно пренебречь. Скорость системной резорбции из спинномозговой жидкости зависит от степени связывания препарата с белками, которая различна у разных веществ. При эпидуральном вве-дении концентрация локального анестетика в спинномозговой жидкости намного выше, чем вплазме, а при интратекальном введении концентрация в плазме может не достичь предела определения. Таким образом, эффекты всасывания и распределения могут уменьшить порфириногенность лекарств.
Вопросы подбора лекарственной терапии при ОП актуальны не только в период лечения острого приступа болезни, основной целью которого является профилактика повторных атак на фоне лечения, но и на амбулаторном этапе. По нашим данным, до 40% случаев амбулаторных обращений больных ОП продиктованы появлением вопросов, связанных с лекарственной терапией, таких как:
— подбор лекарственных средств для лечения конкурирующих заболеваний и отсроченных осложнений ОП;
— подбор лекарственного обеспечения при беременности;
— подбор безопасных препаратов для проведения анестезии при плановых оперативных вмешательствах.
Таким образом, информация о порфириногенности различных лекарственных препаратов имеет важное значение. И здесь возможны две крайности. С одной стороны, незнание, недооценка или игнорирование порфириногенности препарата при его назначении могут привести к развитию острого приступа порфирии. С другой стороны, отказ от назначения иногда заведомо порфириногенного препарата по жизненным показаниям может нанести больший ущерб больному, чем его применение (например, назначение онкологических препаратов, в ряде случаев антибиотических препаратов и т. д.). В этих случаях порфириногенные препараты могут назначаться одновременно с аргинатом гема, что позволит уменьшить продукцию токсичных метаболитов порфиринового обмена либо может быть выбран альтернативный путь их введения, что уменьшит их системное действие (ингаляции, инстилляции и др.).
К сожалению, в настоящее время попытки прогнозировать порфириногенность того или иного лекарственного препарата лишь на основании знаний о его метаболизме не всегда успешны. Поэтому создаются списки порфириногенных и безопасных при порфирии препаратов на основании не только участия в их обмене системы цитохрома Р450, но и отдельных клинических сообщений, наблюдений. Эти списки публикуются в печати (http://www.porphyriafoundation.com/drug-database, http://www.porphyria-europe.com/02-for-healthcare/Abstracts/AbstractList.asp, http://porphyriadrugs.com) в виде баз данных, размещенных в интернете.
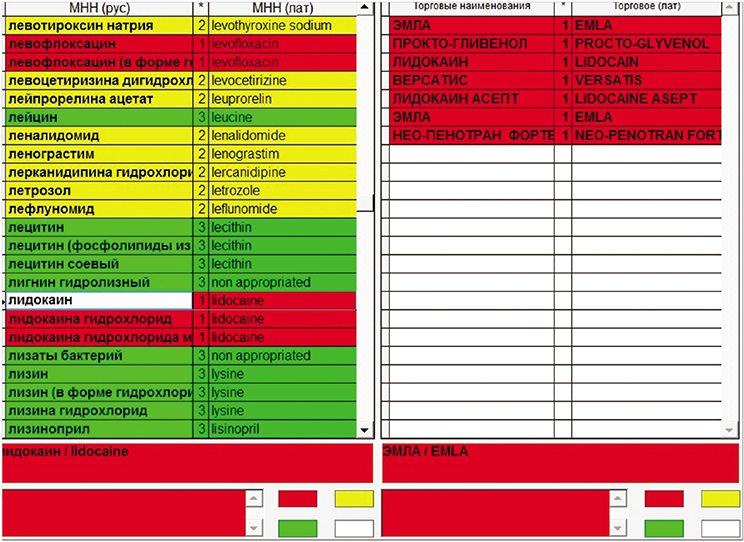
В ФГБУ Гематологический научный центр Минздрава РФ (ФГБУ НМИЦ гематологии МЗ РФ) накоплен один из самых больших клинических опытов лечения и наблюдения за больными ОП. За почти 20-летний период в ФГБУ НМИЦ гематологии МЗ РФ наблюдалось 163 больных с этим орфанным заболеванием, отмечено множество случаев провокации ОП различными лекарственными препаратами, и наш перечень порфириногенных препаратов далеко не всегда совпадает со списками, предлагаемыми зарубежными авторами. В ряде случаев до 15% препаратов, которые авторы (http://porphyriadrugs.com/search/?q=cefo, http://porphyriadrugs.com/search/?q=lido) считаютбезопасными, по нашим данным, провоцируют приступы ОП. Например, такие препараты, как кетонал, лидокаин, цефтриаксон, по данным сайта (http://porphyriadrugs.com) считаются безопасными при ОП, по нашим же данным, как и по данным ряда других авторов, эти препараты обладают сильным порфириногенным действием. Поэтому мы разработали собственную интернет-версию реестра опасных и безопасных для больных порфирией лекарственных препаратов, доступную для всех врачей, которая размещена на сайте ФГБУ НМИЦ гематологии МЗ РФ. За основу создаваемой базы был взят электронный справочный модуль лекарственных препаратов, любезно предоставленный редакцией издания «Видаль». Было проанализировано более четырёх тысяч наименований лекарственных средств, из которых отобраны препараты, использовавшиеся в лечении больных в ФГБУ НМИЦ гематологии МЗ РФ. Все препараты в зависимости от их порфириногенности выделены разными цветами. Красным цветом выделены лекарственным средства с высокой порфириногенностью, зеленым — безопасные препараты. Желтым цветом окрашены названия лекарств, порфириногенность которых до конца не выяснена. Их приема лучше избегать при наличии безопасного аналога. В базе данных возможен поиск, как по патентованным названиям лекарственных средств, так и по международным неторговым наименованиям (рис. 2).
Рис. 2. Скриншот реестра, на основе модуля лекарственной базы издания «Видаль».
Зеленым цветом выделены разрешенные лекарственные препараты, красным — с высокой порфириногенной активностью, желтым — с недостаточными сведениями о порфириногенности.
При назначении того или иного препарата необходимо учитывать, что по витальным показаниям заведомо порфириногенные препараты могут быть назначены одновременно с аргинатом гема. Степень риска гибели от заболевания не должна превышать степень риска развития приступа ОП при использовании порфириногенного средства. В первую очередь это касается терапии шоковых состояний, оказания реанимационного пособия, лечения онкологических заболеваний.
Порфириногенные препараты могут использоваться локально (аппликации, орошения, ингаляции). Поскольку многие инфекционные процессы имеют локальный характер, допустимо успешное использование, в том числе порфириногенных противомикробных средств.
Вакцины, сыворотки, моноклональные антитела считаются непорфириногенными, однако возникающие при их введении иммунологические реакции организма могут спровоцировать приступ ОП.
Предлагаемый реестр порфириногенных лекарственных препаратов носит рекомендательный характер. Принять окончательное решение о назначении того или иного препарата, проанализировав течение заболевания, может только лечащий врач. По мере появления дополнительной информации планируется обновлять реестр, вносить в него дополнения.