что не растворяет азотная кислота
Азотная кислота: химические свойства и применение
Смешивается с водой во всех соотношениях, при этом почти полностью диссоциирует на ионы и образует азеотропную смесь. При нагревании и на свету начинает разлагаться на оксид азота и воду, приобретая при этом бурую окраску. Чем выше температура и концентрация реагента, тем быстрее идет разложение.
Разбавленный реагент взаимодействует с щелочноземельными металлами, цинком и железом с окислением до аммиачной селитры или аммиака. С другими металлами и неметаллами проявляет взаимодействие с образованием оксида азота.
Смесь одного объема азотной кислоты с тремя объемами соляной называется «царской водкой». Это соединение способно растворять металлы, в том числе платину и золото. Его сильные окислительные свойства обусловлены образующимися хлоридом нитрозила и атомарным хлором.
Где применяется азотная кислота?
Этот реагент является одним из наиболее востребованных во многих отраслях промышленности. В частности, он используется для производства комбинированных и азотных удобрений (аммиачной, натриевой, калиевой и кальциевой селитры, нитрофоски, нитрофоса), взрывчатых веществ (тринитротолуола и пр.), ракетной техники, различных сернокислых солей и органических красителей.
В цветной и черной металлургии применяется для травления и растворения металлов, разделения серебра и золота. В органическом синтезе широко используют соединение серной и концентрированной азотной кислоты – «нитрующей смеси».
Также материал применяют для изготовления полупродуктов для получения искусственных красителей и других химикатов, в химической и полиграфической промышленностях. Он используется и при гальванизации, хромировании и никелировании деталей, в электротехнической и молочной отраслях.
Где приобрести?
Мы реализуем высококачественные химпрепараты по самым выгодным ценам. Убедитесь в этом: просто нажмите на кнопку «заказать» рядом с фотографией товара и введите ваши контакты. Мы свяжемся с вами в ближайшее время для уточнения деталей.
Азотная кислота
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.
В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
Чистая азотная кислота впервые была получена действием на селитру концентрированной серной кислоты:
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.
При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.
Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.
Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы.
Al + HNO3(конц.) ⇸ (реакция не идет)
При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается.
Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
Нитрат аммония получают реакция аммиака с азотной кислотой.
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Азотная кислота
Свойства азотной кислоты
Азотная кислота
Безводная азотная кислота — бесцветная летучая жидкость (t кип=83 °С; из-за летучести безводную азотную кислоту называют «дымящей») с резким запахом.
Один объем азотной и три объема соляной кислоты образуют соединение, называемое «царской водкой». Она способна растворять металлы (платину и золото), нерастворимые в обычных кислотах. При внесении в эту смесь бумаги, соломы, хлопка, произойдёт энергичное окисление, даже воспламенение.
При кипячении она раскладывается на составляющие компоненты (химическая реакция разложения):

(при нагревании выделяется бурый газ)
Cвойства азотной кислоты
Cвойства азотной кислоты могут быть разнообразными даже при реакциях с одним тем же веществом. Они напрямую зависят от концентрации азотной кислоты. Рассмотрим варианты химических реакций.
— азотная кислота концентрированная:
Со всеми остальными металлами при химической реакции выделяется бурый газ (NO2). Например, при химической реакции с медью (Cu):
4HNO3 конц. + Cu = Cu(NO3)2 + 2NO2 + H2O
С неметаллами, например с фосфором:
5HNO3 конц. + P = H3PO4 + 5NO2 + H2O
— разложения солей азотной кислоты
В зависимости от растворённого металла разложение соли при температуре происходит следующими образом:
Любой металл (обозначен как Me) до магния (Mg):
MeNO3 = MeNO2 + O2
Любой металл от магния (Mg) до меди (Cu):
MeNO3 = MeO + NO2 + O2
Любой металл после меди (Cu):
MeNO3 = Me + NO2 + O2
— азотная кислота разбавленная:
— химическая реакция с оксидами металлов, например, оксид кальция:
— химическая реакция с гидроксидами (или основаниями), например, с гашеной известью
— химическая реакция с солями, например с мелом:
Только контактные линзы acuvue moist помогут вам со зрением.
Азотная кислота. Свойства, добыча, применение и цена азотной кислоты
В полумраке же, кислота с водой легко смешивается в любых пропорциях. У вещества есть и кристаллическое состояние.
Оно может быть моноклинным и ромбическим. Это указывает на форму ячеек кристаллической решетки.
Моноклинная составлена из наклоненных параллелепипедов, а ромбическая, соответственно, из ромбов.
Свойства азотной кислоты
В обычных условиях кристаллическую кислоту можно лицезреть лишь в жарких странах.
В твердое состояние бесцветная жидкость переходит лишь при 42-ух градусах Цельсия. До этой отметки вещество остается жидким и парит.
При этом, реагент источает резкий, удушливый запах. С ним, собственно, связана история открытия азотной кислоты. Обнаружил ее Даниэль Резерфорд.
Ученый отметил, что вещество не поддерживает горение и непригодно для дыхания.
Позже, выяснилась формула азотной кислоты: — HNO3. Получается, вещество одноосновное.
Поэтому, существует концентрированная азотная кислота и неконцентрированная.
Первая активно дымит, то есть, летуча. Химические свойства концентрата разнятся с разбавленой версией.
Отсюда вывод, в какой таре нужно хранить вещество. Золотые и платиновые фляги, конечно, не выгодны.
А вот емкости из железа и алюминия и бюджетны, и надежны, поскольку закрывают кислоту от света. Главное, не выбрать тару из меди. Азотная кислота ее растворит.
Реагируя с металлами, концентрированный раствор азотной кислоты выделяет бурый газ. Его формула: — NО2.
Параллельно, образуются соли кислоты. В зависимости от растворенного металла, реакции разнятся.
Если к кислоте присоединится соль любого металла после меди, металл отделится. Вместе с ним выделяются бурый газ и кислород.
Разбавленная азотная кислота реагирует с большинством тех же металлов, но, окисляется при этом до аммиака.
К такому исходу приводит взаимодействие, к примеру, с цинком и элементами щелочноземельной группы. В реакцию вступает и железо.
Так что, разбавленную кислоту в емкостях из сплавов с феррумом лучше не хранить.
Самый редкий вариант – закись азота. Ее даст, к примеру, реакция с магнием. С остальными металлами азотная кислота образует оксид азота.
По этой же схеме проходят реакции кислоты с неметаллами, только, вместо солей формируется серная кислота.
Ее так назвали, поскольку вещество растворяет даже золото – металл правителей, сильных мира сего.
Добыча азотной кислоты
В малых количествах вещество возможно добывать даже из воздуха, причем, в прямом смысле. Не секрет, что азот – одна из составляющих атмосферы.
Он-то и реагирует с водой, взвесь которой, как известно, имеется в воздухе. Вступая в контакт с облаками, туманом, бурый газ переходит в азотную кислоту.
Массовая доля азотной кислоты в атмосфере столь мала, что вещество не наносит вред человеку, да и другим живым организмам.
Для промышленной добычи кислота из воздуха тоже не годится. На заводах пользуются иными схемами.
Первая: — производство азотной кислоты из аммиака. Сначала, проводят его конверсию, то есть, дробление состава исходной газовой смеси.
Реакция проходит на платинородиевых сетках при температуре около 1000 градусов Цельсия. Так получают оксид азота. Его окисляют до диоксида.
Это вторая стадия процесса. После, оксиды азота абсорбируют водой. В итоге, получается азотная кислота и чистая вода.
Описанный метод приводит к образованию разбавленной кислоты. Возможна последующая концентрация.
Поэтому, метод наиболее популярен, ведь потребителям нужна, как насыщенная, так и ненасыщенная кислоты.
Работая с аммиаком, промышленники «убивают одним выстрелом двух зайцев».
Второй метод производства реактива приводит сразу к получению концентрата. Речь о прямом синтезе из оксидов азота. Берут жидкие.
Они взаимодействуют с водой и кислородом. Такие реакции с азотной кислотой проходят под давлением в 5 мегапаскалей.
Получается диоксид азота. В обычных условиях он переходит в жидкое состояние. Окисление аммиака дает двойной оксид азота.
В газовой смеси его около 11%. Сжижжают диоксид под давлением. При стандартных условиях переход невозможен.
Применение азотной кислоты
Прежде чем апробировать и продать драгоценный металл, его нужно добыть. В этом тоже помогают азотная кислота и царская водка.
Ими обрабатывают руды, выводя нужные элементы в раствор. Остается осадить металлы и осушить, очистить от примесей. Так добывают не только благородные, но и неблагородные элементы.
Ее примешивают к топливу, получая оксид. Азотная кислота выступает в роли окислителя.
В его присутствии процесс сгорания эффективнее, выделяется больше тепла. Так что, часть реагента производят для ракетного топлива.
Все это соли, объединенные названием «селитры». Азот позволяет растениям быстро развиваться, повышает урожайность.
Чем больше освоенной энергии, тем лучше развитие трав, кустарников, деревьев.
Слово «селитра» на слуху и у пиротехников. Азотная кислота – основа взрывчатых веществ.
Цена азотной кислоты
Азотная кислота, как и большинство востребованных кислот, бывает чистой и технической, отягощенной примесями. Последняя дешевле.
Чистый реагент дороже. Для справки, ГОСТ 4461-77 – норма для очищенной кислоты.
Реагент российского производства стоит в районе 30-55-ти рублей за килограмм. Ценник зависит от концентрации раствора.
Для технической кислоты верхний ценовой предел, обычно, составляет 40 рублей за кило. Предусмотрена и большая фасовка.
Есть, к примеру, 25-литровые канистры, в которые разливается азотная кислота.
Купить реагент с максимальной выгодой позволяют оптовые заказы. Такие уходят на предприятия, где знают правила обращения с реагентом.
Он разъедает не только металлы, но и слизистые. Пары вещества могут затруднить дыхание, повредить трахеи, выстилающие ткани носа.
Поэтому, с кислотой работают лишь в масках. При нарушении правил, кроме трудностей с дыханием, наступает отравление.
Интоксикация выражается в рвоте, чесотке, нарушениях зрения, обоняния. Более-менее безобидны лишь слабые растворы реагента.
Именно такие, к примеру, используют в школьных лабораториях. Учиться обращению с химическими реагентами стоит с малых лет.
Азотная кислота
Азо́тная кислота́ (HNO3), — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентрацией 68,4 % и tкип120 °C при атмосферном давлении. Известны два твёрдых гидрата: моногидрат (HNO3·H2O) и тригидрат (HNO3·3H2O).
Физические и физико-химические свойства
При кристаллизации из водных растворов азотная кислота образует кристаллогидраты:
Твёрдая азотная кислота образует две кристаллические модификации:
Плотность водных растворов азотной кислоты как функция её концентрации описывается уравнением
где d — плотность в г/см³, с — массовая доля кислоты. Данная формула плохо описывает поведение плотности при концентрации более 97 %.
Химические свойства
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
HNO3 как сильная одноосновная кислота взаимодействует:

в) вытесняет слабые кислоты из их солей:
При кипении или под действием света азотная кислота частично разлагается:
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
б) с металлами, стоящими в ряду напряжений левее водорода:


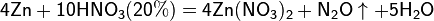

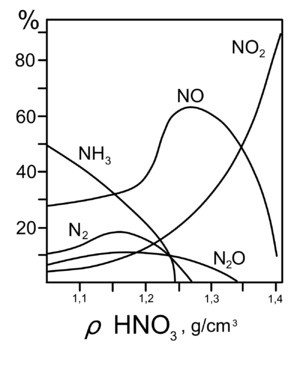
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение концентрации кислоты 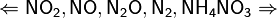
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:

Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:



и сложные вещества, например:
Некоторые органические соединения (например амины, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Некоторые металлы (железо, хром, алюминий, кобальт, никель, марганец, бериллий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж».
Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:


Нитраты
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется.
Соли азотной кислоты при нагревании необратимо разлагаются, причём состав продуктов разложения определяется катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии являются сильными окислителями, например, при сплавлении твердых веществ:
Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
С азотной кислотой не реагируют стекло, фторопласт-4.
Исторические сведения
Методика получения разбавленной азотной кислоты путём сухой перегонки селитры с квасцами и медным купоросом была, по видимому, впервые описана трактатах Джабира (Гебера в латинизированных переводах) в VIII веке. Этот метод с теми или иными модификациями, наиболее существенной из которых была замена медного купороса железным, применялся в европейской и арабской алхимии вплоть до XVII века.
В XVII веке Глаубер предложил метод получения летучих кислот реакцией их солей с концентрированной серной кислотой, в том числе и азотной кислоты из калийной селитры, что позволило ввести в химическую практику концентрированную азотную кислоту и изучить её свойства. Метод Глаубера применялся до начала XX века, причём единственной существенной модификацией его оказалась замена калийной селитры на более дешёвую натриевую (чилийскую) селитру.
Во времена М. В. Ломоносова азотную кислоту называли крепкой водкой.
Промышленное производство, применение и действие на организм
Азотная кислота является одним из самых крупнотоннажных продуктов химической промышленности.
Производство азотной кислоты
Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой


Концентрация полученной таким методом азотной кислоты колеблется в зависимости от технологического оформления процесса от 45 до 58 %.
Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса:
Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой:
Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды.
Применение
Действие на организм
Азотная кислота и её пары очень вредны: пары вызывают раздражение дыхательных путей, а сама кислота оставляет на коже долгозаживающие язвы. При действии на кожу возникает характерное желтое окрашивание кожи, обусловленное ксантопротеиновой реакцией. При нагреве или под действием света кислота разлагается с образованием высокотоксичного диоксида азота NO2 (газа бурого цвета). ПДК для азотной кислоты в воздухе рабочей зоны по NO2 2мг/м