что не относится к иммунобиологическим лекарственным препаратам
Правила обращения ИЛП в аптеках. Часть 1
Иммунобиологические препараты (ИЛП) – особая группа среди лекарственных препаратов, при обращении которой помимо общих требований необходимо соблюдать специальные правила перевозки, хранения, отпуска из аптеки в медицинские организации и отпуска их по рецептам населению. Специфика данной группы препаратов связана с их особой термолабильностью. Нарушение условий хранения является одной из основных причин развития поствакцинальных осложнений. По этой причине тема обращения ИЛП так широко освещена в наших курсах повышения квалификации и профессиональной переподготовки провизоров и фармацевтов.
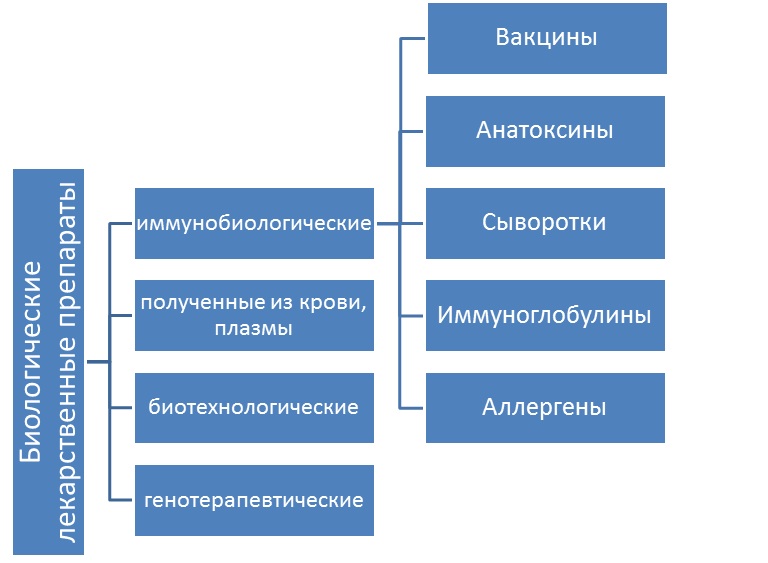
К иммунобиологическим препаратам относятся лекарственные препараты, предназначенные для формирования активного или пассивного иммунитета либо диагностики наличия иммунитета или диагностики специфического приобретенного изменения иммунологического ответа на аллергизирующие вещества. Иммунобиологическими лекарственными препаратами являются: вакцины, анатоксины, токсины, сыворотки, иммуноглобулины и аллергены (пункт 7 статьи 4 федерального закона от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств»).
Основным (но не единственным) документом, регламентирующим обращение ИЛП, являются санитарно-эпидемиологические правила СП 3.3.2.3332-16 «Условия транспортирования и хранения иммунобиологических лекарственных препаратов» (далее СП 3.3.2.3332-16), утвержденные Постановлением Главного Санитарного врача РФ от 17.02.2016 № 19.
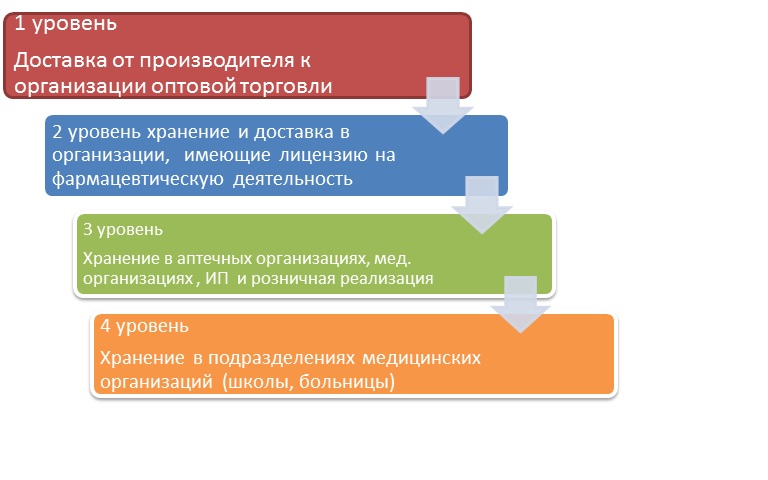
Требования нормативных документов при обращении ИЛП, направлены на соблюдение «холодовой цепи» – комплекса мероприятий по обеспечению оптимальных условий транспортирования и хранения ИЛП на всех этапах их движения от производителя до потребителя. «Холодовая цепь» состоит из четырех уровней, место аптечных организаций в этой системе: 3-й уровень.
Обращаем внимание, что, согласно пункту 3 «Правил отпуска ЛП…», утвержденных Приказом Минздрава РФ от 11.07.2017г. № 403н, отпускать ИЛП по рецептам могут только аптеки и аптечные пункты. Дискриминация индивидуальных предпринимателей, имеющих лицензию на фарм.деятельность, при розничной продаже/отпуске ИЛП объясняется тем, что в пункте 3 статьи 12 Федерального закона от 17.09.1998г. № 157-ФЗ «Об иммунопрофилактике инфекционных болезней» ИП не упомянуты.
В СП 3.3.2.3332-16 (разделы VIII, VII) определены требования к сотрудникам, ответственным за «холодовую цепь»:
Должностным лицом, ответственным за «холодовую цепь» ведется:
— учет поступлений и отправлений ИЛП,
— регулярно контролируются показания термометров и термоиндикаторов (терморегистраторов),
— осуществляется контроль за условиями отпуска и транспортирования ИЛП на четвертый уровень при соблюдении температурного режима.
Сотрудник, осуществляющий регистрацию поступления и отправления ИЛП, должен пройти инструктаж (на рабочем месте) по вопросам соблюдения условий хранения и транспортирования ИЛП, работе с холодильным оборудованием и работе с приборами, регистрирующими изменения температурного режима (термометры, термоиндикаторы, терморегистраторы), о чем должна быть сделана соответствующая запись в журнале инструктажа.
Учитывая особенности обращения ИЛП, и требования пункта 8.6. СП 3.3.2.3332-16 имеет смысл разработать и утвердить в аптеке отдельную стандартную операционную процедуру (СОП):
СОП «Порядок работы с иммунобиологическими лекарственными препаратами».
Основные разделы СОП:
1. Порядок приемки ИЛП в аптеке.
2. Порядок хранения ИЛП:
— используемое оборудование
— размещение ИЛП в холодильном оборудовании
— контроль температурного режима
— порядок уборки холодильного и морозильного оборудования для хранения ИЛП.
3. Порядок учета поступления и отправления ИЛП
4. Порядок отпуска ИЛП в медицинские организации (структурные подразделения) (отправка на 4-й уровень «холодовой цепи») / порядок отпуска ИЛП по рецептам.
5. План проведения экстренных мероприятий по обеспечению «холодовой цепи» при чрезвычайных ситуациях.
Запрещается транспортировать ИЛП совместно с другими лекарственными средствами (пункт 4.4 СП 3.3.2.3332-16). Если перевозка ИЛП осуществлялась в авторефрижераторах, то при поступлении в аптеку представитель поставщика (перевозчика) должен предоставить распечатку показаний терморегистратора (прилагается к сопроводительным документам на ИЛП), подтверждающую соблюдение температурного режима за все время транспортировки.
При перевозке обычным автотранспортом термолабильных ИЛП используются термоконтейнеры различного типа.
При транспортировании ИЛП в термоконтейнерах для контроля температурного режима используются термоиндикаторы или терморегистраторы (встроенные или автономные), допускается использование термометров с встроенной памятью, которые фиксируют нарушение температурного режима. В каждый контейнер должен быть вложен термоиндикатор (терморегистратор), если время перевозки превышает 1 час. Термоиндикатор (терморегистратор) помещают в термоконтейнер согласно термокарте между упаковками с ИЛП. Требования к термометрам, терморегистраторам и термоиндикаторам описаны ниже.
При поступлении ИЛП в аптеку термоконтейнеры вскрывают и проверяют показания термоиндикатора или терморегистратора. В соответствии с требованиями «МУ 3.3.2.2437-09. 3.3.2. Медицинские иммунобиологические препараты. Применение термоиндикаторов для контроля температурного режима хранения и транспортирования медицинских иммунобиологических препаратов в системе «холодовой цепи». Методические указания», утвержденных Главным государственным санитарным врачом РФ 21.01.2009, к каждому электронному и химическому термоиндикатору должна прилагаться контрольная карточка.
Для контроля температурного режима используются также термоиндикаторы на флаконах (ФТИ). Они представляют собой наклейки из термочувсвительного материала, которые наносятся на первичную или вторичную упаковку ИЛП производителем.
Если же термоконтейнер снабжен терморегистратором, то необходимо распечатать его показания или скопировать данные на компьютер для дальнейшей распечатки и сохранения информации.
Если показания терморегистраторов или термоиндикаторов говорят о нарушении температурного режима при транспортировании, то сотрудник аптеки, осуществляющий приемочный контроль ИЛП должен доложить об этом руководителю, комиссия по приемке составляет акт о нарушении температурного режима, руководитель принимает решение об отказе в получении ИЛП. Дальнейший порядок возврата определяется условиями договора с поставщиком.
Если необходимые условия хранения подтверждены при транспортировке, то ИЛП выгружают из контейнеров и размещают в холодильниках в течение 10 минут. При приемочном контроле ИЛП, как и всех других ЛП, проверяют соответствие поступивших ИЛП данным в товарно-сопроводительных документах (наименование, количество, серии, сроки годности). Не допускается отгрузка ИЛП на третий уровень «холодовой цепи» (в аптеки) со сроком годности менее четырех месяцев (п. 8.10.3 СП 3.3.2.3332-16). Кроме того, необходимо проверить наличие поступивших ИЛП в базе данных Росздравнадзора о приостановленных или изъятых из обращения ЛП (электронный сервис «Поиск изъятых из обращения лекарственных средств» на сайте Росздравнадзора). Далее проводят визуальный осмотр поступивших ИЛП, проверяют целостность упаковки, соответствие маркировки, а также наличие сведений о документах, подтверждающих соответствие данных ИЛП.
В соответствии с пунктом 12 «Правил продажи отдельных видов товаров…», утвержденных Постановлением правительства РФ от 19.01.1998г. № 55, в товарно-сопроводительных документах указываются сведения о декларации о соответствии (регистрационный № декларации, срок её действия, наименование организации, принявшей декларацию, орган, её зарегистрировавший) или о сертификате соответствия (номер, срок его действия, орган, выдавший сертификат). Соответствие ИЛП в данный момент согласно Постановлению Правительства от 01.12.2009 г. № 982 «Об утверждении единого перечня продукции, подлежащей обязательной сертификации, и единого перечня продукции, подтверждение соответствия которой осуществляется в форме принятия декларации о соответствии» подтверждается декларацией или сертификатом в зависимости от группы ИЛП.
С 29.11.2019 г. отменяется обязательное подтверждение соответствия лекарственных препаратов, в том числе ИЛП, в форме декларирования/ сертификации (согласно федеральному закону от 28.11.2018 № 449-ФЗ). После 29.11.2019 г. ИЛП будут поступать в обращение после принятия Росздравнадзором разрешения о вводе ИЛП в гражданский оборот (статья 52.1 федерального закона от 12.04.2010г. № 61-ФЗ «Об обращении лекарственных средств»). Информация о сериях ИЛП, введенных в гражданский оборот будет публиковаться на сайте Росздравнадзора. Серии ИЛП, выпущенные до 29.11.2019 г., должны поступать в обращение с сертификатом или декларацией о соответствии.
При несоответствии поступивших ИЛП показателям приемочного контроля, их перемещают в карантинную зону, выделенную в холодильнике, и возвращают поставщику или передают на уничтожение.
Если поступившие ИЛП соответствуют установленным требованиям, то сотрудник, ответственный за «холодовую цепь» в аптеке регистрирует поступление ИЛП в Журнале учета движения ИЛП (Приложение 3 к СП 3.3.2.3332-16). В этот же журнал заносятся данные термоиндикаторов, которые использовались при транспортировке, и их показания («норма»).
Иммунобиологические лекарственные препараты – особенности хранения, перевозки и реализации

Иммунобиологические лекарственные препараты — лекарственные препараты, предназначенные для формирования активного или пассивного иммунитета либо диагностики наличия иммунитета или диагностики специфического приобретенного изменения иммунологического ответа на аллергизирующие вещества. В различных официальных источниках эти лекарственные средства именуются также аббревиатурой МИБП – медицинские иммунобиологические препараты. Особенностями работы с данной группой препаратов является движение по товаропроводящей цепи с обязательным соблюдением температурного режима, то есть по «холодовой цепи».
Согласно требованиям Государственной Фармакопеи 13-го издания, хранение иммунобиологических лекарственных препаратов должно осуществляться при температуре не выше 8 °С. К каждой упаковке иммунобиологического лекарственного препарата в холодильнике должен быть обеспечен доступ охлажденного воздуха. Не допускается совместное хранение в холодильнике иммунобиологических лекарственных препаратов с другими лекарственными средствами.
К МИБП относятся только вакцины, анатоксины, сыворотки, иммуноглобулины и аллергены. К МИБП не относятся пробиотики (синоним – эубиотики), средства, содержащие непатогенные бактерии и нормализующие микрофлору организма человека. Например, Фемафлор, содержащий эубиотик, эстриол и прогестерон, относится, согласно информации из Государственного реестра лекарственных средств, к другим препаратам для лечения гинекологических заболеваний. А лекарственные средства «Бифиформ», «Бифидумбактерин сухой» относятся к фармакотерапевтической группе «Антидиарейные микроорганизмы». Цитокины (например, интерфероны) также не относятся к МИБП, соответственно их перевозка и хранение осуществляются по другим правилам.

Иммунопрофилактика: основные понятия
Профилактические прививки против инфекционных заболеваний на сегодняшний день – наиболее эффективный и безопасный метод предупреждения возникновения данной патологии.
Профилактические прививки— введение в организм человека медицинских иммунобиологических препаратов для создания специфической невосприимчивости к инфекционным болезням.
К иммунобиологическим лекарственным препаратам (ИЛП) относят биологически активные вещества, вызывающие состояние иммунологической защиты, изменяющие функции иммунной системы, либо необходимые для постановки иммунодиагностических реакций.
Все ИЛП, применяемые для профилактики инфекционных заболеваний, разделяют на три группы:
— создающие активный иммунитет;
— обеспечивающие пассивную защиту;
— предназначенные для экстренной профилактики или превентивного лечения инфицированных лиц.
Законодательной основой осуществления иммунопрофилактики в нашей стране является Федеральным законом от 17 сентября 1998 г. № 157-ФЗ «Об иммунопрофилактике инфекционных болезней».
Данный закон устанавливает правовые основы государственной политики в области иммунопрофилактики инфекционных болезней, осуществляемой в целях охраны здоровья и обеспечения санитарно-эпидемиологического благополучия населения Российской Федерации.
Указанным законом определен ряд основополагающих моментов:
— государственная политика в области иммунопрофилактики, включая гарантии гражданам (доступность профилактических прививок, бесплатное проведение профилактических прививок, включенных в национальный календарь, социальная поддержка граждан при возникновении поствакцинальных осложнений, использование для осуществления иммунопрофилактики эффективных медицинских иммунобиологических препаратов);
— права и обязанности граждан при осуществлении иммунопрофилактики;
— финансовое обеспечение иммунопрофилактики;
— организационные основы деятельности в области иммунопрофилактики;
— требования к Национальному календарю профилактических прививок;
— требования к проведению профилактических прививок;
— требования к медицинским иммунобиологическим препаратам, их хранению и транспортировке;
— государственный контроль медицинских иммунобиологических препаратов;
— порядок обеспечения медицинскими иммунобиологическими препаратами;
— социальная поддержка граждан при возникновении поствакцинальных осложнений.
Национальный календарь профилактических прививок– государственный нормативный акт, определяющий перечень инфекционных заболеваний, предупреждаемых иммунопрофилактикой, сроки и схемы проведения профилактических прививок, а также категории граждан, подлежащих обязательной вакцинации.
Конкретный порядок реализации Национального календаря прививок определен:
— приказом Министерства здравоохранения России от 21 марта 2014 г. № 125н «Об утверждении Национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям»;
— приказом Министерства здравоохранения России от 16 июня 2016 года № 307н, внесшего отдельные изменения в Национальный календарь.
Национальный календарь прививок состоит из двух разделов:
— базовый Национальный календарь;
— календаря профилактических прививок по эпидемическим показаниям.
Плановые прививки в соответствии с Национальным календарем проводятся:
— детскому населению против следующих заболеваний: туберкулеза, коклюша, дифтерии, кори, эпидемического паротита, полиомиелита, столбняка, вирусного гепатита В, краснухи, гемофильной инфекции, пневмококковой инфекции, гриппа.
Прививки по эпидемическим показаниям (угроза распространения заболеваний на конкретной территории, либо профессиональные группы риска, предстоящая поездка в неблагополучный район):против туляремии, сибирской язвы, бруцеллеза, лихорадки Ку, лептоспироза, бешенства, клещевого энцефалита, желтой лихорадки, вирусного гепатита А, менингококковой инфекции, ветряной оспы, брюшного тифа, ротавирусной инфекции, шигеллеза Зонне, пневмококковой инфекции (взрослые из групп риска).
Также, проводится экстренная вакцинопрофилактика контактным лицам, в очагах следующих инфекционных заболеваний:корь, эпидемический паротит, дифтерия, менингококковая инфекция, полиомиелит, столбняк.
Новые СанПиНы: туман в холодильнике
Самвел Григорян о температурном режиме транспортировки и хранения иммунобиологических препаратов (ИЛП)
В середине текущего года вступили в силу новые Санитарно-эпидемиологические правила «Условия транспортировки и хранения иммунобиологических препаратов» (СанПиН 3.3.2.3332–16). Они утверждены Постановлением главного государственного санитарного врача РФ от 17.02.2016 № 19. Тема о правилах хранения иммунобиологических препаратов заслуживает отдельного внимания, поскольку речь идет о препаратах, требующих не просто особого, а, если так можно выразиться, «суперособого» обращения, и ошибки в работе с ними могут обернуться и существенными проблемами для потребителей-пациентов, и внушительными административными санкциями для фармацевтических и медицинских организаций.
Что такое ИЛП?
Тема иммунобиологических лекарственных препаратов (далее также — ИЛ-препараты или ИЛП) в начале осени более чем актуальна. Переход от тепла к холоду, от солнца к пасмурности и дождям, от отдыха к напряженной работе — рискованный период для иммунитета. Летняя нега сменяется осенними простудами, которым особенно подвержены ослабленные организмы.
Для начала ответим на вопрос, что такое ИЛП и какие препараты относится к иммунобиологическим? Это далеко не праздный вопрос, потому что фармспециалисты, работающие в аптечном и дистрибьюторском сегментах, нередко спрашивают, как определить принадлежность к ИЛП того или иного препарата.
Согласно п. 7 понятийной ст. 4 Федерального закона «Об обращении лекарственных средств» (№ 61‑ФЗ от 12.04.2010), под этим понятием имеются в виду лекарственные препараты, предназначенные для формирования активного или пассивного иммунитета либо диагностики наличия иммунитета или диагностики специфического приобретенного изменения иммунологического ответа на аллергизирующие вещества. Соответственно, их применяют с лечебными, профилактическими и диагностическими целями.
Согласно упомянутому пункту Закона № 61ФЗ, в список иммунологических препаратов входят вакцины, анатоксины, токсины, сыворотки, иммуноглобулины и аллергены. В этом вопросе между Законом «Об обращении лекарственных средств» и Общей фармакопейной статьей «Иммунологические лекарственные препараты» (ОФС.1.8.1.0002.15) существует противоречие. Последняя к перечню медицинских иммунобиологических относит и другие лекарственные препараты биологической природы: бактериофаги, пробиотики, цитокины, включая интерфероны, ферменты микробов и т. д., а также препараты, произведенные путем биотехнологических процессов, в том числе с применением методом генетической инженерии.
Так каким же из этих нормативно-правовых актов руководствоваться? Здесь фармспециалистам можно порекомендовать придерживаться примата Закона № 61‑ФЗ, поскольку остальные нормативно-правовые акты, включая Государственную фармакопею, разрабатываются и принимаются для исполнения его норм. Поэтому требования, предъявляемые законодательством к условиям хранения и транспортировки медицинских иммунобиологических препаратов — о них пойдет речь ниже, — не распространяются на пробиотики, бактериофаги, цитокины, включая интерфероны, ферменты микробов.
Наверняка Минздрав проводит работу по приведению норм и терминов различных нормативно-правовых актов в соответствие с положениями Федерального закона № 61ФЗ. Но если перейти с сухого языка юриспруденции на живой человеческий… По-хорошему, для фармспециалистов-практиков было бы проще, если каждая упаковка ИЛП была бы промаркирована каким‑либо идентифицирующим знаком или хотя бы аббревиатурой «ИЛП», говорящей о том, что он относится к списку иммунобиологических препаратов.
ИЛП выпускаются в разных лекарственных формах: таблетки, капсулы, гранулы, порошки, лиофилизаты, растворы, суспензии, суппозитории, мази. ИЛ-препараты очень лабильны, поэтому с ними сложно и ответственно работать. Например, нарушение правил и условий хранения вакцин является одной из основных причин развития поствакцинальных осложнений. Уже одно это говорит о важности темы надлежащего обращения с этой группой препаратов на всех производственных, логистических этапах, а также при хранении биопрепаратов в лечебных и аптечных учреждениях.
Четыре уровня холода
Начнем с того, где прописаны эти самые требования к иммунобиологическим препаратам. В приказе Минздравсоцразвития РФ от 23.08.2010 № 706н «Об утверждении правил хранения лекарственных средств» они ни разу не упоминаются. В п. 32 этого нормативно-правового акта содержится лишь общее указание о том, что термолабильные лекарственные средства должны храниться в соответствии с температурным режимом, указанном на первичной и вторичной упаковках. ИЛП, конечно, относятся к этой группе лекарственных средств, но даже среди термолабильных препаратов они составляют особую группу, так что данного указания явно недостаточно для организации их надлежащего хранения.
Более содержательные и детальные нормы, регламентирующие условия хранения иммунобиологических препаратов можно найти, в частности, в Государственной фармакопее РФ. Выделим из ОФС.1.1.0010.15 «Хранение лекарственных средств» то, что касается рассматриваемой темы. В данной фармакопейной статье в первую очередь отмечено, что надлежащее качество ИЛП, безопасность и эффективность их применения обеспечивается системой «холодовой цепи» в комплексе, то есть всеми четырьмя ее уровнями. Их перечисление содержится в разделе II упомянутых выше Санитарно-эпидемиологических правил (далее — Правила).
Первый уровень «холодовой цепи» — доставка ИЛП от производителя до оптового звена, включая этап таможенного оформления. Второй — хранение препаратов данной группы организациями оптовой торговли лекарственными средствами и их доставка до аптечных и медицинских организаций (включая индивидуальных предпринимателей, имеющих лицензию на фармацевтическую или медицинскую деятельность), а также до других фармдистрибьюторов. Третий уровень — хранение ИЛП этими самыми аптечными, медицинскими организациями и предпринимателями, их розничная реализация, а также доставка до других медицинских организаций или их обособленных подразделений (участковые больницы, поликлиники, амбулатории, родильные дома). Соответственно, четвертый уровень — хранение иммунобиологических препаратов и организация холодовой цепи в аптеке и в медицинских учреждениях.
От двух до восьми… по Цельсию
Из ОФС.1.1.0010.15 и ОФС.1.8.1.0002.15, а также из пп. 3.2 и 3.5 СанПиНа следует, что ИЛП необходимо хранить при температуре от +2 °C до +8 °C, если иное не указано в инструкции по применению или иной нормативной документации. То есть речь идет об обеспечении режима хранения, который в ГФ назван «холодным местом». Что касается транспортирования иммунобиологических лекарственных препаратов, то в ОФС.1.8.1.0002.15 подчеркивается, что его температурные и другие условия не должны отличаться от таковых для хранения ИЛП. Таким образом, условия транспортировки и хранения иммунобиологических лекарственных средств совпадают.
Помещения, в которых размещаются холодильники для хранения ИЛП, не должны перегреваться выше +27 °C. В ОФС.1.1.0010.15 также определено, что к каждой упаковке ИЛП в холодильнике должен быть обеспечен доступ охлажденного воздуха. Напомним в связи с этим, что современные фармацевтические холодильники оснащены соответствующими системами циркуляции воздушных потоков. Кроме того, для соблюдения данной нормы упаковки ИЛ-препаратов не следует нагромождать друг на друга.
Следует также иметь в виду, что ОФС.1.1.0010.15 и п. 6.19 Правил не позволяют хранить ИЛП на дверной панели холодильника. Логика этого запрета понятна — температура воздуха в этой части холодильного устройства выше, чем в других его частях, соответственно, и выше риск выйти за рамки +8 °C. Однако, данная норма для тех, кто использует не обычные, а фармацевтические холодильники мало актуальна.
Напустили тумана
Следующую фармакопейную норму ОФС.1.1.0010.15 необходимо процитировать дословно: «не допускается совместное хранение в холодильнике иммунобиологических лекарственных препаратов с другими лекарственными средствами». Почти вторит этой норме аналогичное указание п. 8.12.1 СанПиНа про хранение иммунобиологических препаратов: «не допускается совместное хранение вакцин в холодильнике с другими лекарственными средствами».
Как известно, наше законодательство содержит немало туманных норм, которые можно толковать и так, и эдак. Их порой затрудняются разъяснить даже юристы. А проверяющие этой неоднозначностью могут воспользоваться. Сделаешь так — скажут, что надо было эдак; ну а сделаешь эдак — выяснится, что следовало так.
Норму СанПиНа про иммунобиологические препараты 2016 года «не допускается совместное хранение вакцин в холодильнике…», которую мы только что изложили, похоже, можно отнести к таким «туманностям Андромеды». Данное требование к хранению вакцин и иммунобиологических препаратов воспринимается по-разному, одни понимают это следующим образом: ИЛП и другие термолабильные препараты необходимо хранить на разных полках холодильника. Но некоторые обращают внимание на иную возможную трактовку данной нормы: для хранения ИЛ-препаратов следует выделить отдельный аптечный холодильник.
Имеются сигналы от аптечных работников о том, что проверяющие в ходе отдельных контрольных мероприятий придерживались второй точки зрения. Поэтому можно рекомендовать аптекарям для пущей надежности следовать именно ей.
Проблема здесь в том, что во многих, если не в большинстве аптек, ИЛ-препараты составляют очень небольшую долю ассортимента (ведь традиции аптечного участия в иммунопрофилактических процессах у нас не развиты). Иногда это всего несколько или даже два-три наименования. Ведь в обязательном «минимальном ассортименте» ИЛП отсутствуют. Приобрести и содержать отдельный дорогой аптечный холодильник для нескольких единиц ассортимента — как правило, не относящихся к лидерам продаж — очень накладно. Проще вообще отказаться от приобретения этих «хлопотных» ассортиментных позиций. Проще, но не лучше. А лучше было бы, если наши регуляторы прояснили бы данную норму.
Путешествие в контейнере
Все тонкости оптимального температурного режима хранения вакцин и ИЛ-препаратов изложены в новых правилах СанПиН по иммунобиологических препаратах 2016 года, на которые мы неоднократно ссылаемся. Их много, и в рамках одной статьи такой большой объем норм не охватить. Поэтому можно рекомендовать фармспециалистам отдельно внимательно изучить все условия транспортирования и хранения медицинских иммунобиологических препаратов.
Отсюда рекомендация аптечным работникам, получающим товар от представителя компании-перевозчика, — не принимать препараты этой группы, если они были доставлены в общем коробе с другими лекарствами (тем более требующими другого температурного режима) или если имеются обоснованные сомнения в том, что в ходе транспортирования были нарушены температурные рамки, обозначенные в ГФ и Правилах.
Термометры: сколько и где?
Температуру хранения вакцин в холодильнике необходимо не только поддерживать, но и проверять, фиксировать. Для этих целей при транспортировании и хранении списка иммунобиологических лекарственных препаратов используются: средства измерения температуры, а именно автономные или встроенные электронные термометры, термографы, терморегистраторы, а также средства выявления нарушений температурного режима, то бишь термоиндикаторы. Разумеется, они должны использоваться на всем протяжении пути ИЛ-препарата — от его закладки в упаковочную тару до получения пользователем, для обеспечения сквозного непрерывного температурного контроля, начиная от момента производства через все этапы транспортирования и все периоды хранения.
Нас прежде всего интересует аптечный аспект темы. Согласно п. 6.22 Правил, для целей надлежащего хранения списка иммунобиологических препаратов в аптеке холодильник, помимо встроенного термометра, должен быть оснащен двумя автономными термометрами и двумя термоиндикаторами. Они размещаются парами «один термометр и один термоиндикатор» рядом друг с другом непосредственно на полках холодильника или на коробках с ИЛП в двух контрольных точках каждой камеры холодильника: наиболее «теплой» и наиболее «холодной».
Первой из них считается та, которая наиболее удалена от источника холода. Второй, согласно СП об условиях транспортировки и хранения иммунобиологических препаратов, является та, которая наиболее подвержена замораживанию, с оговоркой «не ближе 10 см к источнику холода».
Этот пункт Правил, похоже, тоже не лишен тумана, поскольку простой математический подсчет показывает, что на одну камеру понадобится в общей сложности два автономных термометра и два термоиндикатора. Но ведь фармацевтические холодильники бывают и двухкамерными. Но это обстоятельство никак не отражено в п. 6.22 Правил. В любом случае можно рекомендовать руководителям аптек оснащать парой «автономный термометр и термоиндикатор» наиболее холодные и наиболее теплые точки каждой камеры холодильника.
Согласно п. 7.10 Правил, контроль показаний каждого термометра осуществляется дважды в сутки, в начале и конце рабочего дня. Они регистрируются в специальном журнале мониторинга температурного режима хранения вакцин в холодильнике, который заполняется отдельно на каждый холодильник. На форс-мажорный случай — отключение электричества, выход из строя холодильника, в котором хранятся ИЛП — необходимо иметь в аптеке термоконтейнер (ы) с запасом хладоэлементов.
В заключение отметим, так как условия транспортирования и хранения иммунобиологических препаратов разнятся, то, что в отношении каждого ИЛ-препарата прежде необходимо посмотреть, не прописаны ли или не допускаются ли для него иные, чем режим «от +2 °C до +8 °C», правила хранения вакцин в холодильнике. Например, есть такие ИЛП, которые, согласно инструкции по их применению, должны храниться в замороженном состоянии (п. 6.25 Правил). Остальные же необходимо беречь от замораживания — например, не размещать их на траектории потока холодного воздуха с температурой ниже +2 °C.
Что же касается мер административного наказания за нарушение правил хранения и транспортировки иммунобиологических препаратов по СанПиН, то надо отметить, что этот вид нарушений относится к категории грубых нарушений лицензионных требований. Соответственно, на сегодняшний день он влечет за собой наложение: на индивидуальных предпринимателей — административного штрафа (АШ) в размере от 4000 до 8000 руб. или административное приостановление деятельности (АПД) на срок до 90 суток; на должностных лиц — штраф от 5000 до 10 000 руб.; на юридических лиц — от 100 000 до 200 000 руб. или приостановление деятельности на срок до 90 суток (п. 4. ст. 14.1 КоАП РФ).
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.