что называется степенью окисления
Валентность и степень окисления
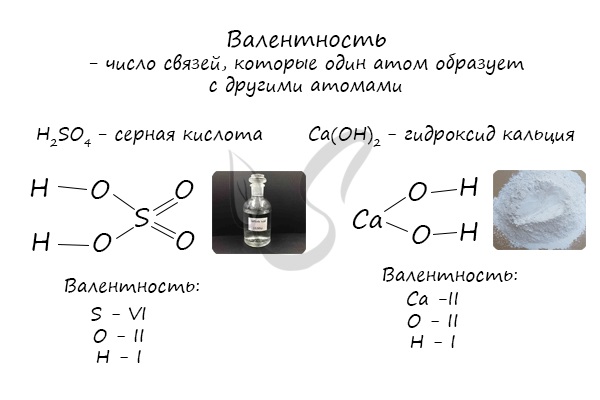
Валентность
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы
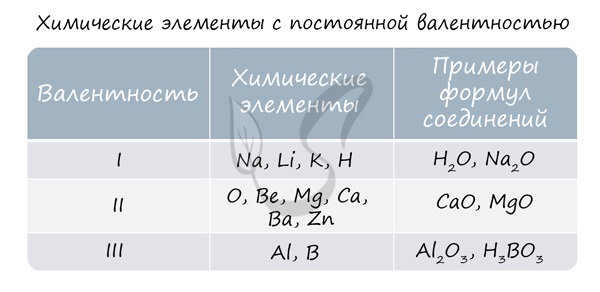
Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.
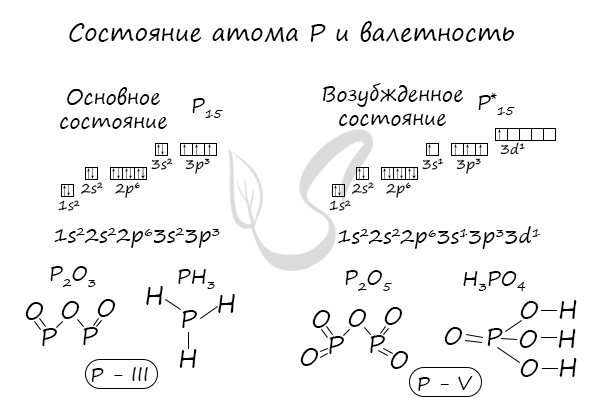
В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.
Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Степень окисления
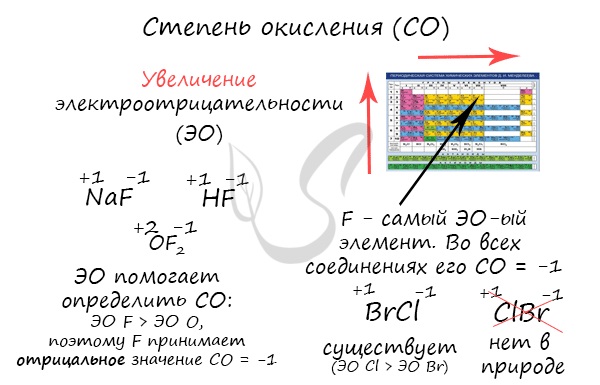
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию 😉
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Валентность и степень окисления
Урок №66. Валентность и степень окисления. Правила определения степеней окисления элементов
I. Валентность
II. Степень окисления
Степень окисления (СО) – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные.
Рассмотрим строение атомов фтора и натрия:
— Что можно сказать о завершённости внешнего уровня атомов фтора и натрия?
— Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня?
— Оба атома имеют незавершённый внешний уровень.
— Атому натрия легче отдавать электроны, фтору – принять электроны до завершения внешнего уровня.
Процесс отдачи электронов атомом, называется окислением .
Атом, отдающий электроны и повышающий свою степень окисления, окисляется и называется восстановителем .
Процесс принятия электронов атомом, называется восстановлением .
Атом, принимающий электроны и понижающий свою степень окисления, восстанавливается и называется окислителем .
Правила определения степени окисления атома
3. В сложных веществах степень окисления фтора -1
5. Элементы IA, IIA, IIIA групп отдают электроны и проявляют высшую «+» степень окисления, равную номеру группы
Э 0 -ne — →Э +n
Э 0 -ne — →Э +n
Э 0 +ne — →Э -n
7. Элементы VIIIA группы (инертные или благородные газы) проявляют степень окисления равную 0
8. Степень окисления атомов в простых веществах равна 0
F 2 0 , S 0 , O 3 0
9. В сложном веществе алгебраическая сумма СО всех атомов, с учётом их индексов, равна 0; а в сложном ионе его заряду.
H +1 N +5 O 3 -2 ((+1)*1)+((+5)*1)+((-2)*3)=0
(S +6 O 4 -2 ) -2 ((+6)*1)+((-2)*4)=-2
10. Металлы главных подгрупп IА-IIIА групп проявляют СО
+n = N группы
11. Металлы главных подгрупп групп IV-VII и металлы побочных подгрупп проявляют переменную степень окисления +n, согласно правилу №9 (с учётом рядом стоящего аниона – см. «Таблица растворимости веществ в воде»)
1. Проставим известные степени окисления у водорода и кислорода, а СО серы примем за «х»
2. Составим и решим уравнение, согласно правилу (II):
Х=6 или (+6), следовательно, у серы CО +6, т.е. S +6
1. Проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х»
2. Составим и решим уравнение, согласно правилу (II):
Х=5 или (+5), следовательно, у фосфора CО +5, т.е. P +5
1. Проставим известную степень окисления у водорода, а СО азота примем за «х»
2. Составим и решим уравнение, согласно правилу (II):
Электроотрицательность. Степень окисления и валентность химических элементов
Содержание:
Электроотрицательность химических элементов
Электроотрицательность (ЭО) – свойство атомов элементов оттягивать на себя электроны от другого атома в соединении.
На ЭО влияет несколько факторов: радиус атома и расстояние между ядром и валентными электронами. Численные значения ЭО приблизительные. Часто используют шкалу определения ЭО по Полингу.
Относительная электроотрицательность атомов элементов по Полингу
Анализируя данную шкалу можно выявить ряд закономерностей, перекликающихся с периодическим законом (ПЗ).
В зависимости от значения электроотрицательности образуются вещества с различным видом химической связей: если между атомами нет разности в электроотрицательности, образуются простые вещества (состоящие из одного вида атомов), чем больше разность, тем полярность молеклы возрастает: образуются молекулы веществ с полярной связью и ионной связью.
Степень окисления химических элементов и ее вычисление
Степень окисления (СО) – условный заряд атомов химических элементов в соединении на основании того, что все связи ионные.
Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно помещается над символом элемента в верхней части.
При определении СО следует руководствоваться следующими правилами:
Применяя эти правила можно рассчитать степени окисления элементов в сложном веществе.
К примеру, определим степени окисления элементов в фосфорной кислоте H3PO4.
Рассчитаем степени окисления у элементов в нитрате алюминия Al(NO3)3.
Валентность. Валентные возможности атомов
Валентность — это способность атома присоединять ряд других атомов для образования химической связи.
Валентность может быть определена числом химических связей, образующих атом, или числом неспаренных электронов.
Для определения валентности применяются определенные правила:
Валентность может совпадать со степенью окисления, но не имеет знака «+» или «-», не может быть равна нулю.
Валентные возможности атомов могут определяться:
Валентные возможности водорода
Валентные возможности водорода определяются одним неспаренным электроном на единственной орбитали. Водород обладает слабой способностью отдавать или принимать электроны, поэтому для него характерны в основном ковалентные химические связи. Ионные связи он может создавать с металлами, образуя гидриды. Ковалентные химические связи образуются за счет общих электронных пар. Поскольку у водорода всего один электрон, он способен образовывать только одну связь. По этой причине для него характерна валентность равная I.
Валентные возможности углерода
На внешнем энергетическом уровне у углерода 4 электрона: 2 спаренных и 2 неспаренных. Это состояние атома называется основным. По числу неспаренных электронов можно сказать, что углерод проявляет валентность равную II. Однако такая валентность проявляется только в некоторых соединениях.
В органических соединениях и некоторых органических веществах углерод проявляет валентность равную IV. Эта валентность характерна для возбужденного состояния С. Из основного в возбужденное состояние он может переходить при получении дополнительной энергии. Один электрон с s-подуровня переходит на p-подуровень, где есть свободная орбиталь.
Валентные возможности азота
У азота на валентном энергетическом уровне находится 5электронов: 3 неспаренных и 2 спаренных. Исходя из этого, валентность азота может быть равна III. В возбужденное состоянии атом азота не может переходить. Однако азот может выступать в качестве донора при образовании ковалентных химических связей, обеспечивая своей электронной паре атом, имеющий свободную орбиталь. В этом случае валентность у азота будет равна IV, причем для азота, как элемента пятой группы, это максимальная валентность. Валентность V он проявлять не способен.
Валентные возможности фосфора
В отличие от азота, фосфор имеет свободные 3d-орбитали, на которые могут переходить электроны. На внешнем энергетическом уровне находятся 3 неспаренных электрона. Атом фосфора способен переходить из основного состояния в возбужденное. Электроны с p-подуровня переходят на d-подуровень. В этом случае атом Р приобретает валентность, равную V. Таким образом, строение электронной оболочки атома увеличивает валентные возможности Р, по сравнению с азотом, от I до V.
Валентные возможности кислорода
На последнем энергетическом уровне у кислорода 2 неспаренных электрона. В соединениях чаще всего проявляет валентность II. У кислорода нет d-подуровня, поэтому переход электронов невозможен. Валентные возможности очень ограничены – проявляет II и III валентности.
Валентные возможности серы
Сера, так же, как и кислород, р в VI группе главной подгруппе ПСХЭ. Поэтому на валентном энергетическом уровне у серы 2 неспаренных электрона. Напрашивается вывод, что валентность серы равна II. Однако у серы есть и d-подуровень, который расширяет ее валентные возможности. Сера способна переходить из основного состояния в возбужденное, при этом может быть либо 4 неспаренных электрона, либо 6.
Таким образом, сера способна проявлять валентности II, IV, VI.
Опираясь на этот материал, можно определить все возможные валентности для любого химического элемента.
Что называется степенью окисления
§3.7 Окислительно-восстановительные свойства элементов. Степень окисления.
Передача электронов от атома к атому называется окислением-восстановлением. Окисляется тот атом, который отдает свои электроны, а принимающий электроны – восстанавливается.
Таблица 3-4. Ионы, находящиеся в каждой вертикальной колонке, имеют одинаковое электронное строение, совпадающее с электронной оболочкой одного из инертных газов.
1s 2 2s 2 2p 6 3s 2 3p 6
Количество отданных или принятых атомом электронов называется степенью окисления атома в молекуле.
Можно продолжить это определение:
При связывании разных атомов степень окисления равна заряду, который приобрел бы атом в этом соединении, если бы оно могло состоять из ионов.
Довольно просто определять степень окисления в ионных соединениях, где сразу видно, откуда и куда перешли электроны. Из табл. 3-4 видно, что знак и величина степени окисления всегда совпадают со знаком и зарядом одноатомных ионов.
Например, при взаимодействии магния с кислородом образуется ионное соединение Mg 2+ O 2– (где 2+ и 2– заряды ионов магния и кислорода, табл. 3-4). Посмотрите видеоопыт из «Единой коллекции цифровых образовательных ресурсов» – горение магния в кислороде.
Степень окисления магния составляет +2, а степень окисления кислорода составляет –2. Точно так же в соединении CaCl 2 степень окисления кальция +2, а степень окисления хлора –1.
Сложнее обстоит дело с полярными ковалентными соединениями. Здесь на помощь приходит знание относительной электроотрицательности элементов. Например, в молекуле воды Н 2 О кислород более электроотрицателен, чем водород, поэтому электроны связей смещены в сторону кислорода. Если бы вода была ионным соединением, то ее формулу можно было бы записать так:
Можно дать еще одно определение степени окисления:
Степень окисления – это условный заряд атома в молекуле или кристалле. Его определяют, условно считая все полярные связи полностью ионнымии.
Второй заряд «–» не может появиться на атоме кислорода потому, что кислород не в состоянии оттянуть электроны от своего соседа – точно такого же атома кислорода. Вывод: степень окисления кислорода в этом соединении составляет –1 (хотя его валентность по-прежнему II). Степень окисления водорода составляет +1.
Степень окисления и валентность несут разную информацию об атоме в его соединениях. Валентность просто характеризует способность атома образовывать некоторое количество химических связей, а степень окисления описывает смещения электронов при образовании химических связей.
Итак, уточним определение степени окисления с учетом всего того, что было сказано о ковалентных соединениях:
СТЕПЕНЬ ОКИСЛЕНИЯ выражают числом частично или полностью смещенных электронов от одного атома к другому в их соединении.
Если атом отдал электроны, его степени окисления приписывается знак “+”, а если атом принял электроны, то знак “–”. Возможна и нулевая степень окисления атома в молекуле, если электроны никуда не смещались или число отданных и принятых электронов одинаково.
Степень окисления – очень важная величина, относящаяся к основным понятиям химии. Фактически, степень окисления описывает состояние атома в соединении.
Есть несколько полезных правил, которые касаются степеней окисления:
1) Степень окисления атома любого элемента в свободном состоянии равна нулю.
2) Степень окисления любого простого одноатомного иона равна его заряду. Примеры:
3) Степень окисления водорода в его соединениях с другими элементами равна +1.
5) Алгебраическая сумма степеней окисления всех атомов в формуле нейтрального соединения всегда равна нулю.
6) Если в ходе химической реакции степень окисления атома повышается, то говорят, что он ОКИСЛЯЕТСЯ. Если же степень окисления понижается, то говорят, что он ВОССТАНАВЛИВАЕТСЯ.
Действие этого правила можно показать и на примере реакции серы с кислородом, в которой электроны формально переходят от одного атома к другому:
Подобных реакций с изменением степеней окисления реагирующих атомов – огромное множество. Все вместе они называются окислительно-восстановительными реакциями.
В последующих главах мы рассмотрим эти реакции подробнее, а пока еще раз разберемся в новых терминах.
Просто так трудно запомнить, какой процесс – отдачи или захвата электронов – называется окислением, а какой – восстановлением. Какой атом приобретает отрицательную, а какой – положительную степень окисления.
Рис. 3-11. Не совсем обычная запись уравнения химической реакции: Na + Cl = NaCl (см. текст). Хлор – «отрицательный», он отбирает чужие электроны. Натрий «окислился» – это заметно по его кислой физиономии.
Кому-то из вас поможет рис. 3-11, который рассказывает о реакции между натрием и хлором так, как будто это случилось в «химическом детском саду». В этом “детском саду” порядки такие же, как и в обычном. У Хлора целых 7 игрушек (электронов). Натрию же достался только грузовичок (1 электрон). Тут Хлор увидел у Натрия грузовичок и решил, что именно этой игрушки ему и не хватает! Хлор посильнее, поэтому грузовичок мгновенно оказался у него. А чтобы Натрий не ябедничал (у него такой окислившийся вид!), Хлор предложил поиграть вместе. Какое там! Конечно же, все 8 игрушек Хлор подтащил поближе к себе, а Натрию только и остается, что стоять рядом с “окисленным” видом.
** 3.26. Численное значение степени окисления, как вы знаете, может не совпадать с валентностью элемента. Ниже приведены структурные формулы нескольких соединений углерода. Напишите их молекулярные формулы и, пользуясь правилами для определения степеней окисления, определите степени окисления атомов углерода в каждой молекуле:
Таблица окисления химических элементов (8 класс, химия)
Что такое степень окисления
Условный заряд атомов элементов в сложных веществах называется степенью окисления. Значение заряда атомов записывается в окислительно-восстановительных реакциях, чтобы понять, какой элемент является восстановителем, а какой – окислителем.
Степень окисления взаимосвязана с электроотрицательностью, которая показывает возможность атомов принимать или отдавать электроны. Чем выше значение электроотрицательности, тем больше способность атома отнимать электроны в реакциях.
Рис. 1. Ряд электроотрицательности.
Степень окисления может иметь три значения:
Например, степени окисления в реакции натрия с хлором выглядят следующим образом:
2Na0 + Cl20 → 2Na+1Cl-1
В реакции металлов с неметаллами металл всегда является восстановителем, а неметалл – окислителем.
Как определить
Существует таблица, в которой указаны все возможные степени окисления элементов.
Название
Символ
Степень окисления
1, 0, +1, +3, +5, +7, редко +2 и +4
Или использовать на уроках этот вариант таблицы.
Рис. 2. Таблица степеней окисления.
Кроме того, степени окисления химических элементов можно определить по периодической таблице Менделеева:
Рис. 3. Таблица Менделеева.
Второе правило не работает для щелочных и щелочноземельных металлов, которые всегда имеют одну положительную степень окисления, равную номеру группы. Исключения составляют магний и бериллий (+1, +2). Также постоянную степень окисления имеют:
Остальные металлы имеют непостоянную степень окисления. В большинстве реакций выступают в качестве восстановителя. В редких случаях могут быть окислителями с отрицательной степенью окисления.
Что мы узнали?
Из урока 8 класса узнали о степени окисления. Это условная величина, показывающая, сколько электронов может отдать или принять атом в ходе химической реакции. Значение связано с электроотрицательностью. Окислители принимают электроны и имеют отрицательную степень окисления, восстановители отдают электроны и проявляют положительную степень окисления. Большинство металлов – восстановители с постоянной или переменной степенью окисления. Неметаллы могут проявлять свойства окислителя и восстановителя в зависимости от вещества, с которым реагируют.