что называется координационным числом и базисом кристаллической ячейки
Что называется координационным числом и базисом кристаллической ячейки
§3.9 Кристаллические решетки.
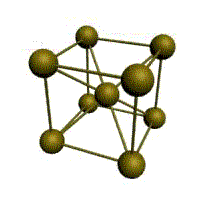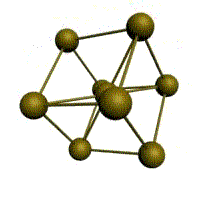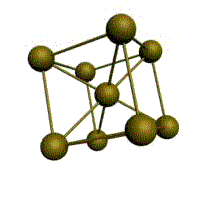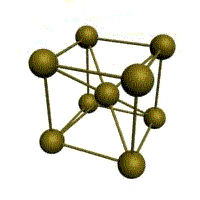
Например, в металлическом кристалле натрия (повторяем здесь рис. 3-13 из предыдущего параграфа) каждый ион натрия окружен восемью ближайшими соседями – на рисунке это особенно хорошо видно по атому, который помещен в центр куба. Но в металле все атомы натрия равноценны и имеют одинаковое окружение. Таким образом, координационное число натрия в металлическом кристалле равно 8.
Точно такое же координационное число у ионов цезия и хлора в кристалле CsCl. Кристалл CsCl построен как бы из вложенных друг в друга кубиков двух разных сортов. Например, можно нарисовать кубик с вершинами из ионов цезия, и тогда в центре окажется ион хлора (как на рис. 3-20). Но если вы представите 8 ионов хлора и мысленно соедините их линиями, то получится кубик с вершинами из ионов хлора, в центре которого окажется ион цезия.
Рис. 3-20. Строение кристалла хлористого цезия CsCl. Координационное число 8 по цезию и по хлору.
Чтобы правильно нарисовать элементарную ячейку, надо поместить в ее центр любую частицу и расположить вокруг нее только ближайшие соседние частицы в соответствии с координационным числом. Неопытный химик (но не мы!) при рассматривании элементарной ячейки кристалла CsCl (рис. 3-20) может прийти к выводу, что в соединении на один атом хлора приходится 8 атомов цезия (или наоборот, если нарисовать ячейку с атомом цезия в середине). Но мы с вами знаем, что это не так: в соединении CsCl соотношение цезия и хлора 1:1, а элементарная ячейка служит для описания структурных особенностей кристалла, а не состава соединения.
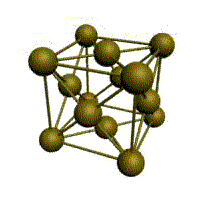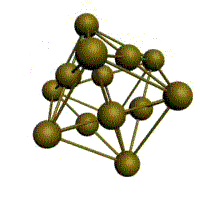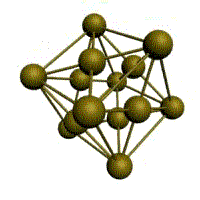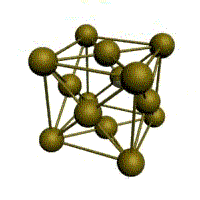
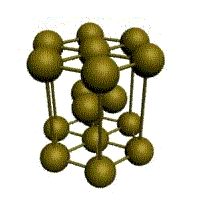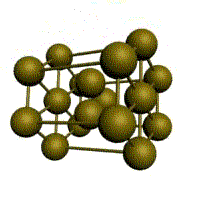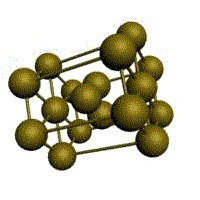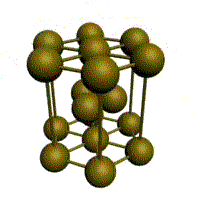
Рис. 3-21. Элементарная ячейка кристалла NaCl. Координационное число 6 по натрию и по хлору.
Элементарной ячейке NaCl соответствует гранецентрированная кубическая упаковка, а рассмотренной выше ячейке кристалла CsCl – объемноцентрированная кубическая упаковка. Названия упаковок говорят сами за себя: у гранецентрированной есть частица в центре каждой грани куба, а у объемноцентрированной – частица находится в центре куба.
Мир кристаллов настолько красив, что даже обычно сдержанные ученые-химики иногда описывают его не сухим языком научных статей, а скорее поэтическими категориями. Посмотрите, с каким восхищением пишет о строении кристаллов норвежский химик Юхан Фогт:
«Представьте себе двести замечательных скрипачей, играющих одну и ту же пьесу на прекрасно настроенных инструментах, но не в унисон. Результат будет не из приятных, и даже человек с хорошим слухом не поймет, что они играют. Аналогичную музыку издают молекулы газов, жидкостей и обычных твердых тел. В отличие от этого кристалл подобен оркестру, руководимому блестящим дирижером; за движениями дирижера следят глаза всех музыкантов, и все смычки повинуются каждому мановению его руки. Для меня музыка физических законов звучит самым полным и сильным аккордом именно в области науки о кристаллах».
Вы можете посетить удивительно красивые коллекции Минералогического музея РАН им. Ферсмана.
Параметры решетки, базис, координационное число
В общем случае элементарная ячейка кристаллической решетки представляет собой наклонный параллелепипед (рис. 8).
Если поместить начало координат в одну из вершин ячейки, то расстояния а,b,c до ближайших вершин и углы a, b, g между координатными осями называют параметрами кристаллической решетки.
Базис решетки- это число атомов, приходящихся на однуэлементарную ячейку.
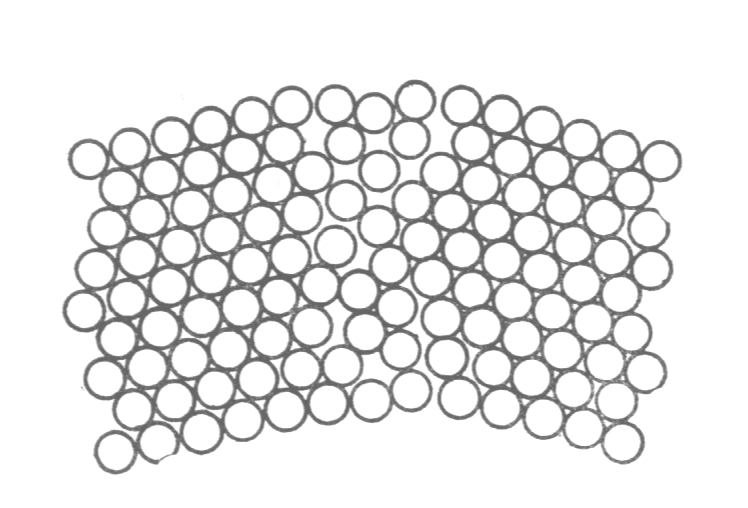
В гексагональной плотноупакованной ячейке 17 атомов. На ГПУ ячейку
Кристаллическая решетка характеризуется также координационным числом К, которое показывает число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома. Для ОЦК решетки К = 8, для ГЦК и ГПУ решеток К = 12. Чем выше координационное число, тем большая плотность упаковки атомов в ячейке.
1.4 Плотность упаковки атомов в решетке
При моделировании кристаллической решетки в виде соприкасающихся шаровмежду ними образуются пустоты.
Индексация плоскостей и направлений
В кристаллической решетке
Индексация плоскостей
Для обозначения плоскостей и направлений в кристаллической решетке используют индексы, связанные с координатными осями [3].
Положение плоскости определяется отрезками, отсекаемыми ею на координатных осях. За единицу измерения вдоль каждой оси принимают параметр ( период ) решетки в направлении данной оси. Чтобы не иметь дело с бесконечностями, а также дробными числами, используют величины, обратные отрезкам, отсекаемым плоскостью на координатных осях, причем отношение
Индексы плоскости отыскиваются следующим образом. Определяются отрезки А, В и С, которые этой плоскостью отсекаются на осях координат.
Записываются величины, обратные отсекаемым отрезкам, например: 1/А, 1/В,1/С. Полученные дроби приводят к общему знаменателю, например,
это будет число D. Целые числа h = D / А, k = D / В, l = D / С и являются индексами данной плоскости.
Определим, например, индексы плоскости, которая отсекает на осях координат отрезки А = 





= 
плоскости являются величины h = 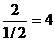


Обозначение плоскости (416).
Примеры индексации плоскостей в кубической решетке показаны на рис. 10, а
в гексагональной плотноупакованной решетке – на рис. 11.
Непараллельные плоскости, имеющие одинаковое атомное строение (количество атомов и их расположение), кристаллографически эквивалентны.
Всю совокупность эквивалентных плоскостей обозначают индексом какой-либо одной плоскости, заключенным в фигурные скобки. Например, плоскости 100, 010, 001, 100, 010, 001. Их обозначают индексом одной какой-либо плоскости и заключают в фигурные скобки как семейство плоскостей <100>или <001>. Другой пример, семейство <111>. Это плоскости 111, 111,111, 111 и др. Если плоскость проходит через начало координат, то для удобства ее
индексации начало координат следует перенести в какую-либо соседнюю вершину элементарной ячейки.
Индексация направлений
Ориентация прямой определяется координатами двух ее точек. Если выбрать из семейства прямых ту, которая проходит через начало координат, или перенести прямую параллельно самой себе так, чтобы она прошла через
начало координат, то направление прямой определится координатами только второй ее точки.
Примеры обозначения направлений в кубической и гексагональной плотноупакованной ( ГПУ) решетке показаны на рис. 12 и 13.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Что называется координационным числом и базисом кристаллической ячейки

1.1. Аморфные и кристаллические тела
В твердых телах атомы могут размещаться в пространстве двумя способами:
Аморфные вещества обладают формальными признаками твердых тел, т.е. они способны сохранять постоянный объем и форму. Однако они не имеют определенной температуры плавления или кристаллизации.
Внешние электронные орбиты атомов соприкасаются, так что плотность упаковки атомов в кристаллической решетке весьма велика.
В кристаллитах соблюдаются ближний и дальний порядки. Это означает наличие упорядоченного расположения и стабильности как окружающих данный атом ближайших его соседей (ближний порядок), так и атомов, находящихся от него на значительных расстояниях вплоть до границ зерен (дальний порядок ).
Рис. 1.1. Расположение атомов в кристаллическом (а) и аморфном (б) веществе
Вследствие диффузии отдельные атомы могут покидать свои места в узлах кристаллической решетки, однако при этом упорядоченность кристаллического строения в целом не нарушается.
1.2. Основные типы кристаллических решеток
Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ). Такой тип структуры называется металлической связью.
Тип решетки определяется формой элементарного геометрического тела, многократное повторение которого по трем пространственным осям образует решетку данного кристаллического тела.
объемно-центрированная кубическая (ОЦК)
гранецентрированная кубическая (ГЦК)
гексагональная плотноупакованная (ГП)
(6 атомов на ячейку)
Рис. 1.2. Основные типы кристаллических решеток металлов
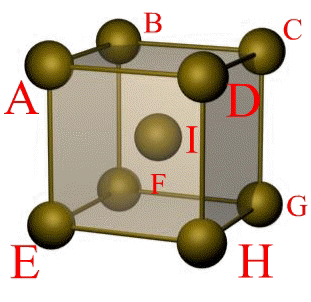
Основу ОЦК-решетки составляет элементарная кубическая ячейка (рис. 1.2,б), в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы.
У ГЦК-решетки (рис. 1.2, в) элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ, рис. 1.2, г). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями.
У гексагональных решеток отношение параметра с/ а всегда больше единицы. Такую решетку имеют магний, цинк, кадмий, берилий, титан и др.
Компактность кристаллической решетки или степень заполненности ее объема атомами является важной характеристикой. Она определяется такими показателями как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметры а кубических решеток металлов находятся в пределах от 0,286 до 0,607 нм. Для металлов с гексагональной решеткой а лежит в пределах 0,228-0,398 нм, а с в пределах 0,357- 0,652 нм.
Параметры кристаллических решеток металлов могут быть измерены с помощью рентгеноструктурного анализа.
При подсчете числа атомов в каждой элементарной ячейке следует иметь в виду, что каждый атом входит одновременно в несколько ячеек. Например, для ГЦК-решетки, каждый атом, находящийся в вершине куба, принадлежит 8 ячейкам, а атом, центрирующий грань, двум. И лишь атом, находящийся в центре куба, полностью принадлежит данной ячейке.
Таким образом, ОЦК- и ГЦК-ячейки содержат соответственно 2 и 4 атома.
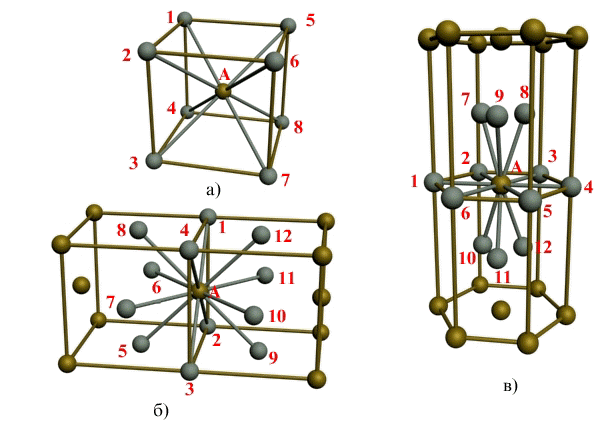
Под координационным числом понимается количество ближайших соседей данного атома.
Рис. 1.3. Координационное число в различных кристаллических решетках для атома А:
В ОЦК решетке (рис. 1.3, а) атом А (в центре) находится на наиболее близком равном расстоянии от восьми атомов, расположенных в вершинах куба, т. е. координационное число этой решетки равно 8 (К8).
В ГЦК решетке (рис. 1.3, б) атом А (на грани куба) находится на наиболее близком равном расстоянии от четырех атомов /, 2, 3, 4, расположенных в вершинах куба, от четырех атомов 5, 6, 7, 8, расположенных на гранях куба, и, кроме того, от четырех атомов 9, 10, 11, 12, принадлежащих расположенной рядом кристаллической ячейке. Атомы 9, 10, 11, 12 симметричны атомам 5, 6, 7, 8. Таким образом, ГЦК решетки координационное число равно 12 (К12).
В ГПУ решетке при с/а = 1,633 (рис. 1.3, в) атом А в центре шестигранного основания призмы находится на наиболее близком равном расстоянии от шести атомов /, 2, 3, 4, 5, 6, размещенных в вершинах шестигранника, и от трех атомов 7, 8, 9, расположенных в средней плоскости призмы. Кроме того, атом А оказывается на таком же расстоянии еще от трех атомов 10, 11, 12, принадлежащих кристаллической ячейке, лежащей ниже основания. Атомы 10, 11, 12 симметричны атомам 7, 8, 9.
Следовательно, для ГПУ решетки координационное число равно 12 (Г12).
Плотность упаковки представляет собой отношение суммарного объема, занимаемого собственно атомами в кристаллической решетке, к ее полному объему. Различные типы кристаллических решеток имеют разную плотность упаковки атомов. В ГЦК решетке атомы занимают 74 % всего объема кристаллической решетки, а межатомные промежутки («поры») 26 %. В ОЦК решетке атомы занимают 68 % всего объема, а «поры» 32 %. Компактность решетки зависит от особенностей электронной структуры металлов и характера связи между их атомами.
От типа кристаллической решетки сильно зависят свойства металла.
1.3. Кристаллографические направления и плоскости
Упорядоченность кристаллического строения в пространственной решетке позволяет выделить отдельные кристаллографические направления и плоскости.
Кристаллографическими плоскостями являются, например, плоскости граней кубов (рис. 1.4, б), а также их различные диагональные плоскости вместе с находящимися на них атомами (рис. 1.4, в, г). Для ГПУ-решеток кристаллографическими плоскостями могут быть плоскости оснований (рис. 1.2, г).
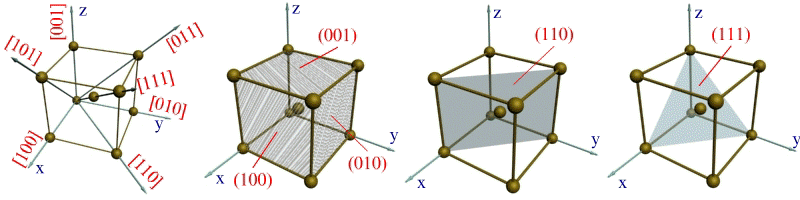
Для определения индекса какого-либо направления необходимо найти индекс ближайшего к данной точке отсчета атома, находящегося на данном направлении. Например, индекс ближайшего атома вдоль оси ОХ обозначается цифрами 100 (рис. 1.4,а). Эт и цифры представляют собой координаты упомянутого атома относительно точки О, выраженные через количество параметров вдоль осей OX, OY и OZ соответственно.
Индексы направления ОХ и параллельных ему направлений обозначаются [100]. Соответственно направления OY и OZ обозначаются [010] и [001]. Кристаллографические направления вдоль диагоналей граней XOZ, XOY и YOZ обозначают [101], [110] и [011]. Пользуясь указанной методикой, можно определить индекс любого направления. Например, индекс направления вдоль диагонали куба выразится так: [111].
Индексами плоскостей, параллельных плоскостям XOZ и YOZ, окажутся выражения (010) и (100) (рис. 1.4, б). Индекс вертикальной диагональной плоскости куба выразится через (110), (рис. 1.2, в), а индекс наклонной плоскости, пересекающейся со всеми тремя осями координат на удалении одного параметра, примет вид (111) (см. рис. 1.4, г).
1.4. Анизотропия в кристаллах
Под анизотропией понимается неодинаковость механических и других свойств в кристаллических телах вдоль различных кристаллографических направлений. Она является естественным следствием кристаллического строения, так как на различных кристаллографических плоскостях и вдоль различных направлений плотность атомов различна.
Например, в кубических решетках (см. рис. 1.2, б, в) по направлениям вдоль ребер насчитывается меньше атомов, чем вдоль диагоналей куба в ОЦК-решетке или диагоналей граней в ГЦК-решетке. На плоскостях, проходящих через грани ОЦК- и ГЦК-решеток, находится меньше атомов, чем на диагональных плоскостях.
Поскольку механические, физические и химические свойства вдоль различных направлений зависят от плотности находящихся на них атомов, то перечисленные свойства вдоль различных направлений в кристаллических телах должны быть неодинаковыми.
Анизотропия проявляется только в пределах одного монокристалла или зерна-кристаллита. В поликристаллических телах она не наблюдается из-за усреднения свойств по каждому направлению для огромного количества произвольно ориентированных друг относительно друга зерен. Поэтому реальные металлы являются квазиизотропными телами, т. е. псевдоизотропными.
Рис. 1.5. Элементарная ячейка решетки ОЦК
Сдвиг в кристалле происходит наиболее легко вдоль атомных плоскостей с наиболее плотной упаковкой атомов. Рассмотрим объемно-центрическую кубическую решетку (ОЦК) (рис. 1.5):
Рис. 1.6. Плоскости решетки ОЦК
1.5. Аллотропия металлов
Некоторые металлы, например, железо, титан, олово и др. способны по достижении определенных температур изменять кристаллическое строение, т. е. изменять тип элементарной ячейки своей кристаллической решетки. Это явление получило название аллотропии или полиморфизма, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными.
На рис. 1.7 показано изменение свободной энергии F от температуры t для двух вариантов кристаллического строения железа: ОЦК (кривая 1 ) и ГЦК (кривая 2).
В интервале температур 911-1392 о C железо имеет решетку ГЦК, так как при этом его свободная энергия меньше. При t 1392°С, у него должна быть решетка ОЦК, обладающая меньшей свободной энергией.
1.6. Дефекты кристаллической решетки металла
Кристаллическая решетка, в которой отсутствуют нарушения сплошности и все узлы заполнены однородными атомами называется идеальной кристаллической решеткой металла.
В решетке реального металла могут находиться различные дефекты.
Все дефекты кристаллической решетки принято делить на точечные, линейные, поверхностные и объемные.
Точечные дефекты соизмеримы с размерами атомов. К ним относятся вакансии, т. е. незаполненные узлы решетки, межузельные атомы данного металла (рис 1.8), примесные атомы замещения, т. е. атомы, по диаметру соизмеримые с атомами данного металла и примесные атомы внедрения, имеющие очень малые размеры и поэтому находящиеся в междоузлиях (рис 1.9). Влияние этих дефектов на прочность металла может быть различным в зависимости от их количества в единице объема и характера.
Рис. 1.8. Схема образования пары вакансия-внедренный атом
Рис. 1.9. Примесные атомы внедрения и замещения
Линейные дефекты имеют длину, значительно превышающую их поперечные размеры. К ним относятся дислокации, т. е. дефекты, образующиеся в решетке в результате смещений кристаллографических плоскостей.
Дислокации бывают двух видов.
Наиболее характерной является краевая дислокация (рис. 1.10). Она образуется в результате возникновения в решетке так называемой полуплоскости или экстраплоскости.
Рис. 1.10. Схема краевой дислокации в идеальном кристалле
Нижний ряд экстраплоскости собственно и принято называть дислокацией.
Другим типом дислокации является винтовая дислокация, которая представляет собой некоторую условную ось внутри кристалла, вокруг которой закручены атомные плоскости (рис.1.11).
Рис. 1.11. Схема винтовой дислокация
В винтовой дислокации, так же как в краевой, существенные искажения кристаллической решетки наблюдаются только вблизи оси, поэтому такой дефект может быть отнесен к линейным.
Дислокации обладают высокой подвижностью, поэтому существенно уменьшают прочность металла, так как облегчают образование сдвигов в зернах-кристаллитах под действием приложенных напряжений.
Дислокационный механизм сдвиговой пластической деформации внутри кристаллов может привести к разрушению изделия. Таким образом, дислокации непосредственно влияют на прочностные характеристики металла.
На рис. 1.12 в виде кривой ABC схематически показана зависимость прочности металла от плотности дислокаций. Точка А соответствует теоретической прочности металла, обусловленной необходимостью одновременного разрыва всех межатомных связей, проходящих через плоскость сдвига, в случае отсутствия дислокаций.
При увеличении количества дислокаций (см. участок АВ) прочность резко снижается, так как на несколько порядков уменьшаются усилия, необходимые для осуществления сдвигов в зернах металла при его деформировании и разрушении.
Рис. 1.12. Зависимость предела прочности кристалла от плотности линейных дефектов(дислокаций). Кривая Одинга
При плотности дислокаций 10 6- 10 7 см-2 (точка В на кривой), прочности минимальна, и на участке ВС происходит ее рост. Это объясняется тем, что с ростом плотности дислокаций их передвижение происходит не только по параллельным, но и по пересекающимся плоскостям, что существенно затрудняет процесс деформирования зерен.
Поэтому начиная с точки В прочность металла возрастает.
Поверхностные дефекты включают в себя главным образом границы зерен (рис.1.13). На границах кристаллическая решетка сильно искажена. В них скапливаются перемещающиеся изнутри зерен дислокации.
Из практики известно, что мелкозернистый металл прочнее крупнозернистого. Так как у последнего меньше суммарная протяженность (площадь) границ. То можно сделать вывод, что поверхностные дефекты способствуют повышению прочности металла. Поэтому создано несколько технологических способов получения мелкозернистых сплавов.
Рис.1.13. Структура границы двух соседних кристаллических зерен
Объемные дефекты кристаллической решетки включают трещины и поры. Наличие данных дефектов, уменьшая плотность металла, снижает его прочность.
Кроме того, трещины являются сильными концентраторами напряжений, в десятки и более раз повышающими напряжения создаваемые в металле рабочими нагрузками. Последнее обстоятельство наиболее существенно влияет на прочность металла.
Контрольные вопросы по лекции №1
В чем состоит существенная разница между строением аморфных и кристаллических тел? Что такое кристаллическая решетка?
Перечислите основные типы ячеек кристаллических решеток металлов. Что такое параметры решеток?
Что понимается под кристаллографическими направлениями и плоскостями и как они обозначаются?
Что такое анизотропия свойств в кристаллах, чем она обусловлена? Привести пример.
Почему поликристаллические тела являются изотропными? Что такое квазиизотропия (псевдоизотропия)?
Что такое аллотропия (полиморфизм) металлов и каково ее практическое значение?
Что представляют собой краевые дислокации, какова их роль в протекании пластической деформации металла и как они влияют на его прочность?
Что такое плотность дислокаций и как она влияет на характер изменения прочности металла?