что называется активностью катализатора
Активность катализатора
Активность катализатора, свойство катализатора ускорять химическую реакцию. Количественно активность определяют как скорость реакции в данных условиях за вычетом скорости той же реакции в отсутствие катализатора. Значение активность используют в технол. расчетах, для сравнит. оценки катализаторов при их подборе, для характеристики качества катализатора. В технол. расчетах активность обычно выражают через скорость реакции, отнесенную к единице объема или массы катализатора. Для сравнит. характеристики катализаторов в гомог. катализе используют также скорость реакции, отнесенную к единице концентрации катализатора, в гетерогенном-к единице поверхности катализатора (так называемой удельную активность катализатора). Часто с этой же целью скорость реакции относят к одному активному центру катализатора; в гетерогенном катализе эта величина называют числом оборотов реакции.
Для сравнения ряда катализаторов используют также значения констант скорости реакции (если ее порядок не меняется на различные катализаторах) или энергию активации реакции (если не меняется предэкспоненциальный множитель в уравении Аррениуса). Иногда сопоставляют степени превращаются реакционное смеси заданного состава при одинаковых условиях реакции, однако такой способ оценки А. является приближенным, его погрешность возрастает с увеличением измеряемой степени превращаются; для реакций, тормозящихся образующимся продуктом, этот способ неприемлем.
Полезное
Смотреть что такое «Активность катализатора» в других словарях:
активность катализатора — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN catalyst [catalytic] activity … Справочник технического переводчика
крекирующая активность (катализатора) — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN cracking activationcracking activity … Справочник технического переводчика
АКТИВНОСТЬ — катализатора, св во катализатора ускорять хим. р цию. Количественно А. определяют как скорость р ции в данных условиях за вычетом скорости той же р ции в отсутствие катализатора. Значение А. используют в технол. расчетах, для сравнит. оценки… … Химическая энциклопедия
Оптическая активность — Оптически активные вещества среды, обладающие естественной оптической активностью. Оптическая активность это способность среды (кристаллов, растворов, паров вещества) вызывать вращение плоскости поляризации проходящего через неё оптического… … Википедия
ГЕТЕРОГЕННЫЙ КАТАЛИЗ — (контактный катализ), изменение скорости хим. р ции при воздействии катализаторов, образующих самостоят. фазу и отделенных от реагирующих в в границей раздела. наиб. распространен случай, когда твердый кат. (контакт) ускоряет р цию между… … Химическая энциклопедия
Кинетика химическая — Химическая кинетика или кинетика химических реакций раздел химии, изучающий механизмы протекания химических реакций, порядок химической реакции, а также закономерности протекания химических реакций во времени. Содержание 1 Скорость химической… … Википедия
КАТАЛИЗАТОРЫ — в ва, изменяющие скорость хим. р ции или вызывающие ее, но не входящие в состав продуктов. Различают К. гомог. и гетерог. катализа. Типичные К. для гомог. катализа протонные и апротонные к ты, основания, нек рые комплексы металлов, для… … Химическая энциклопедия
КАТАЛИТИЧЕСКИХ РЕАКЦИЙ КИНЕТИКА — Каталитич. р ция циклич. процесс, складывающийся из ряда элементарных р ций, скорости к рых описываются действующих масс законом. Этот закон имеет простую форму для идеальных газовых смесей, идеальных р ров и идеальных поверхностных слоев.… … Химическая энциклопедия
промотор (в катализе) — Термин промотор (в катализе) Термин на английском promoter (in catalysis) Синонимы Аббревиатуры Связанные термины Определение вещество, добавляемое к катализатору в небольших количествах с целью улучшения его свойств, таких как активность,… … Энциклопедический словарь нанотехнологий
Катализ — (греч. κατάλυσις восходит к καταλύειν разрушение) избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное… … Википедия
Каталитическая активность
Категории Каталитическая химия | Под редакцией сообщества: Химия
Каталитическая активность – свойство катализатора ускорять химическую реакцию.
Формально каталитическую активность (К.а.) можно определить как скорость каталитической реакции в данных условиях за вычетом скорости той же реакции в отсутствие катализатора или как соотношение скоростей каталитической и некаталитической реакций (vкат / vнекат)опытн.. Как известно, катализатор снижает энергию активации химической реакции, и если предположить, что при одинаковых условиях проведения реакции значения предэкспоненциальных множителей в уравнении Аррениуса близки, то отношение скоростей каталитической и некаталитической реакций можно рассчитать следующим образом:
(vкат / vнекат)рассч. = e — E кат / RT / e — E некат / RT
Однако оказывается, что опытные и расчетные данные различаются очень сильно, что объясняется, прежде всего, изменением числового значения предэкспоненциального множителя. Поэтому первое требование к оценке активности катализатора – это оценка через кинетическое уравнение, дающее значение константы скорости, самого надежного показателя активности. Всякие другие способы (через количество прореагировавшего за определенное время вещества, по степени превращения) неоднозначны и могут приводить к недоразумениям.
Каталитическая активность зависит от количества и природы активных центров, участвующих в каталитическом процессе. Поэтому в идеальном случае, когда все активные центры катализатора участвуют в катализе, ее определяют как максимальное количество молекул, прореагировавших на одном активном центре в единицу времени:
К.а. = Nмол. / Nа.ц. · c
Эту величину называют абсолютной активностью, или TOF (turnover frequency). – «частотой оборотов» Размерность TOF – время в «минус первой степени».
В гомогенных процессах катализатор находится в молекулярно-дисперсном состоянии и его активность прямо пропорциональна действующей массе, поэтому каталитическую активность определяют как число молей превращенного вещества на моле катализатора в единицу времени, т.е. К.а. = Моль реагента/Моль кат-ра · c
Однако такой расчет не может быть корректным, если степень превращения высока и близка к равновесной, поэтому данные для расчета каталитической активности следует брать по тому участку кинетической кривой, где скорость реакции максимальна.
Весовая активность, или весовая производительность, катализатора (А) определяется как количество вещества (в молях), реагирующее в единицу времени на единице массы катализатора; ее размерность – [Моль/г · с]. Удельная каталитическая активность определяется как скорость реакции на единице площади поверхности катализатора; ее размерность – [Моль/м 2 · с].
В качестве характеристики активности катализатора используется величина TN («turnover number»), определяемая как количество молей продукта (или молекул продукта) образовавшихся на одном моле катализатора (или одном центре) до тех пор, пока катализатор полностью не потерял свою активность. У идеального катализатора TN равен бесконечности.
Значение каталитической активности используют в технологических расчетах, для сравнительной оценки катализаторов при их подборе, для характеристики качества катализатора. Для сравнения ряда катализаторов используют также значения констант скорости реакции (если ее порядок не меняется на различных катализаторах) или энергию активации реакции (если не меняется предэкспоненциальный множитель в уравнении Аррениуса). Иногда сопоставляют степени превращения реакционной смеси заданного состава при одинаковых условиях реакции, однако такой способ оценки активности является приближенным, его погрешность возрастает с увеличением измеряемой степени превращения; а для реакции, тормозящихся образующимся продуктом, этот способ неприемлем.
Рекомендуемая литература
Химическая энциклопедия. М.: 1990, Изд-во «Советская энциклопедия». Т.1
Эта статья еще не написана, но вы можете сделать это.
Катализ и катализаторы
Катализ – это процесс изменения скорости химической реакции при помощи катализаторов – веществ, принимающих участие в химической реакции, но в состав конечных продуктов не входящих и в результате реакции не расходующихся.
Одни катализаторы ускоряют реакцию (положительный катализ), другие – замедляют (отрицательный катализ). Отрицательный катализ называют ингибированием, а катализаторы, понижающие скорость химической реакции – ингибиторами.
Различают гомогенный и гетерогенный катализ.
Гомогенный катализ.
При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO2 и SO3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное.
Так, для реакции 2HI = H2+I2 Еа(исх)=184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt, то Еа(исх)=104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
SO2 +1/2 O2 = SO3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О2 = NO2 и NO2 +SO2 = SO3 +NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами. Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO2.
Применение катализаторов
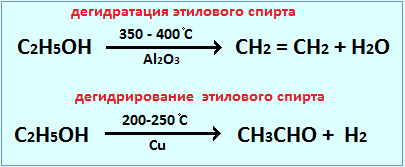
Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование:
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.