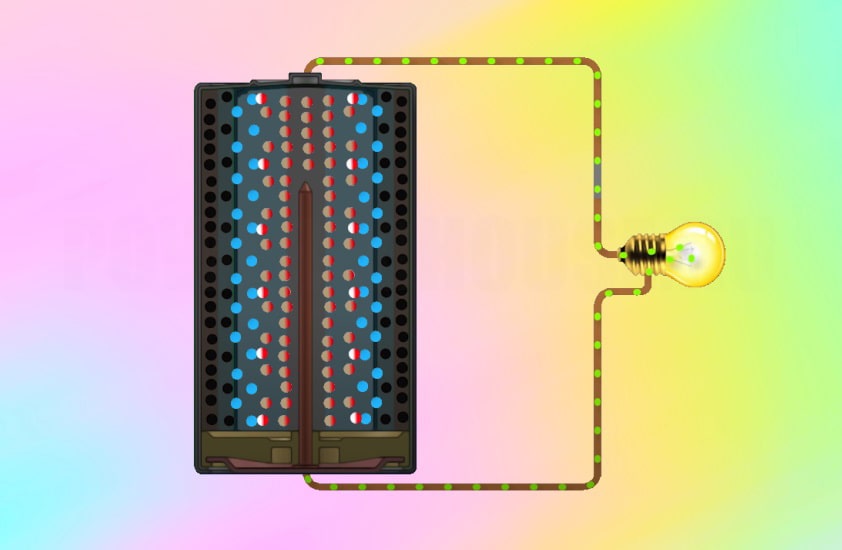
что находится внутри батарейки пальчиковые
Как работает батарейка: строение и состав

Что такое батарейка
Обыкновенная батарейка представляет собой некий источник электрического тока в котором несколько электрохимических элементов объединены между собой в пакет. Стоит обратить внимание, что батарея — это именно несколько объединенных между собой гальванических элементов. Электричество в батарейке вырабатывается вследствие протекающей химической реакции. Изобретателем батареек принято считать ученого Алессандро Вольта, который создал в 1800 г. «Вольтов столб» — первый в мире электрохимический источник тока, ставший прародителем современных батарей.
Устройство батарейки
Иногда, забыв вынуть уже подсевшие батарейки, через некоторое время можно обнаружить, что в батарейном отсеке появилась какая-то жидкость. Это и есть потёкший электролит. Поэтому на упаковке с батарейками можно найти предупреждение о том, что севшие элементы нужно вынимать из электроприборов. Теперь вы знаете, зачем это нужно делать.
Итак, с устройством разобрались, теперь поговорим о том, как работает щелочной элемент.
Принцип работы батарейки
На аноде проходит реакция окисления цинка. Вначале образуется гидроксид цинка
Zn + 2OH − → Zn(OH)2 + 2e −
На катоде проходит реакция восстановления оксида марганца IV в оксид марганца III
Общая картина следующая
Zn + 2KOH + 2MnO2 + 2e − → 2e − + ZnO + 2KOH + Mn2O3
Из первой формулы видно, что на аноде имеется избыток электронов. Но ведь анод это «+»? Дело в том, что в физике принято считать за направление тока движение положительных зарядов, т.е. от плюса (анода) к минусу (катоду). Но электрический ток это упорядоченное движение электронов, которые имеют отрицательный заряд. Поэтому, ток течёт оттуда, где есть избыток электронов, в направлении, где есть нехватка отрицательных зарядов (это и есть плюс – недостаток электронов). При этом получается, что ток течёт в реальности от отрицательного контакта к положительному. В электрохимии анодом принято считать тот электрод, на котором происходит процесс окисления, катодом же считается электрод, где происходит реакция восстановления.
Интересно знать! В результате химических реакций внутри элемента питания происходит необратимое разрушение металлических элементов питания, батарейка теряет свою емкость.
Важно! Поскольку химические изменения в процессе разряда батарейки необратимы — они не подлежат восстановлению заряда.
Разновидности
По форме и размерам согласно мировым стандартам элементы питания разделяются на такие виды:
В настоящее время существует большое количество разнообразных источников питания. Между собой они отличаются материалами, применяемыми для изготовления электродов и электролита. Среди многочисленных батареек выделяют несколько основных видов:
Солевые
Такие гальванические элементы имеют низкую стоимость относительно аналогов, однако имеется один существенный недостаток это низкая внутренняя емкость таких батареек.
Щелочные
Состав батарейки такого вида отличается от своих аналогов применяемым электролитом, в них используется активная щелочь гидроксид калия KOH. Электрод выполнен из двуокиси таких металлов, как цинк и марганец. Нашли широкое применение в современной электронике, на корпусе элементов указывается маркировка «ALKALINE».
Основным плюсом такой батарейки является продолжительный срок службы, в процессе эксплуатации номинальное напряжение понижается с меньшей скоростью. К минусам относят повышенную стоимость.
Серебряные
В качестве электролита применяют КОН, в состав электродов включено серебро. В таких элементах отмечают значительно увеличение срока службы, повышенную энергетическую плотность, постоянное номинальное напряжение, а также полную безвредность. Недостатками являются высокая цена.
Ртутные
В строении таких батареек используется цинк в качестве металла для анода, катод выполняется из ртутного оксида. Электроды разделяются сепаратором пропитанным электролитом. Такой элемент питания способен выполнять функции аккумулятора, однако емкость будет постепенно понижаться с каждым циклом восстановления заряда. При разряде происходит слипание ртути, а при заряде образуются дендриты цинка. Во время эксплуатации не допускается разгерметизация корпуса в связи с повышенной вредностью паров ртути. К преимуществам относят сохранение длительных значений плотности энергии, емкости и напряжения.
Внимание! Ртутные источники питания являются потенциально опасными для здоровья человека и окружающей среды.
Литиевые
Данные элементы питания постепенно вытесняют все аналоги в своей области применения. Отрицательные электроды такой батарейки сделаны из лития. В них постоянно совершенствуются основные технические характеристики. К плюсам батареек с литиевым электродом относят увеличение срока хранения, широкий диапазон рабочих температур, повышенная внутренняя емкость. Основным минусом является повышенная стоимость.
Применение
Различные виды могут применяться по-разному, зависит это от их основных конструктивных свойств и характеристик:
Выбор источника питания
Для правильного выбора элементов питания необходимо обратить внимание на следующие факторы:
Правильный выбор и соблюдение требований к безопасной эксплуатации позволит продлить работу любого элемента питания. Для определенных видов техники необходим свой вид батарейки.
Батарейка — устройство и принцип работы
Термин «батарейка» из книги по электротехнике – это источник электрического тока, в котором соединены несколько электрохимических элементов. В результате химического процесса, протекающего в «теле», образуется электроэнергия. В быту батарейками называют все, что дает постоянный ток, то есть способно запитать или зарядить электронное устройство. Источники питания не подзаряжаются, соответственно, они не вечны. Рассмотрим устройство батарейки, по какому принципу она работает и каких видов бывает.

Принцип работы
Придя в магазин, на полках обнаруживаются сотни разных источников питания. Они различаются техническими характеристиками, но их объединяет принцип работы. У каждой батарейки есть полюса «плюс», «минус» и электролит в виде жидкого или сухого вещества – это основные элементы. Электроэнергия перемещается от «+» к «-».
Катоды, обозначаемые как «минус», работают как восстановители – к ним приходит энергия от анода. В ходе химической реакции образуются ионы, которые внутри батарейки перемещаются в специальной среде – электролите. По ходу службы источника питания в нем образуются другие вещества, а также деформируются электроды – он садится.
Это и есть принцип работы классической батарейки. Процессы, протекающие в ней, необратимы. Это говорит о том, что перезарядить источник питания не получится.
Разновидности батареек
Выделяют несколько основных видов, разница между которыми – в материалах, используемых для производства, и таких компонентах как электролит, анод и катод.
Состав – не единственный классификатор. Источники питания также различаются формой, габаритами и пр.
Особенности устройства разных видов батареек
От размеров и формы изделия зависят его конструкционные особенности. Рассмотрим, какие встречаются батарейки.
Цилиндрические
Имеют вытянутый корпус и, как правило, металлическую оболочку, скрывающую внутренние детали. Сразу за «изоляцией» идет слой токопроводящего металла (в солевых источниках питания это цинк). Он соединяется с «минусом».
В центре корпуса батарейки находится графитовый стержень – положительный вывод. В ходе эксплуатации на одну из сторон надевается защитный колпачок, уберегающий от повреждений. Между стержнем и минусовой оболочкой помещен электролит и смесь для деполяризации.
Для удобства маркируются:
Параметр напряжения – до 6 В.
Квадратные
Батарейки в форме кирпичика, выдающие до 9 В напряжения, но используемые довольно редко. Также их называют «крона».
Дороже младших собратьев, массивнее. Есть солевые и щелочные модели. Особенность – в корпусе размещено 6 компактных источников питания по 1.5 В. Каждое отдельное изделие работает по аналогии с пальчиковой или другой батареей.
Материалом корпуса обычно выступает металл, в редких случаях прочный пластик. Выводы «+» и «-» находятся на одной из плоских сторон, сделанной из диэлектрика.
Выбирая такой элемент питания, необходимо смотреть на размеры, так как одинаковые модели, но разных производителей, могут отличаться на 1 – 2 мм. Причина – разная толщина оболочки, уберегающей от повреждений.

Встречаются элементы питания с надписью на корпусе «Rechargeable». Это значит, что батарейку можно зарядить, подключив к специальному зарядному устройству.
Дисковые
Эти источники питания еще называют «таблетками» или «дисками». Сами они маленькие, и используется в компактных приборах и девайсах – наручных часах, настольных весах, фонариках и т.д. Напряжение дисковых батареек не превышает 3 В.
Ассортимент широкий, и подбирая замену, необходимо отталкиваться от прибора, для которого она берется. Как минимум, учитывают габариты установочного места.
Устройство батареи телефона
Батарея, то есть аккумулятор смартфона – элемент, накапливающий запас энергии, необходимый для работоспособности гаджета в течение часов.
Во многих мобильниках стоят литий-ионные (Li-ion) АКБ, состоящие из двух ключевых частей: пары электродов и электролита. Электроды делают из разных материалов – лития, графита и т.д., и все они подразумевают работу с литием в основе.
Литий – активный метал, то есть он вступает в реакцию с остальными элементами. В чистом виде он настолько активен, что воспламеняется на воздухе, поэтому в батареях смартфонов применяются более безопасную версию – литий оксид-кобальта.
Между двумя электродами расположен электролит – обычно жидкое вещество, пропускающее ток. Когда аккумулятор заряжен, молекулы литий оксид-кобальта задерживают электроны, и высвобождают – когда телефоном пользуются.
Li-ion аккумуляторы наиболее распространены, так как при компактных размерах вмещают большой заряд. А для их «восстановления» достаточно подключить зарядное устройство для смартфона.
Примерный химический состав всех батареек
Чаще всего встречаются такие элементы как: никель, кадмий, свинец, литий, ртуть, цинк, марганец, железо, алюминий. Вещества могут комбинироваться, но все одновременно не используются никогда.
Батарейки – источники питания, используемые для работы разнообразных устройств. Подбирая замену, необходимо отталкиваться от параметров прибора-потребителя. Разновидностей немало, у каждой свои особенности. Производители внедряют новые технологии, чтобы сделать элементы питания безопаснее как для человека, так и для окружающей среды.
Что внутри батарейки и как она работает?
Автор Вячеслав Питель · 13:56 05.02.2019
Здравствуйте, уважаемые читатели сайта Uspei.com. В детстве, глядя на молнии, я часто задавалась вопросом, а можно ли поймать их в какую-нибудь изолированную банку и потом питать ей электроприборы? И не замечала, что нечто похожее всегда уже было под рукой – батарейка. Она тоже каким-то образом питала технику, и даже будучи такой маленькой, делала это часами.
Что же такое батарейка – контейнер для электричества или мини электростанция, которая его производит? Как она работает, почему самые плохие из них вздуваются или протекают, и зачем когда-то давно приходилось кусать батарейки?
Кто изобрел батарейку?
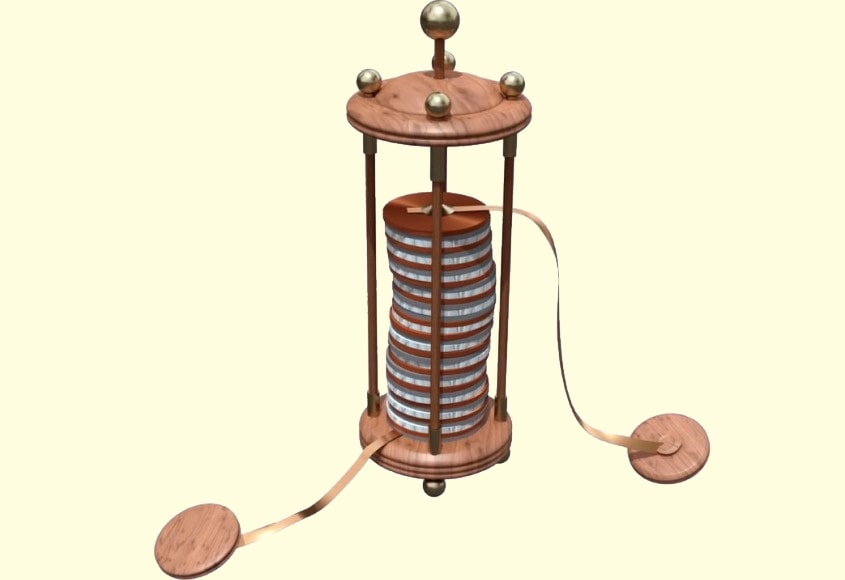
На основе этого Алессандро собрал “вольтов столб”, где находились диски из цинка и меди, соединенные проволокой, а также ткань, пропитанная кислотой. Цинковые пластины растворялись, медные выделяли пузырьки газа, а по проволоке протекал электрический ток. Так был создан прообраз современной батарейки, которая работала на взаимодействии двух металлов в электролите.
Что внутри батарейки?
Как только мы жмем кнопку “включить” создается цепь и электроны через гвоздь устремляются в положительную часть батарейки, на своем пути они проходят через электроприбор и заставляют его работать. Спустя время в катоде образовываются побочные элементы, которые больше не дают электронам перемещаться и батарейка садится.
Чем дешевые батарейки отличаются от дорогих?
Самые простые батарейки, которые стоят копейки, внутри выглядят примерно также, но работают на других материалах. Называются солевые и выпускаются в тех же форматах “три А”, “два А” “С” и “D”.
Иногда этому способствует брак при производстве или несоблюдение очень узкого температурного режима. Начинаются неправильные химические реакции, выделение газа и вздутие батарейки. Хорошие алкалиновые источники таких недостатков лишены, да и корпус у них прочнее.
Почему раньше грызли батарейки?
Как я уже говорила, батарейка садится, когда в катоде накапливаются побочные элементы, они оседают слоем на внутренней части оболочки. Так вот когда грызли довольно податливый корпус этот слой чуть чуть разрушался и батарейка временно оживала.
Но сейчас повторять такое ни в коем случае не советую. Особой пользы не получите, а химии поесть можете. или технику испортите. Лучше вместо этого взять нормальную алкалиновую батарейку с хорошей емкостью. Во второй части расскажу про аккумуляторы и связанные с ними мифы. Например, как правильно их заряжать и что будет, если делать это дольше, чем нужно.
Батарейка (гальванический элемент) — как работает, из чего состоит
Батарейка это прижившееся и не совсем корректное название одиночного гальванического элемента. А уже их соединение в источниках питания для создания нужного напряжения — это батарея. Поэтому не стоит путать эти определения. И если называя гальванический элемент батарейкой, мы поступаем не совсем верно (но смысл понятен), то слово батарея абсолютно никакого отношения не имеет к одиночным химическим источникам электрического тока.
Данный обзор посвящен гальваническому элементу (батарейке) — химическому источнику электрического тока, основанному на взаимодействии двух металлов и (или) их оксидов в электролите, приводящих к возникновению в замкнутой цепи электрического тока. Мы подробно рассмотрим конструктивные особенности элемента, определимся с классификацией и разберемся, как работает батарейка.
История батарейки — гальванического элемента
Свое название гальванические элементы получили по имени итальянского врача и анатома Луиджи Гальвани (1737 — 1798). Проводя опыты с лягушками, Гальвани заметил, что свежепрепарированная лягушачья лапка, подвешенная на медном крючке к железному стержню, сокращается, когда к ней прикасались железом. Наблюдения были истолкованы им как проявление «животного электричества».
Объясняя это явление позже итальянский физик Александро Вольта установил, что причиной сокращения мышц служит не «животное электричество», а наличие цепи из разных проводников в жидкости. Сама лягушачья лапка играла роль чувствительного прибора.
Александро Вольта создал первый источник тока («Вольтов столб»), который можно было использовать на практике. Этот источник состоял из медных и цинковых пластин, между которыми были проложены кружочки ткани, пропитанные раствором щелочи.
Александро Вольта предложил разделить все проводники на два рода:
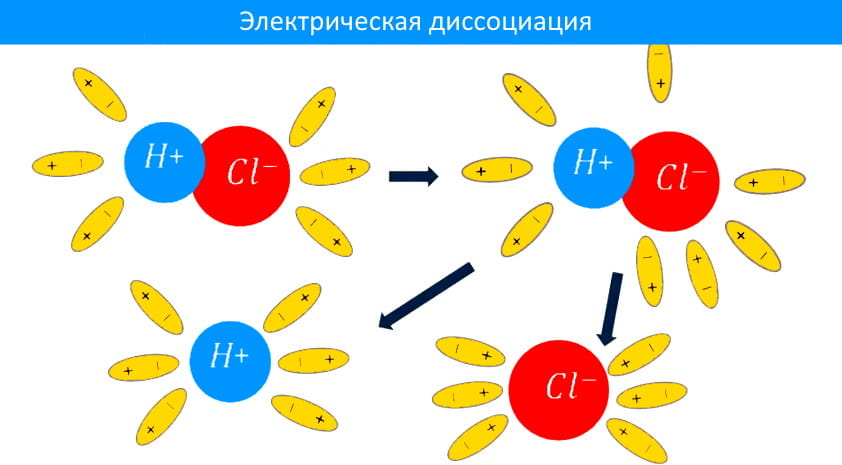
Шведский ученый Сванте Аррениус, изучая электропроводимость растворов различных веществ, в 1877 году пришел к выводу, что причиной электропроводимости является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электрической диссоциацией. При диссоциации в воде электролиты диссоциируют на положительно и отрицательно заряженные ионы. Под действием электрического поля, положительно заряженные ионы движутся к отрицательному полюсу источника тока (катоду) и называются катионами, а отрицательно заряженные – к положительному полюсу (аноду) и называются анионами. Таким образом электролиты обладают электронной проводимостью.
Примеры гальванических элементов:
| Название элемента | Отрицательный электрод | Положительный электрод | Электролит |
| Вольтов столб | Цинк | Медь | Раствор щелочи |
| Первый элемент Вольта | Цинк | Медь | Раствор серной кислоты |
| Элемент Даниэля | Цинк | Медь | Раствор сульфата цинка |
| Элемент Грине | Цинк | Угольный стержень | Раствор сульфата меди и бихромата калия |
| Элемент Лекланше | Цинковый цилиндр | Угольный стержень | Раствор нашатыря и оксид марганца |
| Сухой элемент | Цинковый цилиндр | Угольный стержень | Густой клейстер, приготовленный из муки на растворе нашатыря |
Эволюция батарейки — солевой гальванический элемент
Одним из первых гальванических элементов, которым можно было пользоваться вне лабораторий, была конструкция Жоржа Лекланше (1866 год). Она состояла из цинкового анода, катода из диоксида марганца с углем и электролита из хлорида аммония. Со временем элемент Лекланше эволюционировал в солевой (сухой) гальванический элемент следующим образом:
Конструкция сухой батареи:
 | 1 — воздушная прослойка |
| 2 — цинковый стакан | |
| 3 — электролит (NH4CL + ZnCl2) | |
| 4 — смесь графита и MnO2 | |
| 5 — угольный стержень | |
| 6 — защитный корпус |
Как работает сухая батарейка (солевой гальванический элемент)
Рассмотрим процессы, происходящие в сухом элементе. При потреблении тока электроны поступают через внешнюю электрическую цепь с цинкового электрода на угольный стержень. Происходят следующие реакции:
Во время разрядки цинковый стакан растворяется. Во избежание вытекания электролита или продуктов реакции цинковый стакан имеет запас по толщине или окружен железной защитной оболочкой.
Что находится внутри щелочной батарейки
Впервые щелочные (алкалайновые) батарейки выпустила компания Eveready (Energizer) в 1959 году. Ее принципиальное отличие от сухой батарейки — состав электролита и конструкция. Электролит состоит не из соли аммония, как в солевой, а из раствора щелочи (обычно гидроксида калия). Конструкция элемента вывернута наизнанку по сравнению с конструкцией солевого элемента. То есть, если у солевого элемента корпус (-), а центральный токоотвод (+), то у щелочного элемента наоборот, корпус (+), а центральный токоотвод (-).
В солевых элементах при химической реакции расходуются все реагенты, составляющие этот элемент — анод, катод, электролит. А в щелочном элементе при химической реакции расходуется только анод и катод, электролит не расходуется. Поэтому электролита там совсем мало, и освободившееся место электролита заполнено увеличенным количеством анода и катода, что значительно увеличивает электроемкость щелочного элемента.
Типичная щелочная батарея выполнена в форме стального цилиндра, покрытого изолирующей пластиковой оболочкой. Положительный конец батарейки (катод) имеет выступающую наружу поверхность. Отрицательный конец (анод) — плоский. Эти две клеммы батарейки электрически изолированы друг от друга.
| 1 — никелированный стальной стакан | 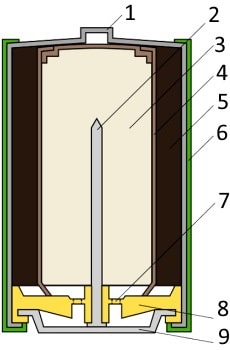 |
| 2 — латунный токосъемник | |
| 3 — анодная паста | |
| 4 — сепаратор | |
| 5 — катодная паста | |
| 6 — защитная оболочка | |
| 7 — предохранительная мембрана | |
| 8 — прокладка | |
| 9 — стальная тарелка |
Корпус батарейки обычно делается из стали с никелевым покрытием. Внутри находится несколько слоев различных материалов, химические реакции которых создают определенные уровни напряжений и токов:
Как работает батарейка
Рассмотрим как работает электрическая батарейка и какие реакции взаимодействия происходят между ее химическими компонентами:
Пока есть полная цепь между выводами батарейки, химическая реакция будет продолжаться, и электроны будут течь от отрицательного клеммника к положительному. Если разорвать цепь, то химическая реакция прекратится.
Наглядно понять, как работает батарейка и что у нее происходит внутри, можно, ознакомившись с представленной ниже видео демонстрацией.
Как работает батарейка — видео
Химическая реакция в батарейке, к которой подключен потребитель:
Форм-фактор распространенных гальванических элементов
| Название | Напряжение, V | Диаметр, мм | Высота, мм | Стандарт (щелочные/солевые) | |
| ANSI | IEC | ||||
| Пальчиковая | 1,5 | 14,5 | 50,5 | AA | LR6/R6 |
| Мизинчиковая | 1,5 | 10,5 | 44,5 | AAA | LR03/R03 |
| Baby | 1,5 | 26,2 | 50 | C | LR14/R14 |
| Mono | 1,5 | 34,2 | 61,5 | D | LR20/R20 |
| 9 V Bloc, Крона | 9 | 26 × 22 ×67 | 1604D | 6LR61/6F22 | |
| CR2032 (монета) | 3 | 20 | 3,2 | 5004LC | CR2032 |
Подведем итог. Гальванический элемент (батарейка) — это источник электрического тока, основанный на химической реакции двух металлов (или их оксидов). Один из металлов (анод) всегда более активный, чем второй (катод). Анод и катод помещены в токопроводящую среду (электролитом). При соединении концов элемента проводником образуется электрическая цепь, начинает вырабатываться ток, который бежит от анода (-) к катоду (+). Несмотря на то, что реальные переносчики заряда (электроны) перемещаются от «минуса» к «плюсу», принято считать, что ток течет от «плюса» к «минусу» (так исторически сложилось).