что находится между молекулами
Аллотропия. Взаимодействие между молекулами
Содержание
Мы уже знаем, что молекула и атомы – наименьшие частицы, составляющие то или иного вещества. Однако, иметь знания о составляющих вещество молекулах недостаточно, чтобы описать его свойства. Например, пар и лед состоят из одинаковых молекул воды, но свойства у них отличаются.
Вспомните конструктор «Лего». Мы высыпаем из коробки просто кучу деталей, которые можно собрать и построить дом или автомобиль, в зависимости от того, каким образом одни и те же детали будут нами соединены.
Аналогично обстоит дело и с веществом. Чтобы его описать, необходимо не только знать атомный и молекулярный состав, но и способы соединения частиц, а также их взаимодействия.
Свойство разных простых веществ состоять из одинаковых частиц называется аллотропией, а сами вещества – аллотропными модификациями.
Самым большим количеством аллотропных модификаций обладает углерод (рисунок 14). Его атом получил свое название от вещества, состоящего из атомов угля.
Из таких же самых атомов состоят сажа, графит и алмаз. Просто атомы в них по-другому расположены и по-другому взаимодействуют. Поэтому, их свойства сильно отличаются: из твердого алмаза делают режущие инструменты, а из мягкого графита – стержни для карандашей.

Взаимное притяжение молекул
Если же все молекулы находятся в беспрерывном движении, почему твердые и жидкие тела не распадаются? Значит, молекулы как-то взаимодействуют между собой, взаимно притягиваются друг к другу.
Но, если вы сломаете карандаш, он же не склеится обратно? Из этого можно сделать просто вывод, что притяжение между молекулами действует только на очень коротком расстоянии. Притяжение между молекулами разных тел неодинаково, что объясняется различной прочностью.
Рассмотрим следующий опыт: если у двух цилиндров идеально ровно срезать поверхности и прижать их друг к другу, вам удастся разорвать их только при большой нагрузке (рисунок 16).

Заметим, что притяжение между молекулами становится заметным, когда расстояние между ними не превышает размеров самих молекул.
Если мы попытаемся таким же образом соединить осколки стекла, то из-за неровностей у нас ничего не выйдет – расстояние между молекулами окажется слишком велико.
Но если нагреть куски стекла, то стекло станет возможно починить. На том же принципе происходит соединение кусков металла при сварке или пайке.
Но почему тогда между молекулами существуют промежутки? По логике вещей, они должны намертво слипнуться. Но этого не происходит, поскольку между молекулами (атомами) в то же время существуют силы отталкивания.
На расстояниях, сравнимых с размерами самих молекул (атомов), заметнее проявляется притяжение, а при дальнейшем сближении – отталкивание (рисунок 17).
Рассмотрим примеры, подтверждающие существование отталкивания между молекулами. Если вы несильно скомкаете лист бумаги, постепенно он начнет расправляться, так как при сжатии молекулы оказались настолько близко друг к другу, что начало проявляться отталкивание. Другие явление связаны со смачиванием твердого тела жидкостью. Взгляните на рисунок 18.

На пружине с помощью нитей закреплена стеклянная пластина, ее подносят к емкости с водой так, чтобы она легла на поверхность жидкости.
Когда мы пытаемся оторвать платину от поверхности воды, пружина заметно растягивается. Это доказывает существование притяжения между молекулами.
К тому же, мы можем заметить, что стеклянная пластина теперь покрыта тонким слоем воды – это значит, что разрыв произошел там, где молекулы воды соприкасаются друг с другом, а не с поверхностью стекла.
Благодаря эффекту смачивания мы можем вытирать мокрые предметы, но с другой стороны, вода может и не смачивать тела (парафин/воск/жир) – это означает, что молекулы жидкости притягиваются друг к другу с большей силой, чем к молекулам твердого тела.
Урок 4. Взаимодействие молекул
В уроке 4 «Взаимодействие молекул» из курса «Химия для чайников» выясним что из себя представляет межмолекулярное взаимодействие; рассмотрим влияние сил Ван-дер-Ваальса на температуры плавления и кипения; определим роль электроотрицательности в образовании ковалентной полярной и водородной связи. Но нельзя обсуждать взаимодействие молекул, не зная их строения, поэтому не пройдите мимо прошлого урока «Схема образования молекул».
Межмолекулярное взаимодействие
Между молекулами в веществе всегда присутствует некоторое притяжение друг к другу, которое называется межмолекулярным взаимодействием. Притяжение молекул друг к другу не такое сильное, как взаимодействие между атомами в молекуле, и недостаточно для образования химических связей, но достаточно для того, чтобы сделать их слегка «клейкими» друг к другу.
Силы Ван-дер-Ваальса
Силы взаимодействия молекул, вызываемые мгновенными флюктуациями распределения электронов в атомах, называются силами Ван-дер-Ваальса. Заумно прозвучало? Далее все встанет на свои места. Силы Ван-дер-Ваальса являются одним из видов межмолекулярного взаимодействия, но можно считать эти силы взаимодействия молекул основными. Просто запомните, что именно благодаря силам Ван-дер-Ваальса в природе существуют три агрегатных состояния вещества.
Температура плавления и кипения
Ковалентная полярная химическая связь
«Силу» атома определяет его электроотрицательность: чем больше электроотрицательность химического элемента, тем сильнее он притягивает к себе электроны.
Постарайтесь запомнить самые электроотрицательные химические элементы в порядке возрастания их электроотрицательности: I, Br, N, Cl, O, F. За помощью вы всегда можете обратиться к таблице электроотрицательности, которая расположена ниже.
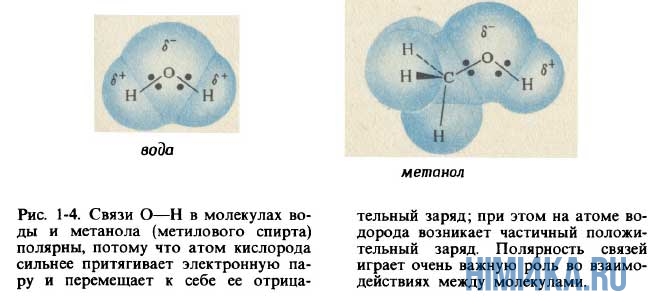
Образование водородной связи
Очевидно, что молекулы воды образованы ковалентной полярной химической связью, поскольку электроотрицательность кислорода больше, чем у водорода. Поэтому атом кислорода в молекуле воды несет в себе небольшой отрицательный заряд, а атомы водорода — небольшие положительные заряды.
Надеюсь урок 4 «Взаимодействие молекул» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Основные агрегатные состояния вещества
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений.
Заполняем нашу табличку
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.
Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
График фазовых переходов
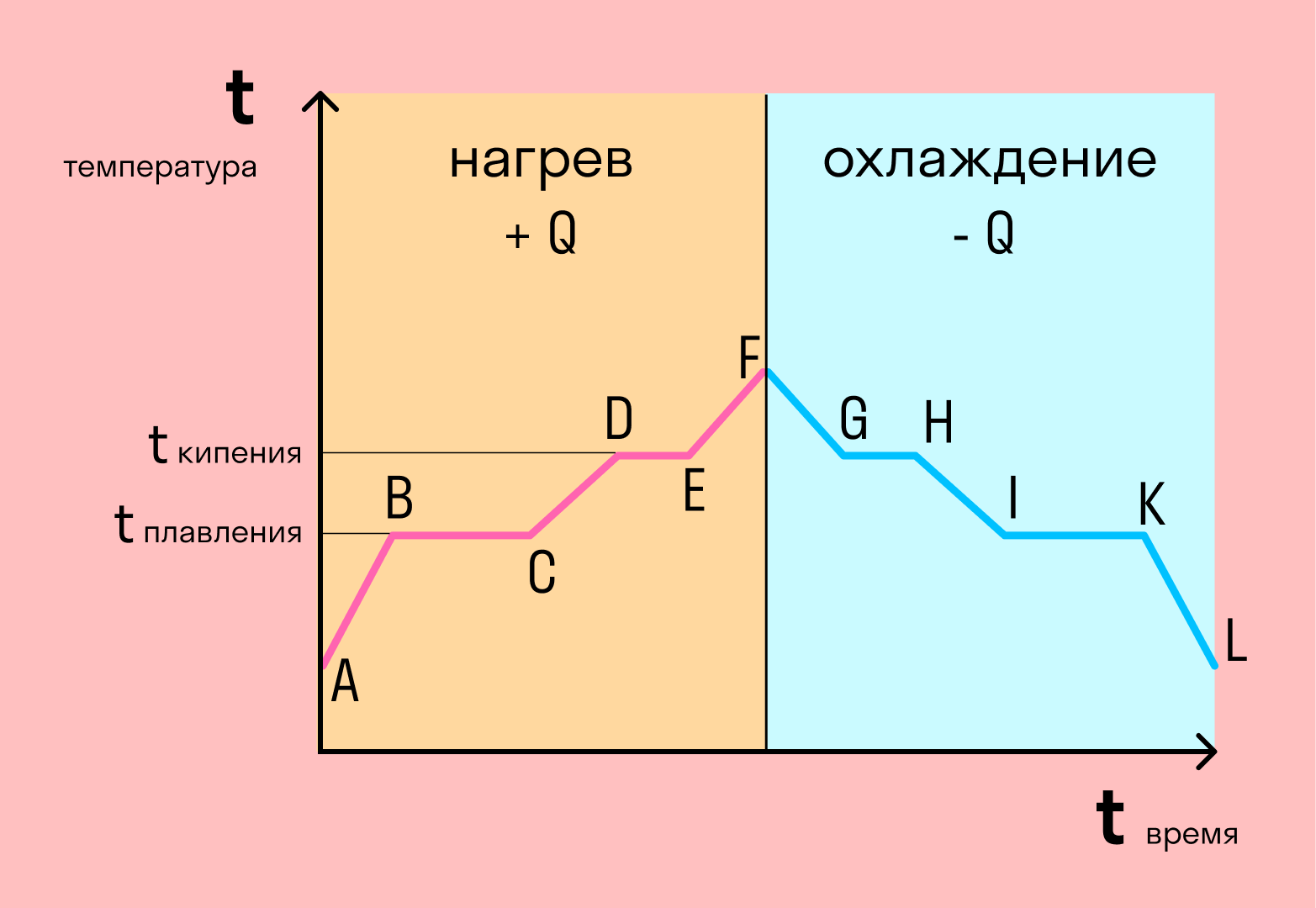
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
Разбираемся по шагам. Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов).
После того, как лед нагрелся до температуры плавления, он начинает плавиться. Плавление происходит при постоянной температуре тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
Расправившись вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс аналогично плавлению происходит при постоянной температуре. Данный процесс нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
Первый шаг в обратную сторону — охлаждение до температуры кипения.
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Плавление
Кристаллизация
Q — количество теплоты [Дж]
λ — удельная теплота плавления вещества [Дж/кг]
m — масса [кг]
Парообразование
Конденсация
Q — количество теплоты [Дж]
L — удельная теплота парообразования вещества [Дж/кг]
m — масса [кг]
Онлайн-уроки физики в Skysmart не менее увлекательны, чем наши статьи!
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг умножить на °С)
Q = 380 * 0,1*(60-20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ=80кДж/кг. Теплопотерями пренебречь.
80 кДж/кг = 80000 Дж/кг
Q = 80000*2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
Примерчики из жизни🤓
Про принтеры. Цветные принтеры (только не лазерные) печатают путем сублимации. Вот как это работает: частицы краски быстро переходят из твердого состояния в газообразное и оседают на бумаге — так получается цветная картинка.
Рисуночки на окнах. Если вы решите проехаться на автобусе в холодную погоду — увидете на стеклах чудесные узоры. Из-за огромной разницы температур между улицей и автобусом, мы можем наблюдать процесс десублимации в виде красивых рисунков на стеклах. Иней образуется похожим способом — резкое похолодание приводит к десублимации воздуха.
Влажность воздуха: испарение и конденсация
Такие процессы, как испарение и конденсация, становятся более логичными и простыми, если их рассмотреть на примере влажности воздуха.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Любое количество пара в воздух не запихнешь, поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Как влажность влияет на человека
Для человека влажность очень важна, потому что мы состоим из воды на 90%. Если окружающей среде нечего испарять, она будет испарять нас. Поэтому при низкой влажности мы чувствуем сухость во рту, а при высокой — волосы впитывают влагу, разбухают и начинают виться. На этом принципе построены некоторые гигрометры — приборы для измерения влажности. Они так и называются — волосяные гигрометры. Только внутри не человеческий волос, а конский, но принцип от этого не меняется.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой, но при высокой влажности пот не может испариться. При испарении пота мы теряем избыточное тепло, а в данном случае этого не происходит.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно, а при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.
Влажностью можно управлять. Существуют мешочки с шариками адсорбентами, которые кладут в коробки с обувью, чтобы впитать лишнюю влагу. Чтобы окна не запотевали, можно насыпать в рамы соль, которая также впитает влагу. А если вам наоборот нужно больше влаги — берем увлажнитель воздуха (классная вещь!): он добавляет в воздух водяной пар.
Межмолекулярное строение твердых тел, жидкостей и газов. Агрегатные состояния
Содержание
Чтобы подробнее рассмотреть свойства веществ, нам необходимо разобраться в их молекулярном строении.
Рассмотрим пример. После дождя появилась лужа. Если ударит мороз, и лужа замерзнет, то по ней уже можно будет проехаться. В жару вода из лужи быстро испарится, превратившись в пар. Но разве в этих случаях лужа будет состоять из другого вещества?
Нет, она все так же состоит из одних и тех же молекул. Лед, пар и вода – это одно и то же вещество, но молекулы в нем могут по-разному располагаться и взаимодействовать.
В таких случаях говорят, что вещество способно пребывать в разных состояниях или переходить из одного в другое (рисунок 19).

Агрегатные состояние – это состояния одного вещества, при которых его свойства значительно различаются. Оно определяется расположением молекул вещества и характером их движения. Различают 3 основных агрегатных состояния: твердое, жидкое и газообразное.
Но у веществ существуют и другие состояния. При очень больших температурах молекулы склонны распадаться на составляющие их атомы, ионы и электроны, о которых пойдёт речь позже. Из этих частиц состоит плазма – одно из состояний вещества.
Мы можем ее наблюдать в виде пламени костра или свечи. Вещества, из которых состоит Солнце, тоже пребывают в плазменном состоянии, плазма в атмосфере вызывает полярное сияние. На свойствах плазмы базируется принцип работы плазменных телевизоров.
Бывают неустойчивые состояния веществ: переохлажденные или перегретые жидкости. Они достигаются охлаждением жидкости ниже температуры кристаллизации либо нагревом ее выше температуры испарения при определенных условиях. При этом, незначительное внешнее воздействие на такую жидкость вызывает ее резкий переход в твердое либо газообразное состояние.
Но сейчас мы рассмотрим подробнее основные агрегатные состояния.
Твердое
Твердым можно назвать любой предмет, сохраняющий свою форму, если его специально не разрушать. Другими словами – это такое агрегатное состояние вещества, при котором оно сохраняет свой объем и форму.
Молекулы/атомы в таком веществе находятся на определенных позициях, они могут колебаться на своих местах, но их положение по отношению к другим молекулам/атомам практически не меняется (рисунок 20).
В твердых кристаллических веществах атомы образуют кристаллическую решетку (лед, соль, металлы и др.) (рисунок 21).


В твердых телах притяжение между молекулами (атомами) намного больше, чем у жидкостей. Поэтому в обычных условиях твердые тела сохраняют свою форму и объем.
В твердых аморфных веществах атомы расположены беспорядочно, не имеют кристаллической структуры, но и не находятся в постоянном движении (смола, янтарь). Обычно характеризуются невысокой температурой плавления, из-за чего могут легко переходить в другое агрегатное состояние и обладать текучестью.
Жидкое
К жидкостям относят тела, изменить форму которых очень легко. Например, налить воду из графина в стакан (рисунок 22). Чего нельзя сказать про их объем.
Наполним шприц водой, закроем пальцем отверстие и попробуем сжать воду. У нас ничего не получится. Жидкость – практически несжимаема. Это такое агрегатное состояние, в котором тело способно сохранять свой объем, но не сохраняет форму.

Молекулы жидкости находятся довольно близко (расстояние между каждыми двумя молекулами меньше размеров молекул) и их взаимодействие ощутимое. Молекулярное строение жидкости представлено на рисунке 23.

Также на свойстве жидкости легко изменять свою форму основано изготовление предметов из расплавленного стекла (рисунок 24).

Молекулы жидкости не расходятся на большие расстояния и жидкость в обычных условиях сохраняет свой объем, но не сохраняет форму.
В состоянии невесомости жидкость имеет форму шара, потому что внешние силы уравновешены и форма определяется только силами молекулярного взаимодействия. У последних нет единого направления, поэтому форма жидкости симметрична в любых направлениях.
Газообразное
Большинство газов бесцветны и прозрачны, а потому невидимы. Его присутствие мы можем почувствовать при дуновении ветра, сквозняка в комнате или же на примере простых опытов (рисунок 25).

Опустим в воду воронку, предварительно соединив ее резиновой трубкой со стеклянной трубочкой. Из трубочки начнут выходить пузырьки воздуха, которые до этого были в воронке и во всей системе в целом. Подобные простые опыты подтверждают наличие воздуха вокруг нас.
Молекулы газа находятся на больших расстояниях друг от друга и в постоянном хаотичном движении. Поэтому часто взаимодействие между молекулами газа не учитывается, и большое пространство между частицами позволяет сильно сжимать газы. Молекулярное строение газа представлено на рисунке 26.

Газы не имеют собственной формы и постоянного объема. Они принимают форму сосуда и полностью заполняют предоставленный им объем.