что можно узнать по диаграмме состояния сплавов
Диаграммы состояния сплавов
Диаграммы состояния сплавов дают возможность правильно выбрать сплав, характеризуют его поведение при обработке, физические и механические свойства. Существуют различные типы диаграмм состояния в зависимости от числа компонентов и характера их взаимодействия друг с другом в твердом состоянии.
Для сплавов, состоящих из двух компонентов, выделяют четыре основных типа диаграмм состояния.
Диаграмма состояния 1-го рода характеризует сплавы (например, свинца с сурьмой), у которых компоненты в жидком виде полностью растворимы, а в твердом образуют механическую смесь.
Диаграмма состояния 2-го рода соответствует сплавам, у которых компоненты и в жидком, и в твердом состоянии неограниченно растворимы друг в друге (например, сплав меди и никеля).
Диаграмма состояния 3-го рода характеризует сплавы, компоненты в которых в жидком виде неограниченно растворимы, а в твердом состоянии ограниченно растворимы друг в друге (например, сплавы медь – серебро, сурьма – германий и др.)
а) кривые охлаждения; б) диаграмма состояния сплавов Рв – Sв
Рисунок 3- Построение диаграммы сплавов
свинец – сурьма по кривым охлаждения
Диаграмма состояния 4-го рода соответствует сплавам, которые в процессе кристаллизации образуют химическое соединение (например, сплав медь – германий).
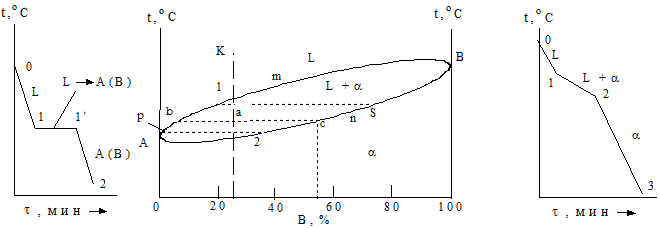
На рисунке 3 показано, как по кривым охлаждения, полученным методом термического анализа, можно построить диаграмму 1-го рода для сплавов свинец – сурьма.
Второй сплав (кривая 3) кристаллизуется аналогично первому, но точка начала кристаллизации у него ниже, а заканчивается кристаллизация также при 246°С, когда концентрация сурьмы достигает 13%.
Третий сплав (кривая 4) кристаллизуется полностью при одной температуре (246°С) с одновременным выпадением кристаллов свинца и сурьмы. Четвертый сплав (кривая 5) начинает кристаллизоваться при 500°С с выделением избыточных кристаллов сурьмы. В жидком сплаве сурьмы становится все меньше, и, когда ее содержание снизится до 13%, при 246° произойдет окончательная кристаллизация.
Все точки начала и конца кристаллизации с кривых охлаждения перенесем на диаграмму свинец-сурьма. Соединив все точки начала кристаллизации, получаем линию АСВ. Эта линия называется линией ликвидус. Все сплавы при температурах выше линии ликвидус находятся в жидком состоянии. Линия МСN называется линией солидус. Ниже этой линии все сплавы находятся в твердом состоянии. В интервале температур между ликвидусом и солидусом в любом сплаве имеются две фазы: жидкий сплав (ж.с.) и крупные первичные кристаллы одного из компонентов. В области МАС структурными составляющими являются жидкий сплав и кристаллы свинца, а в области CBN- жидкий сплав и кристаллы сурьмы.
Сплав, содержащий 13% сурьмы и кристаллизующийся при постоянной температуре 246°С, называется эвтектическим. Он имеет самую низкую для данной системы сплавов температуру кристаллизации, а его структура представляет собой мелкокристаллическую механическую смесь кристаллов свинца и сурьмы (эвтектику). Сплавы, содержащие менее 13% сурьмы,
называются доэвтектическими, а более 13% сурьмы – заэвтектическими.. В структуредоэвтектическихсплавов наряду с эвтектикой имеются кристаллы свинца, в заэвтектических – наряду с эвтектикой кристаллы сурьмы.
С помощью правила фаз и правила отрезков можно проводить анализ диаграмм состояния различных сплавов, т.е. определять фазовый и структурный состав заданного сплава при любой температуре и концентрации компонентов, а также характер зависимости ряда физико-механических свойств сплавов от типа диаграммы состояния того или иного сплава.
2.3 Диаграмма состояния железо – цементит
В различных областях техники наиболее широко применяют железо-углеродистые сплавы – стали и чугуны. Состояние этих сплавов при различных температурах в зависимости от концентрации компонентов описывается в графической форме диаграммой железо-цементит.
Углерод – твердое вещество, бесцветное. Углерод растворим в железе в жидком и твердом состояниях. В железоуглеродистых сплавах может находиться в виде свободного графита и химически связанного соединения – карбидов железа ( 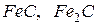
позволяет определить количественный (%) и качественный (тип структуры) состав структурных составляющих в любом агрегатном состоянии; установить критические точки, отвечающие превращениям в любом железоуглеродистом сплаве в зависимости от температуры и концентрации компонентов; выбрать сплавы с нужной температурой плавления; определить температуры начала и конца горячей обработки давлением (ковки, штамповки, прокатки, прессования); установить температуру нагрева сталей для всех видов термической обработки (отжига, нормализации, закалки и отпуска закаленной стали, термомеханической обработки).
При металлографическом исследовании сталей и чугунов с помощью металлографического микроскопа можно обнаружить следующие составляющие микроструктуры.
Цементит – химическое соединение железа с углеродом 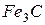
хрупок. Под микроскопом цементит имеет вид темных округлых зерен, темной или светлой сетки, расположенной по границам зерен, или выглядит в виде игл.
химической стойкостью, хорошей сопротивляемостью истиранию и большой вязкостью. Аустенит имеет невысокие твердость (НВ 160-200) и прочность 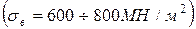
Перлит – эвтектоидная мелкозернистая механическая смесь феррита с цементитом. Перлит обладает невысокой твердостью (НВ 160-200) удовлетворительной прочностью 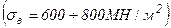
Ледебурит–механическая смесь кристаллов, образующаяся из жидкой фазы определенного состава (4,3 % С). при температуре 1147°С и до 727°С ледебурит состоит из двух фаз – аустенита и цементита; ниже 727°С ледебурит состоит из перлита и цементита, т.е. также из двух фаз, но только уже из феррита и цементита. Содержание углерода в ледебурите всегда постоянно и равно 4,3 %. Ледебурит обладает высокой твердостью, прочностью, но малой пластичностью. Ледебурит всегда присутствует в структуре белого чугуна.
Диаграмма 
Линия АВСD – линия ликвидус. Выше этой линии стали и чугуны находятся в жидком состоянии, представляющем собой жидкий раствор (жидкую фазу).
 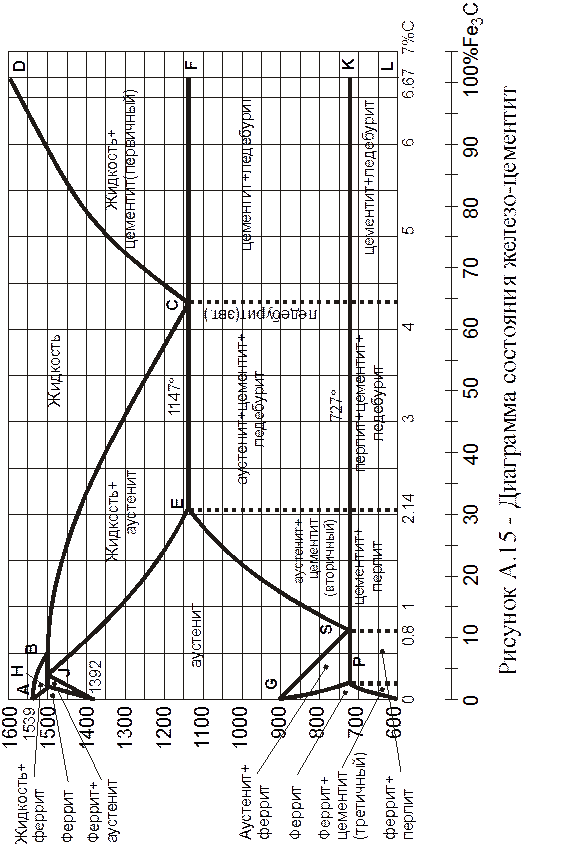 |
Линия AHJECF – линия солидус. Ниже этой линии все сплавы находятся в твердом состоянии. Все сплавы, содержащие более 2,14% С (чугуны), затвердевают или начинают плавиться при одной и той же температуре 1147°С (линия ЕСF).
Разница между эвтектической и эвтектоидной смесями заключается в том, что эвтектика (продукт первичной кристаллизации) образуется при одновременной кристаллизации двух фаз из жидкого раствора (ледебурит в чугунах). Эвтектоид – продукт вторичной кристаллизации – образуется при распаде твердого раствора (например, перлит из аустенита в сталях).
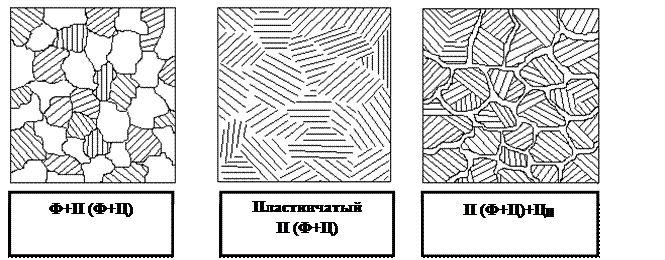
Таким образом, доэвтектоидные стали ниже 727°С имеют структуру, состоящую из феррита и перлита.
Линия ES при охлаждении соответствует температурам начала распада аустенита с выделением из него цементита. Цементит, выделяющийся из аустенита, в отличие от цементита, кристаллизующегося из жидкой фазы, называют вторичным. Структура заэвтектоидных сталей состоит из перлита и вторичного цементита.
Ниже линии ES (1147°С ) при содержании в сплавах 2,14-4,3 % углерода из аустенита, пересыщенного углеродом, выпадает вторичный цементит.
а) доэвтектоидной; б) эвтектоидной; в) заэвтектоидной.
Рисунок 5 – Схемы типичных микроструктур сталей
ГЛАВА 3. ОСНОВЫ ТЕРМИЧЕСКОЙ ОБРАБОТКИ И
Дата добавления: 2015-10-26 ; просмотров: 7193 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Диаграммы состояния сплавов. Их типы и построение
Процесс кристаллизации металлических сплавов и связанные с ним закономерности их строения описываются диаграммами состояния или фазового равновесия.
Диаграмма состояния – графическое изображение фазового состава и структуры любого сплава в зависимости от его концентрации и температуры. Она показывает устойчивые состояния, которые при определенных условиях обладают минимумом свободной энергии, и какие равновесные фазы существуют в системе в данный момент. Поэтому ее еще можно назвать диаграммой равновесия.
Построение диаграмм фазового равновесия осуществляют разнообразными экспериментальными приемами. Наиболее часто пользуются способом термического анализа. Сущность данного метода заключается в следующем. Отбирают несколько сплавов с различным соотношением масс входящих в них компонентов. Сплавы нагревают до их расплавления, далее охлаждают и фиксируют скорость процесса, измеряя температуру и время. По результатам замеров строят термические кривые в координатах температура – время. В ходе анализа получают серию графиков охлаждения или нагревания, на которых при температурах фазовых превращений наблюдаются точки перегибов и температурные остановки. Температуры, соответствующие данным переходам, называются критическими точками.
Для более полного построения диаграмм плавкости в дополнение к термическому анализу при изучении строения и структуры фаз сплавов применяют микроскопический и рентгеноструктурный методы. Используя полученные кривые охлаждения (нагревания), методом параллельного переноса строят диаграмму состояния сплава в координатах температура – концентрация. Для двухкомпонентной системы по оси ординат (две) откладывают температуру, на оси абсцисс – концентрацию.
Общая концентрация обоих компонентов в сплаве равна 100 %, и любая точка на оси абсцисс отвечает определенному содержанию каждого компонента. По мере удаления, например, от точки А увеличивается концентрация второго элемента и в конце (пункт В) она достигнет 100 %. Поэтому обе крайние ординаты на диаграмме описывают температуру чистых металлов (рис. 1.21).
|
|
|
|
|
|
Каждая точка на диаграмме показывает состояние сплава заданной концентрации при определенной температуре. Любая вертикаль отвечает изменению температуры сплава конкретного состава.
Если оба элемента сплава неограниченно растворяются друг в друге как в жидком, так и в твердом виде, то возможно существование только двух фаз – жидкого L и твердого растворов a (с = 2 – 2 + 1 = 1). Следовательно, трех фаз быть не может, кристаллизация при постоянной температуре не наблюдается и горизонтальная линия на диаграмме отсутствует.
Затвердевание чистых металлов, например системы Cu – Ni, описывают кривыми охлаждения (рис. 1.22, график 1).
|
|
|
|
|
|
|
|

Рис. 1.23 – Схема формирования микроструктуры сплавов с неограниченной растворимостью компонентов, например медь-никель
Наблюдаемые критические точки для нескольких сплавов переносят на график зависимости концентрации сплава от температуры, все пункты начала кристаллизации и конца затвердевания соединяют между собой двумя линиями и получают диаграмму состояния. Такие диаграммы характерны для металлов, которые имеют одинаковую кристаллическую решетку с мало различающимися параметрами, например, пары медь-никель, a-железо-хром и некоторые другие.
На диаграмме состояния указывают фазовый состав и структуру сплавов в различных ее областях.
Проведем анализ диаграммы для сплава, содержащего 25 % Ni и 75 % Cu. Для этого используем правило отрезков или рычага. Оно применимо только для двухфазных систем и заключается в том, что через точку а, характеризующую состояние данного сплава, проводят горизонтальную прямую (коноду) до пересечения ее с линиями ликвидуса и солидуса. Точки пересечения этой прямой с кривыми диаграммы (б и с) отображают на ось концентраций. Проекции этих точек покажут состав жидкой и твердой фаз сплава. Так в (•)с это будет твердый раствор a, количественный состав которого соответствует около 45 % Ni и 55 % Cu (рис. 1.21).
Второе положение правила отрезков позволяет определять количественное соотношение фаз системы при любой температуре. Для этого вновь обратимся к прямой, проведенной через точку а на рис. 1.22. Составы жидкой и твердой фаз будут определяться проекциями ее пунктов пересечения (б и с) на линиях ликвидуса и солидуса соответственно. Количество фаз обратно пропорционально отрезкам проведенной прямой: часть жидкого состояния Qж/Qс = ас/bc;а доля твердой фазы Qт/Qс = ba/bc,где Qж – количество жидкого расплава; Qт – содержание кристаллов твердого тела; Qс – масса сплава.
Рассмотрим диаграммы состояния сплавов, в которых оба его элемента неограниченно растворимы друг в друге в жидкой фазе, ограниченно в твердом состоянии и совместно химически не взаимодействуют.
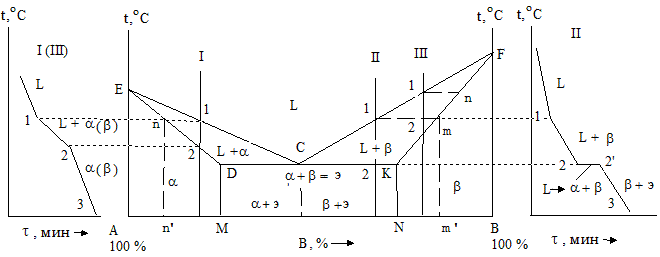
В данной системе не образуются фазы, представляющие собой чистые элементы. Из жидкости выделяются только твердые растворы. На диаграмме около вертикалей А и B, соответствующих свободным компонентам, располагаются области существования твердых растворов a и b (рис. 1.24). Предельные растворимости B в A и наоборот определяются линиями DM и KN. Окончание кристаллизации образующейся структуры сплава происходит по эвтектической реакции Lс ® ad + bk. Кривые ECF – линия ликвидуса, а EDCKF – солидуса соответственно.
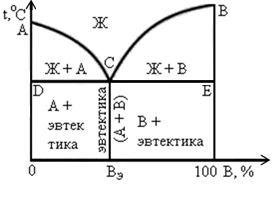
Сплавы с концентрацией сурьмы меньше 13 % называются доэвтектическими. Состав их отмечается на диаграмме левее точки С. Структура такой системы содержит кристаллики свинца и эвтектики, состоящей из мелких зерен свинца и сурьмы. Система, отвечающая формуле эвтектики (13 % сурьмы), именуется эвтектической. Сплавы с содержанием сурьмы больше 13 % называются заэвтектическими. Их строение – это избыточные кристаллики сурьмы плюс эвтектика. На диаграмме состояния отрезок СF определяет их состав.
Диаграммы четвертого типа описывают затвердевание систем с образованием химического соединения между компонентами (рис. 1.27). Таким образом, пользуясь диаграммой состояния системы, можно легко определить температуру начала и конца плавления (затвердевания) любого сплава, а также структурные составляющие, которые он имеет в твердом состоянии.
|
Рис. 1.28. Диаграмма состав – свойство сплавов при различных типах взаимодействия компонентов
Вопросы для самопроверки
1. Что такое механическая смесь? Когда при затвердевании сплавов в их структуре образуются механические смеси?
2. Что такое твердый раствор? Какие виды твердых растворов Вы знаете?
3. Чем отличается твердый раствор замещения от твердых растворов внедрения и вычитания?
4. Какие условия необходимы для неограниченной растворимости металлов?
5. Что такое эвтектика и когда она образуется? Опишите ее процесс кристаллизации.
6. Дайте определение и математическое выражение правила фаз Гиббса. Какие параметры системы оно связывает между собой? Для чего оно применяется?
7. Определите число фаз, их структуру и количество при разных температурах и составах сплавов между линиями ликвидус и солидус в двухкомпонентной системе с полной взаимной растворимостью в жидком и твердом состояниях. Что такое конода?
8. Нарисуйте схему структуры твердого раствора?
9. Как получить пересыщенный твердый раствор в системе сплавов с ограниченной растворимостью? Как называется такой технологический процесс?
10. Что такое диаграмма состояния или плавкости сплава? Что она характеризует?
11. Опишите сущность термического метода построения диаграмм плавкости сплавов. Какие виды диаграмм Вы знаете.
12. Что такое линии ликвидус и солидус? Как с их помощью можно определить структуру образующегося сплава?
13. Что такое правило отрезков или рычага? Как оно позволяет определить состав сплава и соотношение фаз в нем по диаграмме состояния?
Дата добавления: 2015-09-21 ; просмотров: 4524 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Металлические сплавы и диаграммы состояния
Сплавами являются твёрдые вещества, получаемые сплавлением двух или более простых веществ, называемых компонентами. В металлическом сплаве основными компонентами являются металлы. Для металлического сплава меняя соотношение компонентов, можно получить бесчисленное множество вариантов сплава, и каждый вариант будет иметь свою структуру и свойства, температуру плавления, затвердения и т.д.
В технике большинство сплавов получают взаимным растворением их составляющих в жидком состоянии, т.е. доводят компоненты до плавления. Однако сплавы могут быть получены в твёрдом состоянии в процессе смешивания и спекания порошков компонентов под давлением при высоких температурах. Расплавленные компоненты при охлаждении и кристаллизации могут образовывать твердые металлические сплавы с различным строением: смеси, твердые растворы, химические соединения.
Наиболее часто встречающиеся сплавы – твёрдые растворы, в которых компоненты в твердом состоянии частично или полностью растворены друг в друге. Можно просто представить понятие твёрдого раствора можно, если, например, заморозить солёную воду. В этом случае лёд уже будет представлять собой твёрдый раствор соли в воде.
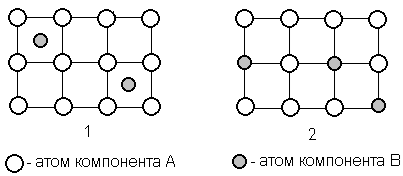
Растворение атомов одного из компонентов в кристаллической решётке другого компонента может идти по типу внедрения, когда атомы растворенного элемента располагаются между атомами растворителя (рисунок 1.1), и по типу замещения, когда атомы растворенного элемента замещают атомы растворителя (рисунок 1.2).
Рисунок 1 – Строение твёрдого раствора внедрения и замещения
При образовании твёрдого раствора внедрения его растворимость всегда ограниченная, что связано с ограниченными размерами межатомных промежутков в кристаллической решётке растворителя.
Чем больше концентрация твёрдого раствора, тем больше увеличены межатомные расстояния в решетке. Такие твёрдые растворы возникают при сплавлении металлов с неметаллами, имеющими малый атомный радиус – углеродом, азотом, бором, водородом. Примером твёрдых растворов внедрения, имеющих промышленное значение, являются твёрдые растворы углерода в ОЦК и ГЦК решётке железа – феррит и аустенит.
Информация о состоянии и структуре сплавов просто и сжато может быть представлена в виде диаграммы состояния – графического изображения состояния сплавов в зависимости от температуры и концентрации компонентов. Такие диаграммы также называют структурными с добавлением слова равновесные, что указывает на образование таких фаз и структур, которые соответствуют наименьшему значению свободной энергии системы.
На любой диаграмме состояния можно выделить следующие точки и линии:
Ликвидус – точка, отвечающая началу кристаллизации.
Линия ликвидус – геометрическое место точек ликвидус.
Солидус – точка, отвечающая концу кристаллизации.
Линия солидус – геометрическое место точек солидус.
Фигуративная точка– точка, взятая в пределах диаграммы состояния, которая показывает температуру сплава, его состояние, процентное соотношение компонентов.
Фигуративная линия – линия, проходящая через фигуративную точку параллельно оси температур.
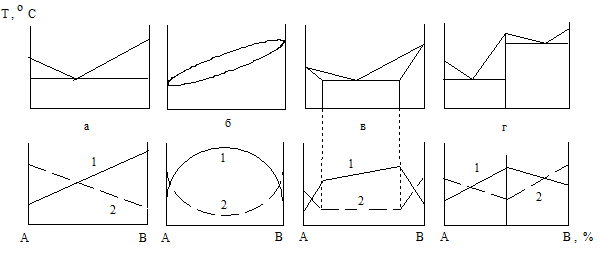
Рассмотрим основные диаграммы состояния двойных сплавов.
Рисунок 2 – Диаграмма состояния I рода
Диаграмма состояния II рода характерна для сплавов с неограниченной растворимостью компонентов друг в друге, имеющих одинаковые типы кристаллических решеток. Диаграмма (рисунок 3) содержит область жидкой фазы (выше линии ликвидус АСВ), двухфазную область α + Ж, расположенную между линиями АСВ и АDВ, область твердой фазы α (ниже линии солидус АDВ). Фаза α представляет собой твердый раствор компонентов А и В, азерна этой фазы имеют общую кристаллическую решетку.
Рисунок 3 – Диаграмма состояния II рода
Диаграмма состояния III рода характерна для сплавов с ограниченной растворимостью компонентов друг в друге. На диаграмме (рисунок 4) линия АDВ является линией ликвидус, а линия АСDЕВ – линией солидус. Фаза α является твердым раствором компонента В в компоненте А, а фаза β – твердым раствором компонента А в компоненте В. Эвтектика для рассматриваемой диаграммы представляет собой смесь мелкозернистых фаз α и β. Эвтектика кристаллизуется при наименьшей для данной системы температуре, т.е. на линии СЕ.
Линия СF показывает предельную растворимость компонента В в компоненте А, а линия ЕК – предельную растворимость компонента А в компоненте В. Ниже линии СF из α-фазы начинают выделяться атомы компонента В, образуя вторичные кристаллы βIIβ-твер-дого раствора. Аналогично ниже линии ЕК из β-фазы выделяются атомы компонента А, образуя вторичные кристаллы αIIα-твердого раствора. Структура доэвтектических сплавов ниже линии СЕ состоит из первичных зерен α-фазы, эвтектики (α + β) и зерен вторичной βII-фазы. А структура заэвтектических сплавов состоит из первичных зерен β-фазы, эвтектики (α + β) и зерен вторичной αII-фазы.
Рисунок 4 – Диаграмма состояния III рода
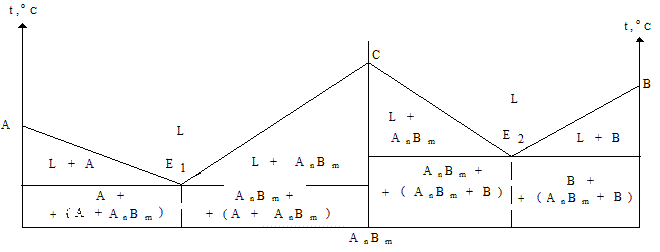
Диаграмма состояния IV рода (рисунок 5) относится к сплавам, в которых сплавляемые компоненты образуют устойчивое химическое соединение АтВп. Поэтому в данном случае химическое соединение выступает в роли самостоятельного компонента, способного образовывать сплавы с каждым из исходных компонентов.
Химическое соединение АтВп образует с компонентами А и В сплавы, которые характерны для диаграммы состояния I рода.
Рисунок 5 – Диаграмма состояния IV рода
Рисунок 6 – Изменение твёрдости и электрического сопротивления в зависимости от рода диаграммы
Для сплавов и компонентов, образующих химическое соединение, максимальные значения твердости и электрического сопротивления наблюдаются при концентрации компонентов, соответствующих химическому соединению (рисунок 6,г).
Таким образом, если известны характер взаимодействия между компонентами и тип диаграммы состояния, то возможен выбор состава сплава, обеспечивающего заданные физико-химические свойства.
1. Что такое сплав? Что является компонентами для металлического сплава? Сколько компонентов должно присутствовать, чтобы вещество можно было назвать сплавом?
2. Способы получения сплава.
3. Типы растворения твёрдых растворов. Показать на рисунке. Какой тип растворения способствует увеличению межатомных расстояний.
4. Что такое диаграмма состояния?
5. Ликвидус как точка и как линия (определения).
6. Солидус как точка и как линия (определения).
7. Фигуративная точка, фигуративная линия (определения).
8. Диаграммы состояний I, II, III, IV рода. Для каких сплавов характерна каждая из диаграмм, особенности диаграмм. Уметь показать на каждой из диаграмм ключевые точки и линии (солидус, ликвидус и др.)
9. Диаграммы изменения твёрдости и электрического сопротивления. Уметь изобразить – как изменяются эти свойства для каждого рода диаграмм.