что можно есть при сибр
Что можно есть при сибр
При синдроме избыточного бактериального роста (СИБР) в тонкой кишке и в желудке увеличивается количество бактерий, представляющих нормальную микрофлору. В некоторых случаях в составе микрофлоры могут появляться патогенные микроорганизмы. Такое возможно после различных операций на желудке или кишечнике, при нарушении двигательной активности кишечника или изменении кислотности в желудке.
Изменение качественного и количественного состава микрофлоры нарушает переваривание и всасывание, что вызывает диарею и потерю с калом жиров и витаминов. Из-за недостаточного поступления витамина В12 может развиться анемия.
В диагностике используются дыхательные тесты и бактериологическое исследование кишечного содержимого.
Лечениедолжно быть направлено не только на коррекцию микрофлоры кишечника, но и на патологию, вследствие которой развился СИБР. При отсутствии адекватной терапии симптомы заболевания могут сохраняться в течение длительного времени.
У ослабленных лиц вероятны тяжелая интоксикация и истощение, что может угрожать жизни.
СИБР, синдром тонкокишечного дисбиоза.
Bacterial overgrowth syndrome, BOS,Bacterial overgrowth.
У некоторых пациентов заболевание может долго не проявляться. Наиболее частыми его симптомами являются:
Иногда симптомы заболевания связаны с нарушением всасывания питательных веществ:
Общая информация о заболевании
В обычных условиях в тонкой кишке есть микроорганизмы, составляющие нормальную микрофлору. Они начинают заселять кишечник после нашего рождения и играют важную роль в пищеварении, формировании иммунной системы, в росте и развитии организма.
Основными представителями такой флоры являются лактобактерии, энтерококки, оральные стрептококки и другие грамположительные бактерии.
Микрофлора меняется при состояниях, нарушающих функционирование желудочно-кишечного тракта и ведущих к сбою защитных механизмов. Создаются условия для активного роста некоторых бактерий или присоединения патогенной флоры, что и представляет собой синдром избыточного бактериального роста.
К таким состояниям относятся хронические запоры, последствия оперативных вмешательств на кишечнике, свищи, дивертикулы (мешковидные образования в стенке кишки), что ведет к замедлению двигательной активности и застою кишечного содержимого.
Также условия для распространения микроорганизмов создаются при атрофическом гастрите и в результате длительных частых курсов антисекреторных препаратов, когда среда желудка перестает служить барьером для бактерий.
При врождённой или приобретенной недостаточности ферментов (панкреатите, желчнокаменной болезни) и нарушениях всасывания питательных веществ (воспалении слизистой оболочки кишки – болезни Крона, энтеритах) лишние питательные вещества служат почвой для избыточного роста микроорганизмов.
Также СИБР может развиться на фоне иммунодефицитных состояний (тяжелых хронических заболеваний, инфекции, СПИДа), когда снижается функция клеток иммунной защиты в кишечнике.
Если эти механизмы недостаточно эффективны и состав микрофлоры меняется, перистальтика кишечника усиливается для своевременного удаления лишних бактерий, что приводит к диарее и потере массы тела.
При нарушении состава микрофлоры поражается слизистая оболочка и нарушается функционирование клеток кишечника, ухудшается всасывание питательных веществ: белков, жиров, углеводов, витаминов, микроэлементов. Кроме того, из-за избыточного потребления микроорганизмами витамина В12 возможны анемия (вызванная его недостатком в крови) и изменения со стороны нервной системы. Часто возникает дефицит жирорастворимых витаминов (А, D, Е, К).
Также микроорганизмы препятствуют всасыванию жиров, что приводит к жирному, трудносмываемому стулу.
При недостаточном всасывании селена кожа краснеет и шелушится.
У ослабленных пациентов СИБР вызывает истощение и интоксикацию, что может даже приводить к смертельному исходу.
Кто в группе риска?
В целях диагностики применяются методы исследования кишечного содержимого и дыхательные тесты.
Для выявления нарушения процессов переваривания и всасывания могут быть использованы следующие анализы.
Окончательный диагноз можно поставить с помощью:
Различные дыхательные тесты – увеличение продуктов, выделяемых микробной флорой, в выдыхаемом воздухе свидетельствует о нарушении её состава.
Объем обследования определяется лечащим врачом.
В основе лечения лежит прием антибиотиков широкого спектра действия с возможным последующим переходом на те, к которым чувствительны микроорганизмы, что определяется после бактериологического исследования содержимого кишки.
Также большое значение имеет диета, направленная на обогащение организма питательными веществами. Показан прием препаратов, нормализующих двигательную активность кишечника, противодиарейных и обезболивающих средств.
Рекомендуемые анализы
Low FODMAP: рекомендованная диета при СРК
Low FODMAP: рекомендованная диета при СРК
I. Общая характеристика диеты low FODMAP
Ученые, занимающиеся исследованиями заболеваний органов желудочно-кишечного тракта, установили, что некоторые компоненты пищи могут провоцировать появление симптомов или усиливать их у пациентов с синдромом раздраженного кишечника (СРК), функциональным вздутием живота и некоторыми другими болезнями. К таким компонентам относятся определенные углеводы, которые хорошо расщепляются в кишечнике, однако плохо всасываются или не всасываются вовсе.
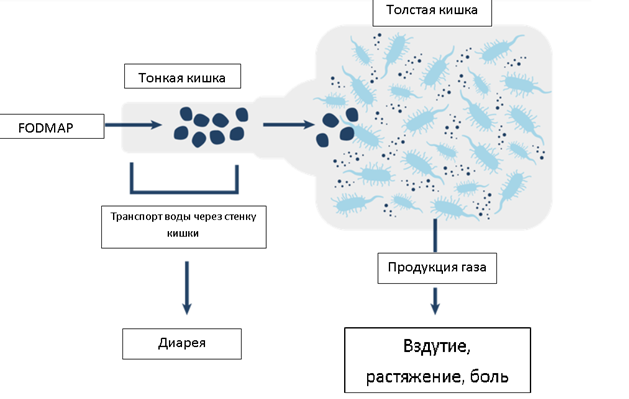
Какие же это углеводы? К ним относятся лактоза, фруктоза, фруктаны, галактаны, а также сахарные спирты. Данные вещества были объединены в группу FODMAP. Акроним FODMAP обозначает группу ферментируемых (F) углеводов – олиго- (O), ди- (D) и моносахаридов (M), а также полиолов (P). Невсосавшиеся углеводы активно перерабатываются бактериями толстой и тонкой кишки с образованием газов. Некоторые из них обладают высокой осмотической активностью, что приводит к перемещению жидкости в просвет кишечника – развивается послабление стула вплоть до диареи (см.рисунок ниже).
Рисунок – вероятный механизм возникновения/усиления симптомов у пациентов с СРК при употреблении пищи, богатой веществами FODMAP.
У здоровых людей симптомы вздутия живота и послабление стула могут развиться при употреблении большого количества углеводов FODMAP. Ярким примером служит диарея после съеденной сливы или черешни в большом количестве. У лиц с СРК порой достаточно небольшого превышения FODMAP веществ в рационе для появления или усиления симптомов. Это, например, наблюдается при наличии у пациента лактазной недостаточности или непереносимости фруктозы.
Лактазная недостаточность во взрослом возрасте – это снижение активности фермента лактазы, которая расщепляет молочный сахар лактозу в просвете тонкой кишки. Вероятность развития лактазной недостаточности увеличивается с возрастом, поскольку снижение активности фермента – это закономерный эволюционный процесс при переходе от грудного вскармливания на взрослый тип питания. Вторичная лактазная недостаточность может наблюдаться при некоторых заболеваниях кишечника инфекционного и воспалительного происхождения. Следствием низкой активности фермента лактазы является плохое расщепление молочного сахара, а употребление продуктов с большим количеством лактозы может привести к появлению описанных выше симптомов.
Непереносимость фруктозы как следствие плохого всасывания этого углевода – нередкая проблема в практике врача-гастроэнтеролога. Фруктоза, как и другие углеводы, всасывается в тонкой кишке, однако возможность усвоения фруктозы в кишечнике человека ограничена. Исследования на здоровых добровольцах показали, что 15 г фруктозы всасывается у 100% лиц, 25 г фруктозы – у 90% испытуемых, однако большую дозу углевода (50 г) могут усвоить лишь 20-30% лиц.
15 г фруктозы (доза, которая хорошо переносится практически всеми здоровыми лицами) – это много или мало? Такое количество фруктозы содержится в 250 г яблок или 300 г груш или 100 г кураги. Следует помнить, что помимо ягод и фруктов, фруктоза в большом количестве содержится в мёде, кукурузном сиропе, а также входит в состав многих промышленных продуктов питания в качестве альтернативы сахарозе.
Помимо лактозы и фруктозы существуют и другие углеводы FODMAP. Фруктаны являются углеводами, содержащимися в таких продуктах как пшеница, лук, чеснок и т.д. Они не подвергаются всасыванию в кишечнике, зато могут служить пищей для бактерий толстой кишки, что приводит к образованию избыточного количества кишечных газов.
Галактаны тоже относятся к углеводам, которые практически не всасываются в кишечнике из-за отсутствия необходимого фермента. Их, в частности, обнаруживают в бобах, красной фасоли и чечевице.
Полиолы или сахарные спирты содержатся в некоторых овощах, фруктах и грибах. Они могут быть в составе некоторых промышленных продуктов питания (ксилит, сорбит, маннитол в «диабетических» продуктах), а также нередко добавляются в жевательные резинки, леденцы от кашля, сиропы (в т. ч. лекарственные).
Поскольку в обычном рационе питания могут содержаться различные вещества FODMAP зачастую невозможно сразу понять, на какой конкретно углевод плохо «среагировал» кишечник. Более того, современная медицина может установить нарушение всасывания только некоторых (не всех!) углеводов FODMAP. Например, для диагностики лактазной недостаточности используется водородный дыхательный тест с лактозой или определение активности фермента лактазы в биоптате двенадцатиперстной кишки (взятом при гастроскопии). Тот же самый водородный дыхательный тест (в этом случае с раствором фруктозы) используется и для диагностики непереносимости фруктозы.
Гипотеза авторов была очень простой: известно, что какой-то из углеводов FODMAP (один или несколько) может вызвать появление или усиление кишечных симптомов. Чтобы доказать это, следует исключить потенциальные раздражители из рациона на некоторое время и оценить симптомы. Если вздутие живота, послабление стула исчезли или значительно уменьшились, значит какой-то из углеводов «виновен» в провокации симптомов. Остается только выяснить, какой именно.
Данная диета чем-то напоминает элиминационную диету у детей с предполагаемой пищевой аллергией, когда из рациона исключают наиболее вероятные продукты-аллергены, а затем постепенно вводят их в рацион с оценкой симптомов. Подобный подход используется и в диете low FODMAP: во время диеты оценивается эффект от исключения из рациона FODMAP углеводов, а затем выявляются продукты-провокаторы.
II. Эффективность диеты low FODMAP при желудочно-кишечных заболеваниях
Диета low FODMAP была оценена у пациентов с некоторыми желудочно-кишечными заболеваниями. Так, у пациентов с СРК соблюдение этой диеты показало снижение выраженности вздутия живота и интенсивности болей в животе по сравнению с обычной диетой и диетой, где содержание веществ FODMAP было высоким [2, 3]. В связи с этим ряд руководств по лечению СРК (например, рекомендации ВОЗ от 2015 года, рекомендации Канадской гастроэнтерологической ассоциации от 2019 года) отмечает эффективность диеты low FODMAP у части пациентов с СРК в отношении вздутия живота и болей в животе.
Крупные исследования диеты low FODMAP у пациентов с функциональным вздутием живота не проводились, однако до 75% больных СРК отмечали снижение выраженности вздутия живота при соблюдении данной диеты. С учетом этих данных, можно предположить, что диета low FODMAP будет не менее эффективной у тех лиц, которые отмечают вздутие живота как единственный симптом.
III. Этапы диеты low FODMAP
Этап 1. Исключение запрещенных продуктов. Необходимо строго соблюдать принципы диеты с исключением из рациона продуктов, богатых веществами FODMAP (перечень «запрещенных» и «разрешенных» продуктов с указанием количества приведен здесь). Период исключения запрещенных продуктов обычно составляет 3-6 недель. Однако при правильном подборе лечебной диеты и ее неукоснительном соблюдении улучшение самочувствия может наблюдаться уже на первой неделе.
Очень важно, чтобы на период исключения запрещенных продуктов рацион оставался разнообразным. Формирование меню в рамках Этапа 1 диеты должно быть основано на принципах рационального питания. Так, например, количество порций овощей в суточном рационе должно быть не менее 5, молока и кисломолочных продуктов (разрешенных диетой) 2-3 порции в день, фруктов – 2 порции, злаков и продуктов из них – 6-7 порций.
Размеры «порции» различается как внутри одной группы продуктов, так и между группами. Например, для большинства овощей одна порция обычно составляет 75 г. В группе молочных продуктов и заменителей молока 1 порция это 1 чашка (250 мл) молока, 3/4 чашки (200 мл) кисломолочных продуктов, 2 кусочка твердого сыра, 1/2 чашки (120 г) мягкого сыра или творога. Одна порция фруктов соответствует в среднем 100-150 г свежих плодов (1 банан, 1 груша, 1 апельсин или 2 мандарина, 2 киви) или 30-40 г сушёных фруктов или 1/2 стакана сока. В группе злаков одна порция это 1 кусок хлеба (40 г), полчашки приготовленных круп и макаронных изделий (75-120 г), 4 столовые ложки хлопьев и мюсли.
Завтрак может включать в себя следующие блюда:
Этап 2. Расширение диеты. В случае достижения эффекта на фоне диетотерапии (исчезновение или значимое уменьшение симптомов заболевания) рекомендуется постепенное введение в рацион продуктов с высоким содержанием веществ FODMAP. На этом этапе уточняются те FODMAP продукты, которые вызывают появление симптомов, а также определяется допустимое количество этих продуктов в рационе. При отсутствии эффекта от диеты low-FODMAP (в случае ее строгого соблюдения в течение 6 недель) пациент может вернуться к привычному рациону питания после консультации лечащего врача. Если эффект от диеты наступил до того, как истёк запланированный врачом срок (например, через 3 недели вместо 4-6), расширение диеты можно начать раньше.
Это наиболее важный этап диетотерапии. Решение вопроса о переходе на второй этап принимается после консультации с лечащим врачом, назначившим диету. Правильно выполненное расширение рациона позволит подобрать хорошо переносимые продукты. Что значит правильно? Попробуем разобраться.
Как было сказано выше, к веществам FODMAP относятся 5 разных углеводов. В некоторых продуктах содержится только один вид углеводов (например, в молоке присутствует только лактоза), в других – сразу несколько (ярким примером является арбуз, содержащий фруктозу, фруктаны и маннитол). Для того, чтобы установить реакцию на определенный углевод FODMAP, целесообразно сперва расширять рацион за счет продуктов, содержащих только один из перечисленных углеводов. Например, начать с молочных продуктов, чтобы исключить непереносимость лактозы. Затем – с мёда (источник фруктозы). Маннитол содержится в грибах, сорбитол – в свежем авокадо и персике. Фруктаны помимо некоторых фруктов (дыня и т.д.) являются единственным FODMAP углеводом в свежем репчатом и красном луке и чесноке. Галактаны присутствуют в значительном количестве в миндальном орехе.
Обычно при плохой переносимости определенного углевода (лактозы, фруктозы и т.д.) схожие симптомы будут наблюдаться и при употреблении в пищу других продуктов, содержащих этот углевод.
Не стоит начинать расширение диеты с продуктов, содержащих несколько углеводов. Например, яблоко содержит фруктозу и сорбитол, поэтому при появлении симптомов невозможно будет уточнить, на какой именно углевод так реагирует кишечник.
На введение одного продукта отводится 3 дня.
День 1 – употребление маленькой порции продукта. Поскольку реакция на углеводы FODMAP может отличаться у разных пациентов и обычно зависит от их количества, рекомендовано начать с половины рекомендованной порции. Это может быть, например 100 мл йогурта. Поскольку йогурт содержит лактозу, то в данном случае оценивается переносимость лактозы. Если симптомы (вздутие живота, послабление стула, усиление болей в животе) появились после употребления 100 мл йогурта, это может свидетельствовать о непереносимости даже маленького количества лактозы. Следует попробовать другой продукт с тем же самым углеводом через 3 дня. Если симптомы при употреблении маленькой порции отсутствуют, следует продолжить оценку переносимости обычной порции продукта на 2-й день.
День 2 – употребление стандартной порции продукта. Размеры стандартной порции для овощей, фруктов, злаков и молочных продуктов были описаны выше, более подробная информация представлена в таблицах с продуктами. Во второй день следует употребить в пищу стандартную порцию (например, 200 мл йогурта) с оценкой симптомов. При появлении вздутия живота, усиления болей в животе, послабления стула или других неприятных ощущений проба в день 3 не проводится. Через 3 дня можно попробовать другой продукт с тем же самым углеводом.
День 3 – употребление большой порции продукта. При хорошей переносимости обычной порции, можно оценить переносимость большего количества продукта на третий день. Например, выпить 400 йогурта за один прием пищи (двойная порция). Наличие симптомов будет свидетельствовать о том, что такое большое количество не следует употреблять в пищу. При отсутствии симптомов через три дня следует оценить переносимость других продуктов из той же группы. Например, для оценки переносимости лактозы это может быть творог, сметана, сливки, молоко (коровье, козье).
Каждый новый продукт оценивается по указанной выше схеме (день 1-2-3). Если пациент хочет установить точное количество продукта, который он может переносить (например, что будет при употреблении в пищу 50 мл йогурта?), то такую оценку можно провести дополнительно. Между пробами с двумя разными продуктами должно пройти 3 дня для того, чтобы полностью исключить влияние предыдущего теста на последующий.
После анализа переносимости различных продуктов внутри одной группы (например, группы молока и кисломолочных продуктов), можно перейти к оценке других углеводов. Попробуйте провести пробу на переносимость фруктозы с мёдом и манго. Следующей группой продуктов для оценки выберите, например, чечевицу, фундук и миндальный орех (содержат только галактаны). Гранат, грейпфрут, дыня и некоторые другие фрукты, чеснок и репчатый лук помогут оценить переносимость фруктанов. Сорбитол содержится в персике, абрикосе, авокадо, ежевике. Маннитол в большом количестве содержится в грибах (шампиньоны, белые грибы), а также в цветной капусте.
Далее можно будет провести оценку переносимости продуктов со сложным углеводным составом (могут содержать 2-3 углевода FODMAP). Принцип тестирования тот же самый: день 1-2-3.
Записывайте свои симптомы после проведения пробы с новыми продуктами и разными порциями этих продуктов!
Наименование продукта
День теста
Симптомы после употребления продукта в пищу
Избыточный бактериальный рост в тонкой кишке, патофизиология и вопросы терапии
Рассмотрены клинические проявления синдрома избыточного бактериального роста (СИБР) в тонкой кишке и терапия СИБР, направленная на коррекцию факторов риска развития заболевания и проведение адекватной антибиотикотерапии.
Clinical manifestations of small intestine bacterial overgrowth (SIBO) are viewed. Therapy is targeted at correction of the risk factors that predispose to SIBO and providing appropriate antibiotic therapy.
Желудочно-кишечный тракт (ЖКТ) является местом обитания огромного количества бактерий, общая масса которых превышает 1 кг. Это сообщество можно рассматривать как самостоятельный орган — микробиом, выполняющий множество жизненно важных функций для человека [1]. Состав микрофлоры каждого биотопа пищеварительного тракта является постоянным, что связано со способностью микроорганизмов фиксироваться к строго определенным рецепторам эпителиальных клеток слизистой оболочки (СО). В СО тонкой кишки имеются рецепторы для адгезии только аэробных бактерий, в то время как в толстой кишке преобладают рецепторы для фиксации анаэробных штаммов [2]. Количественные и качественные колебания состава микробиоты определяются возрастом человека, характером его питания, образом жизни, эпидемиологическими особенностями региона проживания, временем года и даже временем суток [3, 4].
В двенадцатиперстной, тощей и начальных отделах подвздошной кишки общее число бактерий составляет 10 2 –10 4 колониеобразующих единиц на 1 г содержимого (КОЕ/г), которые локализуются преимущественно пристеночно. Важно отметить, что в данном биотопе практически отсутствуют облигатно анаэробные бактерии, а также представители семейства энтеробактерий и, в первую очередь, кишечная палочка. В дистальных отделах тонкой кишки концентрация микроорганизмов возрастает и составляет 10 5 –10 9 КОЕ/г, появляются анаэробные бактерии (бактероиды, бифидобактерии и др.). Толстая кишка является основным местом обитания нормальных кишечных бактерий, содержание которых составляет 10 11 –10 12 КОЕ/г, что приблизительно равно 1/3 сухой массы фекалий. В данном биотопе обнаруживаются бактероиды, бифидобактерии, энтерококки и клостридии, лактобациллы, кишечные палочки, стрептококки, стафилококки, кандиды и ряд других бактерий. В последнее время с использованием молекулярно-генетических методов было показано, что микробиота кишечника включает около 400 различающихся между собой типов бактерий, большинство из которых относятся к родам Firmicutes и Bacteroides, объединенных в три различных энтеротипа, и требуются дальнейшие исследования для уточнения их структуры и функции [5].
Нормальные кишечные бактерии не проникают во внутреннюю среду организма благодаря существованию барьерной функции слизистых оболочек ЖКТ. Кишечная цитопротекция включает преэпителиальный, эпителиальный и постэпителиальный защитный слизистый барьер. Основными компонентами преэпителиального защитного барьера являются слизь, связанные с гликопротеинами слизи иммуноглобулины А1 и А2; гликокаликс, ряд низкомолекулярных кишечных метаболитов, обеспечивающих резистентность эпителия в отношении условно-патогенных и частично патогенных микроорганизмов, а также некоторых химических агентов. Эпителиальный (внутренний) защитный барьер включает апикальные клеточные мембраны и тесные межклеточные соединения, блокирующие пассаж в клетку макромолекул и препятствующие их межклеточному проникновению. В состав постэпителиального барьера входит кровоток, обеспечивающий фагоцитоз, гуморальные иммунные реакции и другие механизмы защиты, а также функционирование преэпителиального и эпителиального барьеров [6, 7].
Микробиом ЖКТ выполняет ряд важных функций в организме человека, включая повышение колонизационной резистентности СО в отношении условно-патогенных и патогенных бактерий, синтез витаминов, метаболизм желчных кислот, деградация ксенобиотиков, поддержание энергетического гомеостаза и др. [8]. Безусловно, при нарушении нормального состава кишечных бактерий в различных биотопах нарушаются функции микробиома ЖКТ, с развитием клинических симптомов и метаболических последствий, а также с транслокацией бактерий во внутреннюю среду.
Одним из наиболее частых и клинически значимых нарушений микробиоты кишечника является избыточный рост как нормальных для данного биотопа бактерий, так и бактерий толстой кишки, а также условно-патогенных бактерий в проксимальном отделе тонкой кишки. Это нарушение, при наличии у пациента соответствующих симптомов, принято обозначать современным термином «синдром избыточного бактериального роста» (СИБР) в тонкой кишке, вместо используемых ранее «синдром слепой петли», «синдром приводящей петли» и др. [9].
В организме здорового человека имеется многофакторные механизмы, предупреждающие избыточный бактериальный рост в кишечнике, основными из которых являются соляная кислота желудка, которая ингибирует или разрушает проглоченные микроорганизмы, и очистительный эффект кишечной моторики. Другие важные защитные факторы включают наличие иммуноглобулинов в кишечном секрете и интактный илеоцекальный клапан [10, 11]. Основные факторы риска развития избыточного бактериального роста представлены в табл. 1.
Следует отметить, что дисбиоз кишечника, включая избыточный бактериальный рост в тонкой кишке, не является самостоятельным заболеванием, но сопровождается развитием ряда симптомов и синдромов, которые вносят свою лепту в клиническую картину болезней, на фоне которых он формируется. В то же время в последние годы доказана этиологическая роль кишечного дисбиоза в развитии ряда заболеваний, включая некротизирующий энтероколит, язвенный колит, антибиотик-ассоциированную диарею, ожирение, атопические заболевания, в частности бронхиальную астму [13].
Клинические проявления СИБР складываются из местных (кишечных) симптомов, а также системных нарушений, обусловленных транслокацией кишечных бактерий и их токсинов во внутреннюю среду макроорганизма, нарушением процессов всасывания, иммунологическими расстройствами и др. Местные симптомы СИБР включают абдоминальную боль, метеоризм, диарею, падение массы тела, а при микробной контаминации двенадцатиперстной кишки (ДПК) появляется горечь во рту, чувство быстрого насыщения, мучительная тошнота. При пальпации определяются болезненность, урчание и шум плеска по ходу ДПК и петель тонкой кишки. Нередко, преимущественно при транслокации кишечных бактерий за пределы кишки и при развитии реактивного мезаденита, выявляется выраженная болезненность при пальпации в зоне дуоденоеюнального изгиба (слева выше пупка) и по ходу брыжейки тонкой кишки. Патогенетической основой формирования большинства местных клинических проявлений СИБР является мальабсорбция, обусловленная метаболическими эффектами размножающихся бактерий и повреждением энтероцитов. При морфологическом исследовании слизистой оболочки тонкой кишки при СИБР выявляется характерная микроскопическая картина в виде уплощения ворсинок, структурных повреждений щеточной каймы энтероцитов, нарушений целостности эпителиоцитов и наличия воспалительного инфильтрата в собственной пластинке.
При СИБР отмечается снижение содержания и активности внутрипросветных и пристеночных ферментов за счет их разрушения бактериями, падения внутрикишечного уровня рН, снижения их концентрации в результате разведения кишечного содержимого, что сопровождается развитием мальдигестии, а при наличии структурных повреждений энтероцитов и мальабсорбции основных ингредиентов пищи. Одним из наиболее частых последствий является формирование дисахаридазной недостаточности вследствие повреждения щеточной каемки энтероцитов. В результате данные углеводы расщепляются ферментами бактерий до короткоцепочечных органических кислот, которые повышают осмолярность кишечного содержимого и снижают внутрипросветный уровень рН, что приводит к задержке жидкости в просвете кишки и развитию осмотической диареи, которая уменьшается или купируется после 24- или 48-часового голодания.
Наличие большого количества бактерий в проксимальных отделах тонкой кишки приводит к преждевременной бактериальной деконъюгации желчных кислот, с которой связано не только нарушение гидролиза и всасывания жира, но и стимуляция интестинальной секреции воды и электролитов, а также химические повреждения СО кишечника [2, 14]. В результате развивается секреторная диарея, которая не купируется после 24-часового голодания, и могут выявляться признаки воспаления и эрозии в СО ДПК и тонкой кишки. Значительно реже, как следствие мальабсорбции жиров, может возникать дефицит жирорастворимых витаминов (витамины А, D, Е, К). Утилизация бактериями пищевых белков, снижение уровня олигопептидаз с последующим нарушением образования и всасывания аминокислот, а также формирование катаболической энтеропатии в результате повреждения СО кишки лежат в основе мальабсорбции протеинов [12, 15].
Транслокация кишечных бактерий — явление, часто обнаруживаемое при СИБР. К факторам риска ее развития относятся присутствие условно-патогенных микроорганизмов и их токсинов; прием нестероидных противовоспалительных препаратов, глюкокортикостероидов, цитостатиков, нарушающих основные механизмы преэпителиальной защиты и снижающих иммунологическое звено защитного барьера; нарушение кровотока (абдоминальная ишемия, портальная гипертензия) и целостности слизистой оболочки кишечника и др. [7, 16]. Основными органами-мишенями, которые вовлекаются в патологический процесс при транслокации кишечных бактерий, являются лимфатические узлы (развитие мезаденитов и наличие лимфангиэктазий СО кишки, например, «симптом манной крупы» в СО ДПК); мочевыводящая система (возникновение бактериурии, острых и хронических пиелонефритов, мочекаменной болезни); печень и билиарная система (формирование неалкогольного стеатоза, стеатогепатита и даже цирроза печени, а также воспалительных процессов внепеченочного билиарного тракта). Большое значение придается циркуляции в крови и накоплению в тканях бактериальных токсинов, что вызывает активацию гуморальных иммунных реакций и формирование перекрестной иммунологической реактивности с развитием полиартралгий, реже — реактивных артритов, миалгий, аллергических дерматозов, пищевой псевдоаллергии.
Определенная роль в формировании клиники СИБР отводится развитию полигиповитаминозов и нарушению обмена макро- и микроэлементов. Так, у значительной части пациентов с наличием СИБР выявляется снижение в сыворотке крови уровня витамина В12, обусловленное преждевременным отщеплением его от внутреннего фактора и утилизацией анаэробными кишечными бактериями, и высокое содержание фолатов, связанное с повышенным бактериальным синтезом [12].
Для выявления СИБР используются микробиологические методы (посевы полостной и пристеночной микробиоты ДПК и тонкой кишки), водородный дыхательный тест с различными субстратами (глюкоза, лактулоза и др), определение аэробных и анаэробных бактерий и грибов и их метаболитов в различных биологических средах с использованием газовой хроматографии и масс-спектрометрии, полимеразная цепная реакция для выявления в крови бактериальных ДНК и РНК при транслокации кишечных бактерий [8]. Определенная роль в диагностике СИБР отводится положительному терапевтическому эффекту на прием антибиотиков [12].
Целью терапии СИБР является купирование клинических проявлений и связанных с ним метаболических расстройств. Лечебные мероприятия при СИБР включают: 1) воздействие на этиологические факторы развития СИБР; 2) в случае невозможности ликвидировать факторы риска формирования СИБР проведение курсов антибактериальной терапии; 3) восстановление нормальной моторики тонкой кишки; 4) нутритивная поддержка у пациентов с дефицитом массы тела и гиповитаминозами [16]. Несмотря на то, что ликвидация факторов риска развития СИБР кажется оптимальным направлением в ведении данных пациентов, практически лишь у незначительной части из них этого возможно достигнуть. Как правило, указанные выше факторы сохраняются пожизненно, что лежит в основе рецидивирования или персистенции симптомов и метаболических последствий СИБР.
Ведущая роль в терапии СИБР отводится антибиотикам, назначение которых преследует цель не стерилизации тонкой кишки, а модификации состава тонкокишечных бактерий, максимально приблизив его к норме. Антибактериальная терапия должна быть направлена на удаление грамнегативных и анаэробных бактерий. Подход к назначению антибактериальных средств в основном эмпирический, но в то же время необходимо учитывать, что при избыточном бактериальном росте в тонкой кишке и при транслокации бактерий за пределы кишечника приоритетными являются всасывающиеся, а при нарушении микробиоты толстой кишки — невсасывающиеся препараты. С этой целью используются несколько групп антибиотиков, которые представлены в табл. 2.
Продолжительность курса антибактериальной терапии составляет 7–10 дней. Повторные курсы терапии проводятся при рецидивировании симптомов СИБР со сменой препаратов в очередном курсе [12].
Что касается пробиотиков и пребиотиков, то назначение их при толстокишечном дисбиозе является, несомненно, обоснованным, в то же время при СИБР — спорным. Вероятнее всего, любое увеличение бактериальной нагрузки в тонкой кишке является нежелательным у пациентов с наличием факторов риска развития СИБР, не говоря о больных с уже имеющимся СИБР. Проведенные исследования эффективности терапии пробиотиками при СИБР не выявили положительных результатов — как ближайших, так и отдаленных [17]. Одновременно с антибактериальной терапией необходимо парентеральное введение витаминов для коррекции их дефицита, а также проведение лечебных мероприятий, для купирования электролитных нарушений.
Прокинетические средства, назначение которых препятствует избыточному бактериальному росту в тонкой кишке, являются важным дополнением к антибиотикотерапии СИБР. Исследования, проводимые на животных, подтвердили, что прокинетики, в частности цизаприд, снижают избыточный рост бактерий в тонкой кишке [18], однако в связи с токсичностью данный препарат в настоящее время не используется. В то же время у значительной части пациентов с СИБР моторные нарушения носят разнонаправленный характер. При этом наблюдается значительное многообразие сочетаний гипер- и гипокинетических дискинезий в различных отделах пищеварительного тракта, что создает значительные трудности в выборе адекватной терапии, когда для нормализации моторных нарушений в одной зоне требуется спазмолитик, а в другой — прокинетик. Наиболее частыми сочетанными нарушениями при СИБР являются гипомоторная дискинезия двенадцатиперстной и тонкой кишки со спазмом сфинктера Одди и/или спастической дискинезией толстой кишки. Для купирования сочетанных моторных нарушений и связанного с ними болевого синдрома перспективным является использование препаратов, способных нормализовать моторику, независимо от ее исходного состояния, а также влияющих на висцеральную чувствительность ЖКТ и участвующих в антиноцецептивных механизмах контроля боли. В данной ситуации особое место принадлежит тримебутину (Тримедату), обладающему уникальными фармакологическими свойствами. Тримебутин, являясь агонистом периферических µ-, δ- и κ-опиоидных рецепторов, расположенных на гладкомышечных клетках и ганглиях энтеральной нервной системы (ЭНС), в зависимости от исходной функциональной активности миоцитов оказывает спазмолитическое или прокинетическое действие, а также восстанавливает функциональную активность интерстициальных клеток Каяла, которые выполняют функцию водителя собственного, автономного физиологического ритма гладкомышечных волокон ЖКТ. Так, при гиперкинетических состояниях препарат связывается с κ-рецепторами, блокирует возбуждающие импульсы нейронов ЭНС и угнетает моторику ЖКТ. При гипокинетических нарушениях тримебутин имеет тропность к µ- и δ-рецепторам, что приводит к блокаде тормозных стимулов из нейронов ЭНС и, как следствие, стимуляции моторики органов пищеварения [19]. В терапии СИБР показано курсовое назначение тримебутина по 200 мг 3 раза в день не менее 30 дней.
С практических позиций наиболее целесообразной является представленная ниже схема ведения пациентов с СИБР, которая согласуется со стандартами, предложенными рядом других авторов [12, 16, 20, 21].
Примерная схема ведения пациентов с СИБР:
Таким образом, при ведении пациентов с наличием СИБР следует учитывать, что воздействие на этиологический фактор у многих пациентов остается невыполнимой задачей. Большинство предрасполагающих состояний являются труднообратимыми, а чаще совсем необратимыми. Поэтому, как и при других хронических состояниях, лечение СИБР должно быть многофакторным и, как правило, длительным, сконцентрированным, в первую очередь, на эрадикации бактерий, нормализации моторики кишечника и коррекции проявлений мальнутриции.
Литература
* ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
** ФГБУ КБ УД Президента РФ, Москва

.gif)
.gif)